重组腺相关病毒的生产主要基于三质粒(核心质粒pAAV-GOI/shRNA、血清型质粒pAAV-RC、辅助质粒pHelper)共转染HEK293T细胞。包装细胞反式提供rAAV的结构蛋白Cap及功能蛋白Rep,并在辅助质粒pHelper的帮助下,高效地将带有ITR的目的DNA片段包装到包装到rAAV病毒颗粒中。
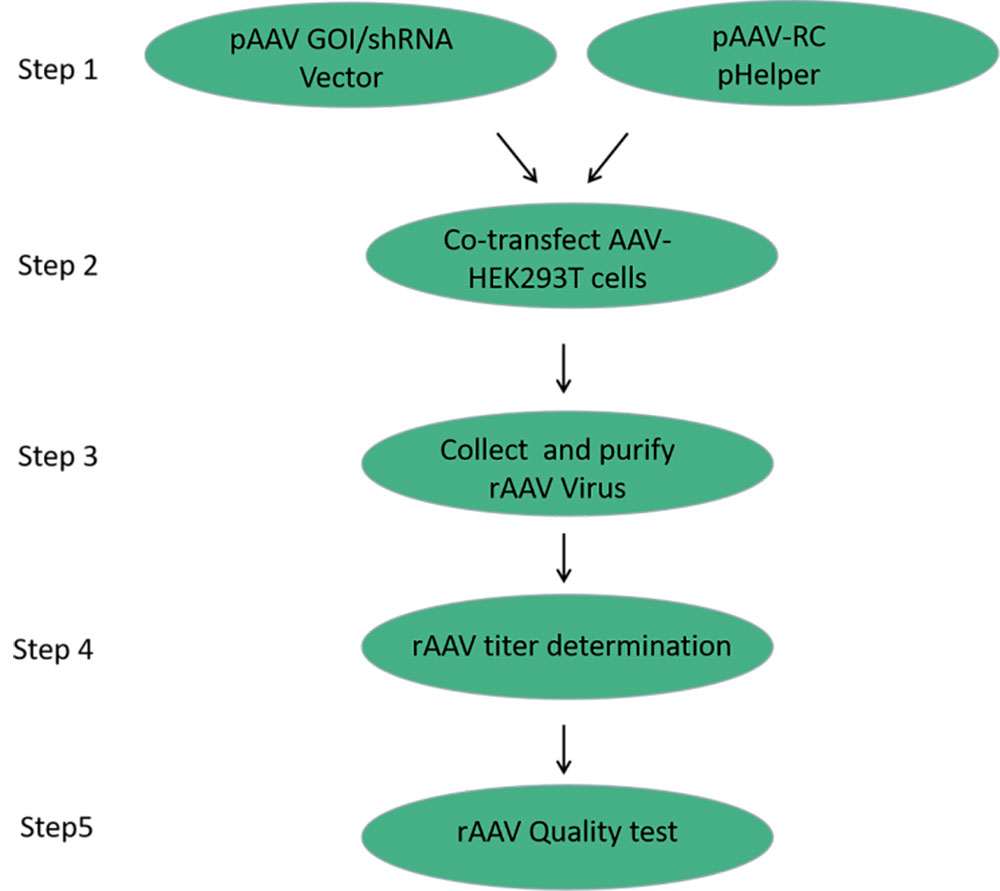
图1 rAAV的生产流程
1)根据实验目的和受试细胞选择不同的rAAV载体。一般通过简单酶切-连接-转化-测序的方式将目的基因克隆至rAAV表达载体,并验证载体表达功能。
2)为了获得高质量、高浓度且低内毒素含量的质粒,通过柱离心法及去内毒素试剂进行质粒DNA纯化。
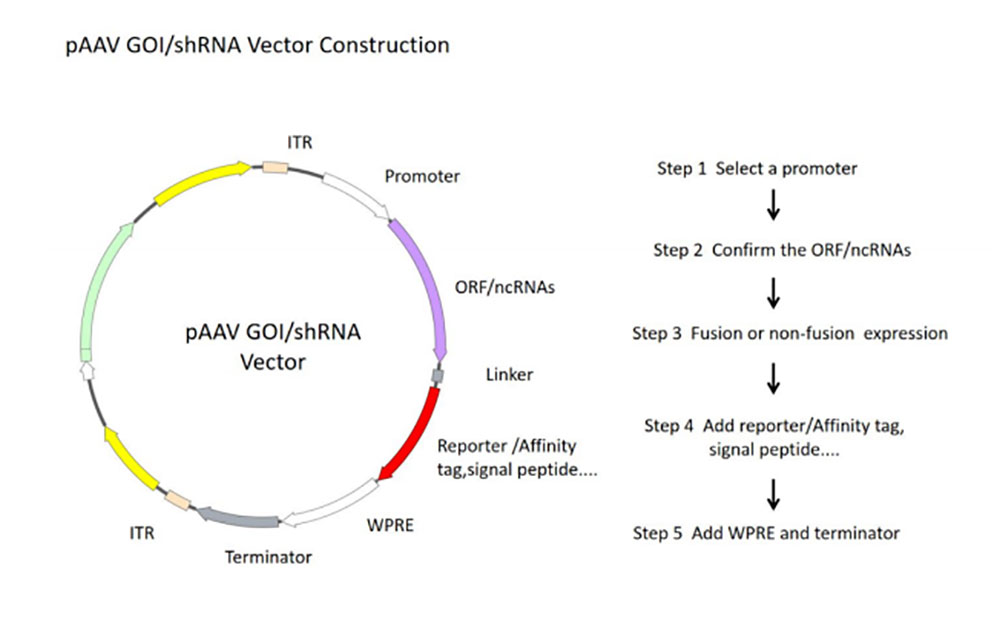
图2 rAAV核心质粒构建流程图
从液氮灌中取出冻存细胞,迅速放入37℃水浴锅中复苏,离心后向细胞中加入新鲜培养基,37℃、5%CO2条件下培养,每2-3天进行细胞传代;待细胞生长正常后转入10cm的培养皿中贴壁培养备用。
当细胞密度达到约80~90 %的汇合率即可进行转染,将转染三质粒体系按照一定比例配置后,按照每皿1000μL体系进行转染及培养。
培养一天后,通过显微镜观察细胞转染情况。一般情况下需转染效率在80%以上,转染率过低会导致病毒产量下降。
培养72hr后,收集病毒上清。将病毒培养上清液低温离心去除细胞碎片,并加入适量核酸酶,37℃去除游离的核酸,然后加入PEG8000/NaCl溶液过夜聚沉。
将聚沉的病毒用PBS进行重悬并置于超速离心机进行密度梯度离心;离心后,抽取病毒对应层的溶液,利用透析袋进一步4℃透析过夜;第二天将透析液0.22um过滤,并通过浓缩管进行浓缩和清洗,达到除杂和浓缩的目的。
腺相关病毒的质量主要包括滴度检测、纯度检测、无菌检测、支原体检测及内毒素检测。