慢病毒载体(lentivirus vector,LV)属 于 逆 转 录 病 毒 科 (Retrovidae),为 RNA病毒。区别一般的逆转录病毒载体,它对分裂细胞和非分裂细胞均具有感染能力。慢病毒载体的研究发展得很快,研究的也非常深入。该载体可以将外源基因有效地整合到宿主染色体上,从而达到持久性表达。
感染能力方面可有效地感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,从而达到良好的的基因治疗效果,在美国已经开展了临床研究,效果非常理想,因此具有广阔的应用前景。
慢病毒与其他病毒工具比较,具有以下优势:
将1μl siRNA实验组病毒(AAV2/8/SMVEGF-2;n=12)或对照载体(AAV2/8/gfp;n=14)注入C57BL/6小鼠的视网膜下腔。1week后,用半导体激光在每只眼的视神经周围制造4个不同的脉络膜烧伤,诱导脉络膜新生血管(CNV)。2week后,摘除眼睛进行视网膜平贴制剂CNV分析。
结果显示,视网膜下注射AAV2/8/SmVEGF-2与AAV8/GFP相比,激光损伤区的CNV显著减少(1597.3±2077.2比5039.5±4055.9µm(2);P<0.05)。使用酶联免疫吸附试验,我们发现AAV2/8/SmVEGF-2治疗组的VEGF水平降低了大约一半。
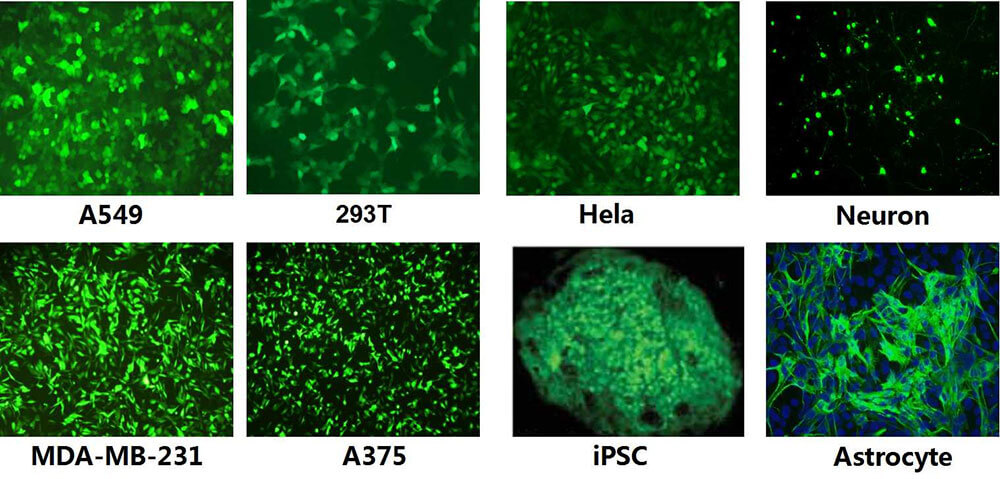
图1. 慢病毒可以高效的感染各类肿瘤细胞、干细胞、原代细胞、和不分裂的细胞
神经元细胞感染表达b-Catenin小发夹RNA (shRNA)的慢病毒,使大部分神经元敲除b-Catenin。b-Catenin敲低后,神经元细胞棘突稳定性受到破坏。
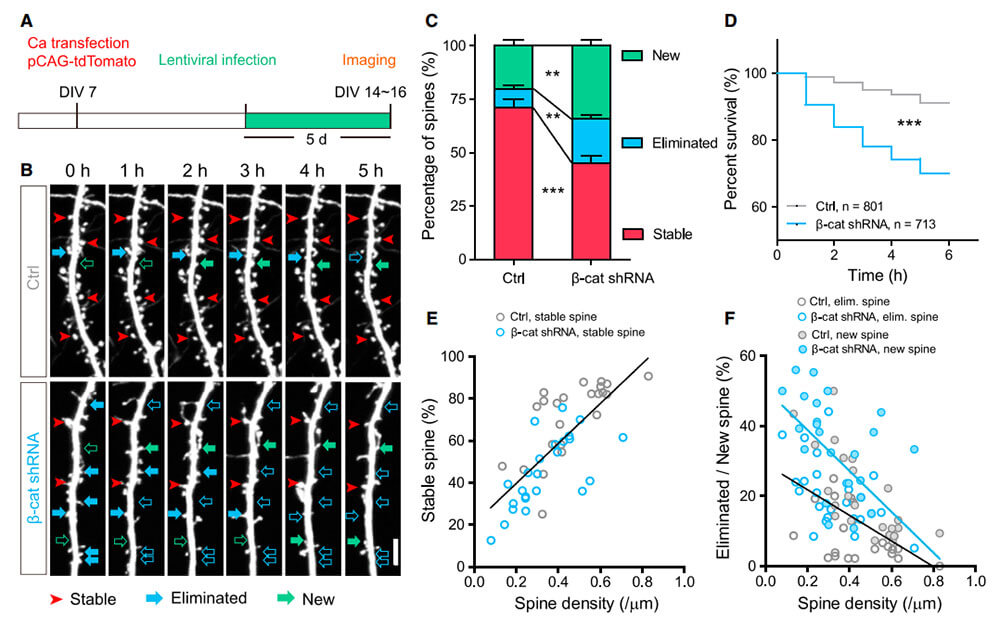
图2. 慢病毒携带shRNA介导b-Catenin敲减(Li MY et al., Neuron, 2017)
将LV-shRNA病毒注射到新生P1小鼠的硬脑膜和皮质层P1的间隙(e.f),P15小叔中观察到GFP+主要分布在L1,在深层的分布较少。
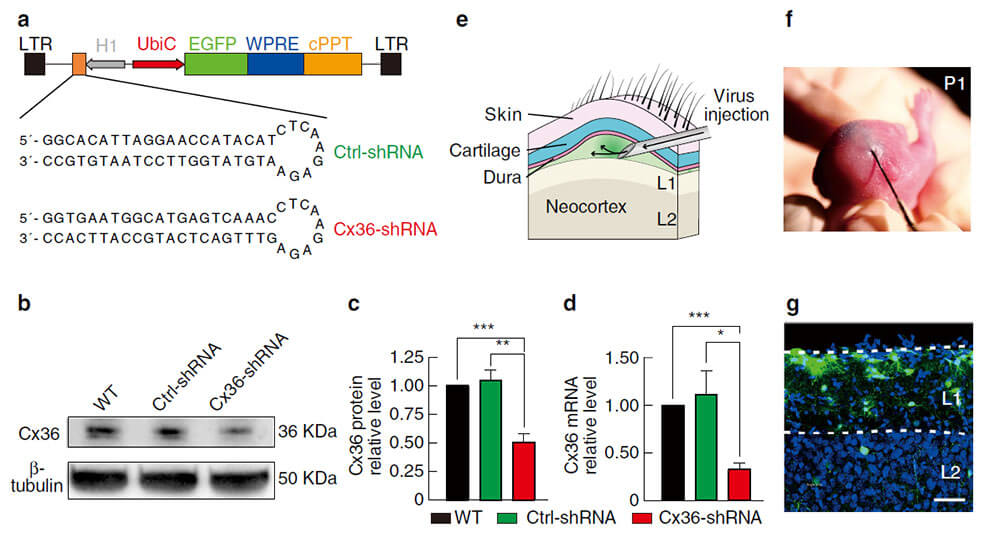
图3. 诱导型慢病毒shRNA有效介导Connexin36敲减 (Xinghua Yao et al.,Nat Commun,2017)
慢病毒可以携带光感基因(ChR2、eNpHR3.0等)感染神经元细胞,实现靶基因的高效表达。
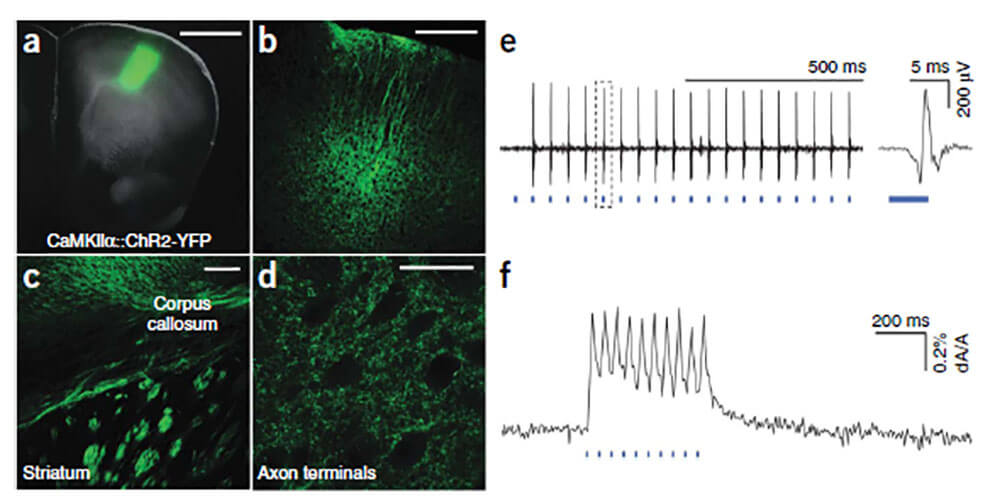
图4. LV携带光敏基因的应用(Feng Zhang, Viviana Gradinaru., et al. Nature protocols,2010)