单纯疱疹病毒(herpes simplex virus,HSV)是目前在临床使用最广泛的溶瘤病毒(oncolytic virus,OV)之一。HSV为双链DNA病毒,可编码84种不同多肽,其基因组长为152Kb。HSV基因组由两个独特的序列组成:长节段(Unique Long(UL))和短节段(Unique Short(US)),两端为末端反向重复序列,以内部反向重复序列连接。
HSV病毒基因按照其表达的时序性分为三个类别:早期或α基因、中期或β基因、晚期或γ基因。这些溶瘤基因编码蛋白可促进病毒的复制并引发宿主免疫反应[1]。其中,α基因的主要功能是调节β和γ基因的转录。DNA复制后,γ基因主要编码病毒粒子结构成分。病毒DNA复制和蛋白质合成导致癌细胞裂解,随后,子代病毒被释放以感染相邻的癌细胞,扩大对癌症的杀伤能力。
HSV可以通过局部(腹膜或胸膜灌注和肿瘤内注射)和全身途径(血管传递)发挥作用。肿瘤内注射可限制其只传送到肿瘤部位。一些物理障碍如细胞外基质和针对HSV的宿主免疫应答反应会抑制病毒复制。
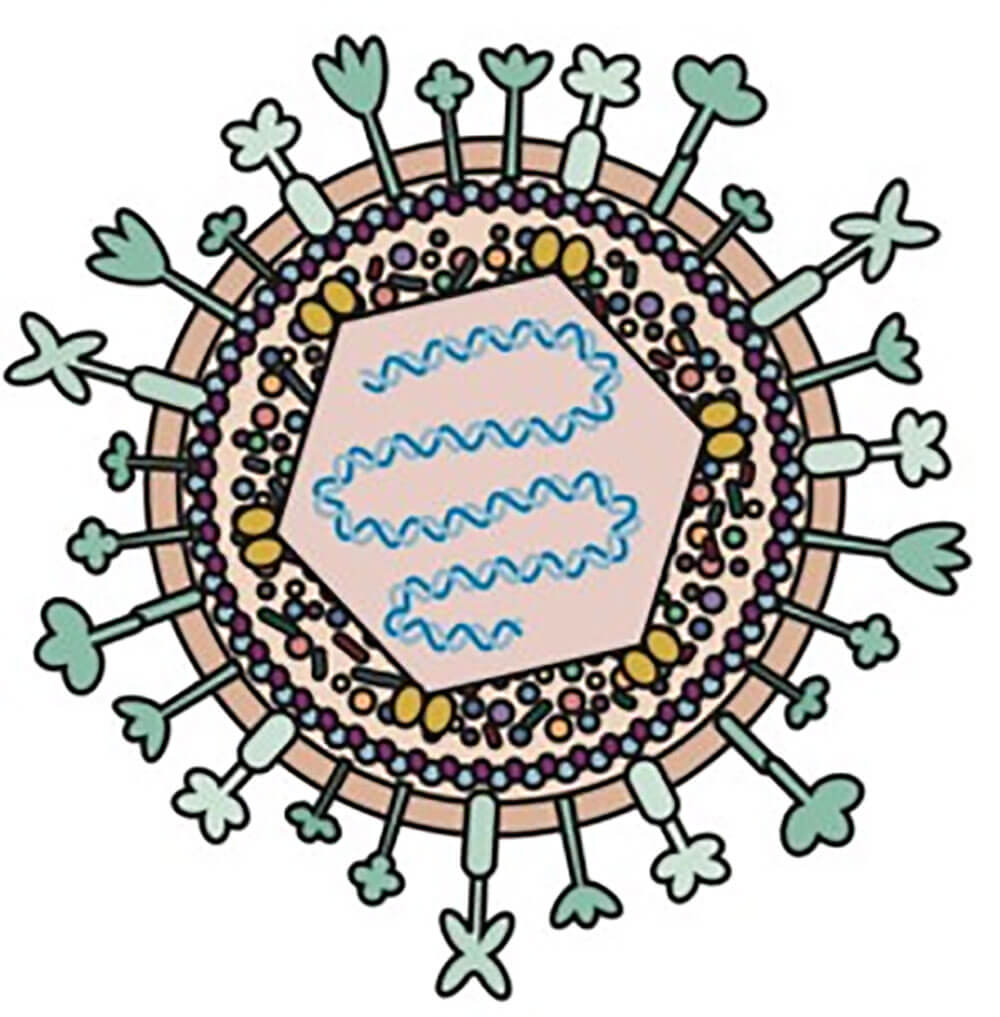
图1、单纯疱疹病毒1型(HSV-1)模式图
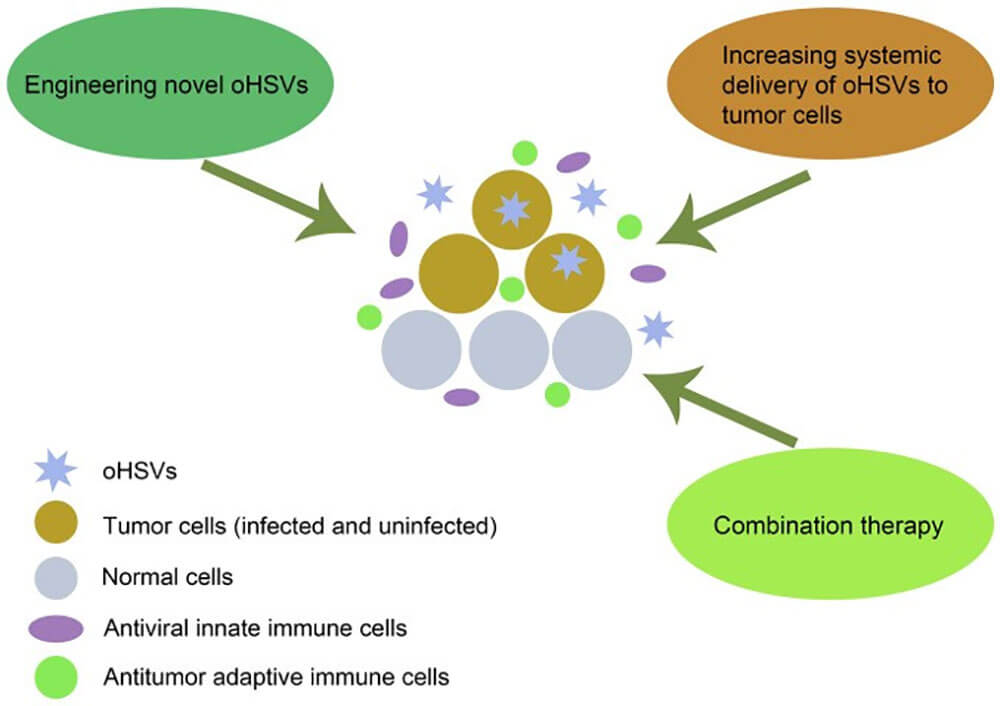
图2:oHSVs破坏肿瘤细胞的破坏机制示意图及提高其疗效的多种策略 doi:10.3892/ol.2021.12771
2015年,经美国食品和药物管理局(FDA)批准,用于治疗黑色素瘤的talimogene laherparepvec(T-VEC)是对HSV-1基因改造后形成的有效临床治疗药物,也是OV应用于临床的重大突破[5-6]。T-VEC的正式名称为OncovexGM-CSF,是HSV-1的基因工程改造毒株,其缺失了两个拷贝的ICP34.5基因和ICP47编码基因,插入了人粒细胞集落刺激因子(granulocyte-macrophage colonystimulating factor,GM-CSF)编码基因。OncovexGM-CSF通过直接肿瘤溶解和诱导肿瘤特异性再次免疫应答发挥抗肿瘤作用,包括增强抗原特异性T细胞应答、抑制CD4+Tregs、CD8+Ts和骨髓来源的抑制性免疫细胞(MDSCs)的水平[7]。针对不可切除的晚期黑素瘤患者(OPTIM临床试验)III期临床试验,在晚期黑色素瘤的III期临床试验中,OncovexGM-CSF的客观反应率为26%,持续的反应率为16%,完全缓解率为11%[8]。
2021年,第三代溶瘤性单纯疱疹病毒载体G47Δ被日本厚生劳动省(WHLW)批准用于治疗胶质瘤。为提高其抗肿瘤活性,敲除了ICP34.5基因以消除病毒的神经毒性,敲除了312bp的α47基因以提高病毒的复制和繁殖能力[9-10]。同时,将ECOL-I LacZ基因插入ICP6(UL39)区域使核苷酸还原酶(RR)失活,让病毒仅在肿瘤细胞中繁殖,从而改善其溶瘤作用。G47Δ在多种癌症中显示出很强的复制能力,有效诱导特异性抗肿瘤免疫,并显示出高安全性[11]。G47Δ可以非常有效地杀死癌细胞。在一项涉及复发性胶质瘤患者的II期临床试验中,每例患者接受肿瘤立体定向注射G47Δ,每4周一次,最多6次,临床试验数据的中期分析显示,13例患者的1年生存率为92.3%。相关的严重不良事件仅有2例患者且均为2级发热。G47Δ被日本政府指定为SAKIGAKE(突破性疗法)产品,并进一步指定为恶性胶质瘤孤儿药,这是继T-VEC之后第二种获批的溶瘤单纯疱疹病毒药物,也是世界上首个获批用于治疗恶性胶质瘤的OV药物[10]。
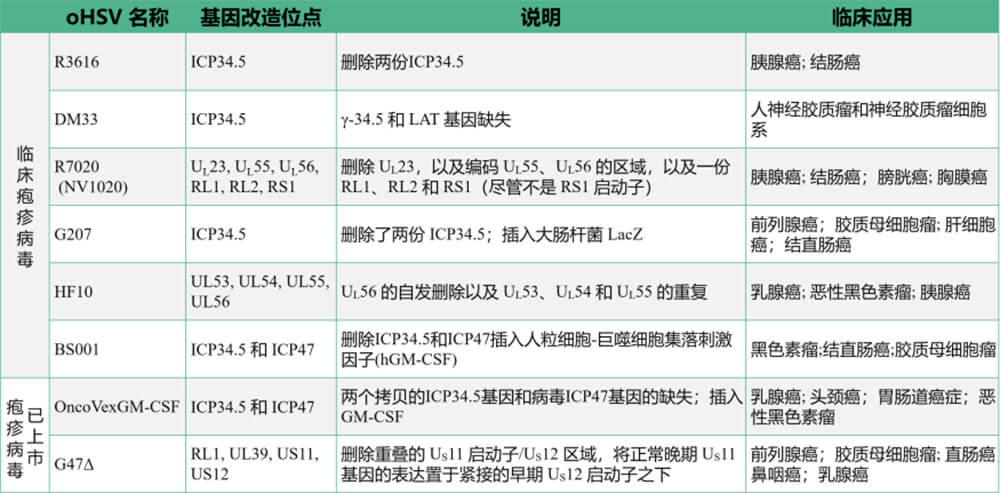
表1:已上市及临床的疱疹病毒
目前处于临床研究中的oHSV主要以1型为主,2型oHSV也显示出较强的研究潜力,已有公司开始布局。
R3616是HSV-1(F)衍生重组病毒,缺失两个拷贝的ICP34.5基因 [12]。宿主蛋白激酶R(protein kinase R,PKR)感应各种应激源如病毒dsRNA,阻止病毒蛋白质的合成。ICP34.5的功能之一是介导eIF2a的去磷酸化,解除蛋白合成抑制。因此,R3616靶向以不可控蛋白质合成为特征的癌细胞。与传统疗法相比,R3616可以引起更有效的宿主抗肿瘤免疫反应。在小鼠结肠癌模型中,R3616可诱导大量的浸润性T细胞,巨噬细胞和树突状细胞[13]。R3616与吉西他滨联合治疗晚期胰腺癌可产生协同作用[14]。
DM33是ICP34.5和LAT基因双缺失的重组HSV-1OV。与DLSPTK不同,DM33的突变基于McKrae毒株,具有更强的增殖能力并诱导更强烈的抗肿瘤效应。在颅内携带U-87MG人神经胶质瘤的裸鼠模型中,小鼠接受DM33治疗后其生存时间延长,组织学分析显示DM33治疗组加速了肿瘤细胞溶解。DM33的安全性在于其对神经元细胞,星形胶质细胞和内皮细胞的减毒作用。
NV1020是衍生自HSV-1的减毒重组病毒,用编码几种病毒糖蛋白的HSV-2基因组区域取代了五个HSV-1基因 [15]。除了RL1缺失,UL56缺失最有可能进一步降低神经毒力,因为pUL56与神经元特异性驱动蛋白(Kinesin Family,Member1A,KIF1A)(一种涉及突触小泡前体的轴突运输的蛋白质)相关联,并通过缺失TK基因和基因UL24的启动子进一步减弱其毒性[16]。这些基因修饰使NV1020的毒性能够被极大减弱,并且使其仅在肿瘤细胞中传播。NV1020的安全性和有效性已经在胰腺癌,结肠癌,膀胱癌和胸膜癌中进行了检测。结合NV1020的细胞减弱毒性和肿瘤靶向性,已应用于临床治疗II期与III期试验。
G207是第一种用于临床试验的oHSV-1。它删除了两个拷贝的ICP34.5以及ICP6并插入了大肠杆菌LacZ,衍生自HSV的TK在G207中是完整的,可通过联合用药治疗增强其抗肿瘤效果[17]。G207诱导全身抗肿瘤免疫,抗肿瘤免疫的效应与增强细胞毒性T淋巴细胞的活性有关 [18]。G47Δ是来源于G207的一类HSV-1的突变体,删除了非必需基因α47,促进了G47Δ的复制。
HF10在UL和UL/irL结合的右端具有3.9kbp的缺失,导致UL56表达的丧失。与野生型HSV-1相比,HF10毒力更低并且复制能力更前,其安全性和有效性在许多动物模型中得以证实,已被用于治疗卵巢癌、恶性黑素瘤、乳腺癌和胰腺癌的临床试验。
BS001 是第一种用于临床的oHSV-2。通过删除ICP34.5促进病毒在肿瘤细胞中选择性复制,增强安全性; 删除毒力基因ICP47,降低免疫抑制,促进病毒复制,增强抗肿瘤疗效:插入人粒细胞-巨噬细胞集落刺激因子(hGM-CSF)表达序列可诱导肿瘤及其周围的树突细胞(DC)前体的分化、增殖和成熟,同时增强DC的抗原递呈,以激活体内免疫杀伤细胞,有助于诱导局部和全身性抗肿瘤免疫应答。目前已获得美国FDA孤儿药认证的溶瘤病毒药物。
目前,HSV的基因修饰大部分都基于ICP6基因(UL39)失活和ICP34.5基因缺失[19]。ICP6蛋白是对病毒DNA复制而言必不可少的核糖核苷酸还原酶的大亚基。ICP6突变的HSV只能在快速分裂的细胞如肿瘤细胞中复制,可提高其肿瘤靶向性。病毒基因ICP34.5是HSV中的主要神经毒性基因。真核细胞翻译起始因子2α(eukaryotic initiation factor-2α,eIF-2α)的α亚基磷酸化会阻断宿主蛋白质合成,而ICP34.5编码蛋白质ICP34.5的表达导致eIF-2α脱磷酸化,解除其对蛋白质合成的抑制作用。RAS/丝裂原活化蛋白激酶途径通常在癌细胞中被激活,这使得ICP34.5缺陷型的HSV可选择性地在癌细胞中复制。作为遗传修饰的结果,ICP6/ICP34.5缺失的HSV对正常组织具有低致病性,对肿瘤细胞具有高的溶瘤能力[20]。
目前,HSV-1的基因设计一般采用病毒株或含有病毒基因组的质粒,通过同源重组技术或细菌人工染色体(bacterial artificial chromosome, BAC)技术进行多轮重组以获得目的病毒。
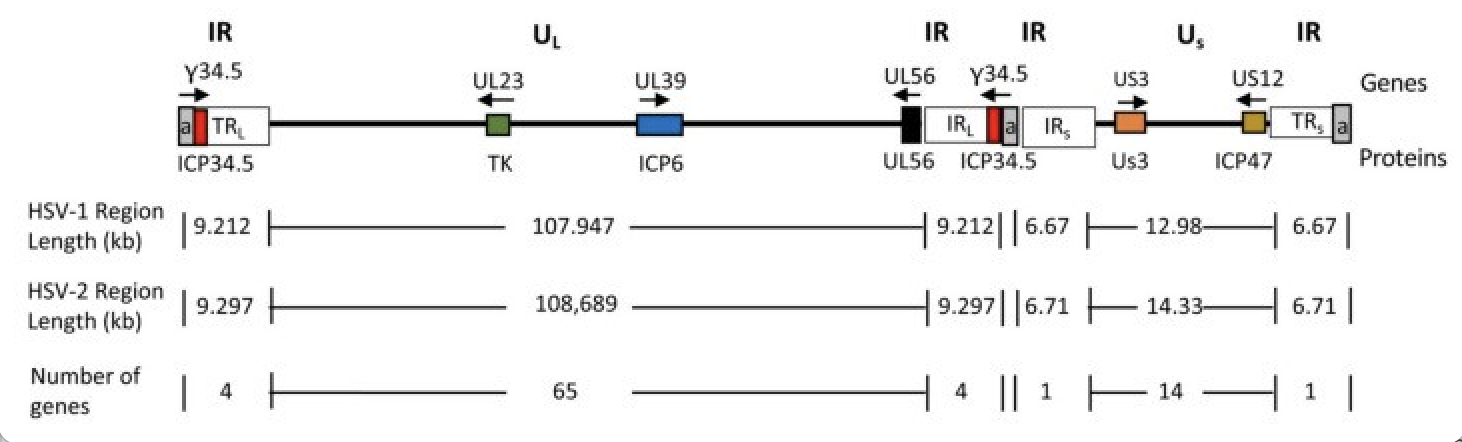
图3. HSV基因组doi:10.3390/v13091740示意图序列重复的次数(a,灰色)是可变的。与肿瘤特异性相关的基因显示为彩色框,其名称显示在基因组线上方;基因产物名称显示在基因组线下方。箭头指示转录方向。
溶瘤HSV病毒用于肿瘤治疗的首要问题是面对宿主免疫、复杂的肿瘤微环境以及肿瘤细胞异质性等,如何通过基因工程的方法将某些外来基因插入到oHSV中或联合其他传统疗法,提高OV治疗的安全性及靶向肿瘤细胞的特异性是目前研究的重点。
病毒是高效的基因传递系统,通过基因修饰OV可产生更有效的抗肿瘤作用。HSV-1作为载体可以在其病毒基因组内引入较大的治疗基因,且目前已经成功地应用于递送各种免疫调节分子,包括白细胞介素-12(Interleukin-12 , IL-12)、IL-24(Interleukin-24 , IL-24)、IL-4(Interleukin-4 , IL-4)、IL-18(Interleukin-18 , IL-18)和干扰素α(Interferonα , IFN-α)。这些转入的治疗基因通过刺激局部炎性或激发宿主免疫应答来抑制肿瘤生长。IL-24、IL-4和IFN-γ已被证明可通过抑制肿瘤血管发生、调节T辅助细胞成熟及调节肿瘤微环境来选择性诱导肿瘤细胞凋亡[27]。
实体肿瘤以不同的方式限制免疫治疗的有效性,例如免疫抑制细胞因子的分泌和免疫抑制配体的表达可抑制抗肿瘤T细胞的功能。OV通过联合PD-L1或PD-L2抑制剂,阻断程序性细胞死亡蛋白(programmed cell death protein-1,PD-1)信号通路,解除对T细胞的抑制,在许多类型的癌症试验中取得成功[28]。
目前对胶质母细胞瘤(glioblastoma multiforme,GBM)患者的临床治疗标准是替莫唑胺(Temozolomide,TMZ)化疗与最大安全切除术和放疗联合使用。这种治疗方法复发性疾病的治疗效果普遍较差。研究显示oHSV-TRAIL(oHSV-TNF related apoptosis inducing ligand)有望克服GBM的治疗耐药性和复发性的能力,为其用于开展GBM治疗临床试验提供依据[29]。
现阶段,各种类型的OV均在临床上进行了阶段测试。认识OV与肿瘤微环境和免疫系统之间的相互作用对OV的改造及提高其安全性和抗肿瘤特性而言非常重要。对增强OV在体内溶瘤作用的机制以及影响OV在肿瘤微环境中传播的因素,目前均没有很确切的答案。另外,OV和常规疗法联合的临床抗肿瘤效果还有待更多的实验证实。用治疗转基因修饰HSV是癌症治疗中有希望的策略,可用于补充常规疗法的不足之处。随着各种研究不断地推进,有理由相信OV将会在肿瘤治疗中占有重要地位。
参考文献
[1]Conrady CD, Drevets DA, Carr DJJ. Herpes Simplex Type I (HSV-1) Infection of the Nervous System: Is an Immune Response a Good Thing? Journal of neuroimmunology. 2010;220(1-2):1-9. doi:10.1016/j.jneuroim.2009.09.013
[2]Zeyaullah M, Patro M, Ahmad I, et al. Oncolytic viruses in the treatment of cancer: a review of current strategies. Pathology oncology research: POR. 2012;18(4):771-781. doi:10.1007/s12253-012-9548-2
[3]Dai MH ., Zamarin D, Gao SP, et al. Synergistic action of oncolytic herpes simplex virus and radiotherapy in pancreatic cancer cell lines. The British Journal of Surgery. 2010;97(9):1385-1394. doi:10.1002/bjs.7124
[4]Watanabe D. Medical application of herpes simplex virus. Journal of Dermatological Science. 2010;57(2):75-82. doi:10.1016/j.jdermsci.2009.10.014
[5]Killock D. T-VEC oncolytic viral therapy shows promise in melanoma. Nature Reviews Clinical Oncology. 2015;12(8):438-438. doi:10.1038/nrclinonc.2015.106
[6]Johnson DB, Puzanov I, Kelley MC. Talimogene laherparepvec (T-VEC) for the treatment of advanced melanoma. Immunotherapy. 2015;7(6):611-619. doi:10.2217/imt.15.35
[7]Kaufman HL, Kim DW, DeRaffele G, Mitcham J, Coffin RS, Kim-Schulze S. Local and Distant Immunity Induced by Intralesional Vaccination with an Oncolytic Herpes Virus Encoding GM-CSF in Patients with Stage IIIc and IV Melanoma. Annals of Surgical Oncology. 2009;17(3):718-730. doi:10.1245/s10434-009-0809-6
[8]Andtbacka RHI, Kaufman HL, Collichio F, et al. Talimogene Laherparepvec Improves Durable Response Rate in Patients With Advanced Melanoma. Journal of Clinical Oncology. 2015;33(25):2780-2788. doi:10.1200/jco.2014.58.3377
[9]Wang JN, Liu RB, Jun-Jie LI, Abdalwalithabit M. Oncolytic herpes simplex virus vectors for the treatment of human breast cancer. Chinese Journal of Breast Disease(Electronic Edition). Published online 2009.
[10]INO Y, TODO T. CLINICAL DEVELOPMENT OF A THIRD-GENERATION ONCOLYTIC HSV-1 (G47Δ) FOR MALIGNANT GLIOMA. Gene Therapy and Regulation. 2010;05(01):101-111. doi:10.1142/s1568558610000185
[11]Todo T. ATIM-14. RESULTS OF PHASE II CLINICAL TRIAL OF ONCOLYTIC HERPES VIRUS G47Δ IN PATIENTS WITH GLIOBLASTOM. Neuro-oncology. 2019;21(Suppl 6):vi4-vi4.
[12]12. Chou J, Kern ER, Whitley RJ, Roizman B. Mapping of Herpes Simplex Virus-1 Neurovirulence to γ134.5, a Gene Nonessential for Growth in Culture. Science. 1990;250(4985):1262-1266. doi:10.1126/science.2173860
[13]Shirota T, Kasuya H, Kodera Y, et al. Oncolytic Herpes Virus Induces Effective Anti-Cancer Immunity against Murine Colon Cancer. Hepatogastroenterology. 2011;58(110-111). doi:10.5754/hge11168
[14]Watanabe I, Kasuya H, Nomura N, et al. Effects of tumor selective replication-competent herpes viruses in combination with gemcitabine on pancreatic cancer. Cancer Chemotherapy and Pharmacology. 2007;61(5):875-882. doi:10.1007/s00280-007-0567-8
[15]Loret S, Guay G, LippéR. Comprehensive Characterization of Extracellular Herpes Simplex Virus Type 1 Virions. Journal of Virology. 2008;82(17):8605-8618. doi:10.1128/jvi.00904-08
[16]Koshizuka T, Kawaguchi Y, Nishiyama Y. Herpes simplex virus type 2 membrane protein UL56 associates with the kinesin motor protein KIF1A. Journal of General Virology. 2005;86(3):527-533. doi:10.1099/vir.0.80633-0
[17]Kroeger KM, Muhammad AKMG, Baker GJ, et al. Gene therapy and virotherapy: novel therapeutic approaches for brain tumors. Discovery Medicine. 2010;10(53):293-304. Accessed November 18, 2022. https://pubmed.ncbi.nlm.nih.gov/21034670/
[18]Todo T. “Armed” oncolytic herpes simplex viruses for brain tumor therapy. Cell Adhesion & Migration. 2008;2(3):208-213. doi:10.4161/cam.2.3.6353
[19]Eager RM, Nemunaitis J. Clinical development directions in oncolytic viral therapy. Cancer Gene Therapy. 2011;18(5):305-317. doi:10.1038/cgt.2011.7
[20]Walker JD, Sehgal I, Kousoulas KG. Oncolytic herpes simplex virus 1 encoding 15-prostaglandin dehydrogenase mitigates immune suppression and reduces ectopic primary and metastatic breast cancer in mice. Journal of Virology. 2011;85(14):7363-7371. doi:10.1128/JVI.00098-11
[21]Buijs PR, Verhagen JH, van Eijck CH, van den Hoogen BG. Oncolytic viruses: From bench to bedside with a focus on safety. Human Vaccines & Immunotherapeutics. 2015;11(7):1573-1584. doi:10.1080/21645515.2015.1037058
[22]Zhou G, Roizman B. Construction and properties of a herpes simplex virus 1 designed to enter cells solely via the IL-13alpha2 receptor. Proceedings of the National Academy of Sciences of the United States of America. 2006;103(14):5508-5513. doi:10.1073/pnas.0601258103
[23]Menotti L, Cerretani A, Hengel H, Campadelli-Fiume G. Construction of a Fully Retargeted Herpes Simplex Virus 1 Recombinant Capable of Entering Cells Solely via Human Epidermal Growth Factor Receptor 2. Journal of Virology. 2008;82(20):10153-10161. doi:10.1128/jvi.01133-08
[24]Zhou G, Ye GJ ., Debinski W, Roizman B. Engineered herpes simplex virus 1 is dependent on IL13R 2 receptor for cell entry and independent of glycoprotein D receptor interaction. Proceedings of the National Academy of Sciences. 2002;99(23):15124-15129. doi:10.1073/pnas.232588699
[25]Menotti L, Cerretani A, Campadelli-Fiume G. A Herpes Simplex Virus Recombinant That Exhibits a Single-Chain Antibody to HER2/neu Enters Cells through the Mammary Tumor Receptor, Independently of the gD Receptors. Journal of Virology. 2006;80(11):5531-5539. doi:10.1128/jvi.02725-05
[26]Grandi P, Fernandez J, Szentirmai O, et al. Targeting HSV-1 virions for specific binding to epidermal growth factor receptor-vIII-bearing tumor cells. Cancer Gene Therapy. 2010;17(9):655-663. doi:10.1038/cgt.2010.22
[27]Ottolino-Perry K, Diallo JS, Lichty BD, Bell JC, McCart JA. Intelligent design: combination therapy with oncolytic viruses. Molecular Therapy: The Journal of the American Society of Gene Therapy. 2010;18(2):251-263. doi:10.1038/mt.2009.283
[28]Chen CY, Wang PY, Hutzen B, et al. Cooperation of Oncolytic Herpes Virotherapy and PD-1 Blockade in Murine Rhabdomyosarcoma Models. Scientific Reports. 2017;7(1). doi:10.1038/s41598-017-02503-8
[29]Jahan N, Lee JM, Shah K, Wakimoto H. Therapeutic targeting of chemoresistant and recurrent glioblastoma stem cells with a proapoptotic variant of oncolytic herpes simplex virus. International Journal of Cancer. 2017;141(8):1671-1681. doi:10.1002/ijc.30811