抑郁表现为持续性精神低落和情绪障碍,是全世界最常见和最突出的精神障碍之一。全球因抑郁引发的残疾所致健康寿命损失年(years lost todisability,YLD)高达7640 万,占所有疾病负担YLD的10. 3%,位居疾病负担因素之首。全世界约有3. 5 亿人饱受抑郁之苦,中国的发病率约为3. 02%,且研究者认为受诊断方式的影响,中国人的抑郁情况远被低估[1] 。其典型的症状主要包括情绪低落、思维迟缓、兴趣减退、饮食睡眠障碍、认知功能损害以及其他各种躯体性症状[2]。

尽管如此,我们对抑郁症的病因、发病机制仍知之甚少,抑郁症并非简单的功能性精神障碍,而是一种涉及遗传、心理、生物化学和社会环境等因素的疾病[3-4],基于此也形成了从不同角度阐述抑郁症病机的假说,如单胺类神经递质假说(认为抑郁症与5-羟色胺等神经递质缺失有关)、神经可塑性假说(主张神经可塑性失调最终引发抑郁症)等。各假说切入点不同,致病机制也不尽相同,但都为阐述抑郁症病机提供了可能性。
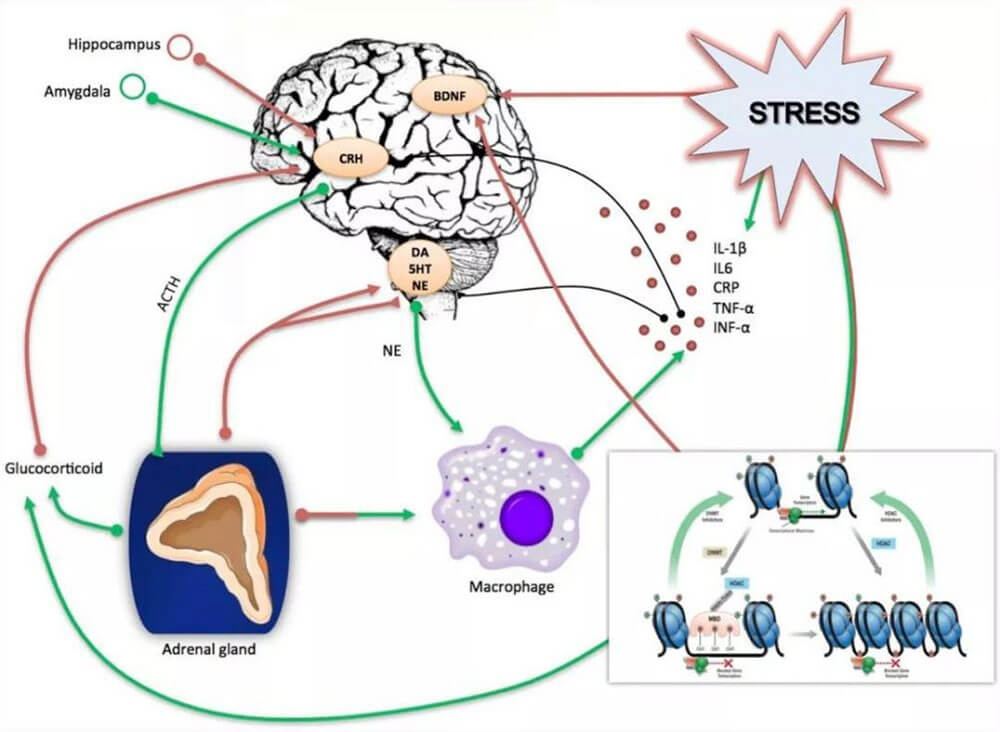
为研究抑郁发展及机制,研究者经过不断探索,构造了科学有效的抑郁动物模型作为抑郁基础研究的体内研究基础。抑郁模型动物表现出抑郁和认知功能障碍等行为学变化,能够模拟人类抑郁症状。使用动物模型不仅可以规避人类抑郁研究的伦理学问题,还能获得研究所需的足够样本量。因此,抑郁动物模型业已成为抑郁研究的重要工具[5-6]。
多年以来,为了确切模拟抑郁症的发生和症状表现,研究者已在环境应激、社会应激、神经生化、转基因等方面对抑郁症动物模型开展了深入研究。每种模型的切入点都不尽相同,都有各自的适用范围和局限性,而抑郁症的造模方法可以分为四个大类,分别为应激造模、手术造模、药物诱发造模以及遗传型造模。
| 模型名称 | 造模方法 | 优缺点 | |
| 应激造模 | 大小鼠强迫游泳实验(forced swimming test,FST) | 将大鼠或小鼠置于一个局限且无法逃脱的空间游泳,当多次逃逸无效后,放弃挣扎而漂浮在水面上呈不动的“绝望”状态。 | 此法简单易行,可信度较高可用于抗抑郁药的初筛。但此模型有假阳性反应,品系差异也较大。 |
| 小鼠悬尾实验(tail suspension test,TST) | 将动物头部向下悬挂,动物为克服不正常体位,经多次挣扎仍不能摆脱困境后,出现间断性不动,显示“行为绝望”状态。 | 该方法是抗抑郁药物活性筛选中具有高灵敏度的行为学方法,又因其快速、方便,但该模型也有品系差异可能更适合用于急性应激抑郁模型的建立。 | |
| 习得性无助模型(1earned helplessness model, LH) | 反复给予不可控的恶性刺激后,表现出逃避行为缺失等现象。 | 存在争议:并没有证据表明抑郁症患者的临床症状,是由于习得性无助这一心理过程所导致的。 | |
| 社会失败应激模型 | 运用同一物种间引发冲突进而产生精神心理压力来实现。 | 该模型能同时引起抑郁和焦虑的行为表现,可能更适合于具有二者混合特征的机制研究。 | |
| 慢性束缚应激模型(chronic restraint stress,CRS) | 慢性束缚应激模型是将啮齿类动物重复地置于束缚管内,限制其行动自由一段时间。 | 这种模型制作简便,实验中经常联合慢性温和应激模型造模。该模型广泛用于研究啮齿类动物不同脑区形态、激素水平及行为学的改变。 | |
| 手术造模 | 嗅球切除模 型(olfactory bulbectomized , OB ) |
嗅球位于端脑前端。去除大鼠双侧嗅球会使其产生复杂的行为,所以也是模拟人类抑郁症很有效的一种模型 | 此模型抑郁效果明显、可靠性好,常用于抗抑郁药的次筛以及作用机制研究。但对实验手术技术要求高,实验中动物死亡率较高,模型有品系差异。 |
| 卒中后抑郁(post-stroke depression , PSD ) | 联合大脑中动脉阻塞和空间行为限制建立了卒中后抑郁动物模型 | 该模型理想地模拟了临床卒中病人由于肢体瘫痪行动受限所导致的抑郁状态,为卒中后抑郁症的病理学机制研究和临床治疗提供了基础。 | |
| 药物诱导造模 | 利血平等药物模型 | 这类模型主要基于抑郁症的单胺假说,如利血平诱导的抑郁模型。 | 此类模型主要筛选针对专一靶点的抗抑郁药。可以用来探讨抗抑郁药的药理作用性质,或用于初筛未知化合物。 |
| 遗传性造模 | Flinders sensitive rat line(FSL)大鼠模型 | Overstreet和Wegener[8]最初发现该大鼠模型。 | 此模型大鼠和抑郁症患者的行为学表现、神经化学和药理学机制类似,是一种非常有效的检测抗抑郁药的动物模型。 |
| Wistar·Kyoto(WKY)大鼠模型 | Nam等人[9]发现该动物模型。 | 该品系大鼠源自自发性高血压大鼠,能表现出和抑郁症患者类似的激素水平、行为学及生理学的异常。 |
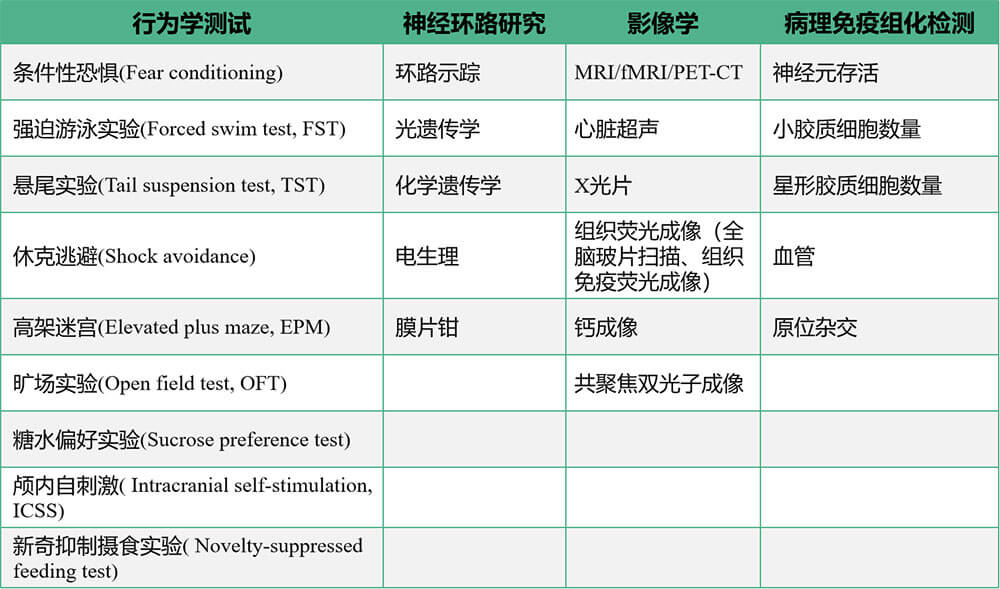
抑郁的监测和评价指标主要通过评价实验动物在情绪和认知、绝望行为、焦虑症状、快感缺乏等方面的表现。以下介绍一些常用评价指标。
参考文献
[1] Smith K. Mental health: a world of depression [J]. Nature,2014, 515(7526):181.
[2] Kupfer D J, Frank E, Phillips M L. Major depressive disorder:new clinical, neurobiological, and treatment perspectives [J] Lancet, 2012,379: 1045-1055.
[3] Fischer AS, Camacho MC, Ho TC, et al. Neural markers of resilience in adolescent females at familial risk for major depressive disorder[J]. JAMA Psychiatry ,2018,75 (5) :493-502.
[4] Malhi GS, Mann JJ. Depression [J]. Lancet , 2018 ,392 (10161): 2299-2312.
[5] Harro J. Animal models of depression: pros and cons[J]. CellTissue Res, 2019, 377(1):5-20.
[6] 张磊阳,贺敏,李玥,裘福荣,陈文文,吴雨,杨蒋伟,蒋健.抑郁症动物模型的研究进展[J].中国比较医学杂志, 2017,27(9):92-97.
[7] 王雀良,潘集阳,刘亚平,等.抑郁症动物模型的回顾与展望[J].广东医学,2011, 32(7) :932-935.
[8] Overstreet D H , Wegener G. The flinders sensitive line rat model of depression-25 years and still producing [ J ]. Pharmacological Reviews, 2013,65:143-155.
[9] Nam H , Clinton S M , Jackson N L, et al. Learned helplessness and social avoidance in the Wistar-Kyoto rat [ J ]. Front Behav Neurosci, 2014,8:109.
布林凯斯在神经系统疾病相关药效药理评价领域,能为您提供一站式从基因分子层次到细胞组织层次,再到神经环路,最后到动物作为整体的行为学评价平台。
在基因分子层次,通过基因编辑,基因干扰,原位杂交,免疫组化等技术手段,验证基因或蛋白对于细胞生理代谢信号转导、基因表达调控等影响进行研究,并在此基础上结合行为实验验证某分子的功能。
在神经环路层次,我们可以通过环路示踪、光遗传学、化学遗传学、电生理等手段分析不同脑区、不同类型神经元之间形成的神经环路结构和功能。此类研究是目前神经科学的重点发展方向之一。理解神经元联系变化带来的巨大表型差异,并对其进行深入的操作和分析。
同时,布林凯斯也提供神经系统疾病造模后的高精度动物行为检测平台包括但不限于:认知功能检测,运动功能检测,清醒动物多通道在体电生理记录、呼吸记录、听觉、痛觉、焦虑、抑郁、嗅觉功能相关的行为学检测等。
还可提供MRI/fMRI/PET-CT的小动物活体成像,心脏超声,X光片,组织荧光成像(全脑玻片扫描、组织免疫荧光成像)、钙成像、共聚焦双光子成像。