腺相关病毒 (Adeno-associated Virus,AAV)
简介:
腺相关病毒(Adeno-associated Virus,AAV)属于细小病毒科(parvoviridae),单链DNA病毒,经过改造的rAAV病毒工具已被广泛的应用在动物水平的基因表达、基因操作和基因治疗。AAV是迄今发现的一类结构最简单的天然的复制缺陷型病,不能独立复制,只有在辅助病毒如单纯疱疹病毒存在时才能完成复制,生成子代AAV。
AAV对中枢神经系统具有较高的感染效率,能够介导长久稳定的基因表达,相对于其他类型的嗜神经病毒产生的细胞毒性极小。AAV的另一个优势就是能够产生高滴度的病毒粒子,可保证同一个神经元感染多个病毒粒子,从而维持外源基因的高表达。因此 AAV 是外源基因表达的良好载体,也是神经环路研究中使用最广泛的表达工具。
AAV病毒载体的优势:
- 1)表达时间长: 绝大多数重组rAAV 不会整合到基因组上,而是在宿主细胞中串联形成附加体(episome)存在于细胞核中 ,细胞在细胞复制和分裂后会丢失附加体,并因此失去基因表达能力,rAAV在细胞分裂不旺盛的组织中可持续表达6个月以上;
- 2) 扩散性强: rAAV 的体积小,滴度高,因此具有远高于腺病毒和慢病毒的扩散性,可以穿透血脑屏障,是理想的神经元和胶质细胞感染工具;
- 3) 特异性强: rAAV 有十数种常用的血清型,不同的血清型对不同的脏器有较高的识别及感染能力,是动物实验首选;
- 4) 安全性高: 目前还没有发现AAV 对人体致病,是美国FDA 批准的可以直接用于人体基因治疗的最安全的病毒载体;
- 5) 免疫原性低: 当AAV 用局部大剂量感染肌肉、脑、眼等组织时,不易造成免疫反应;
- 6) 高稳定性: rAAV 病毒在4℃可以保存1 周,并且对氯仿等试剂具有抗性。
- Table1 常用几种病毒载体工具比较
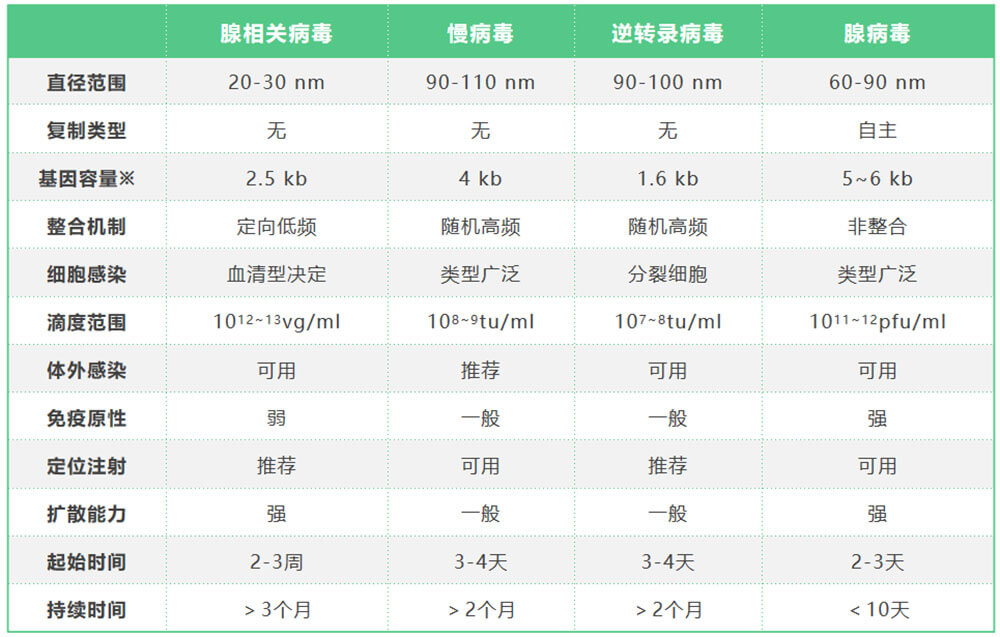
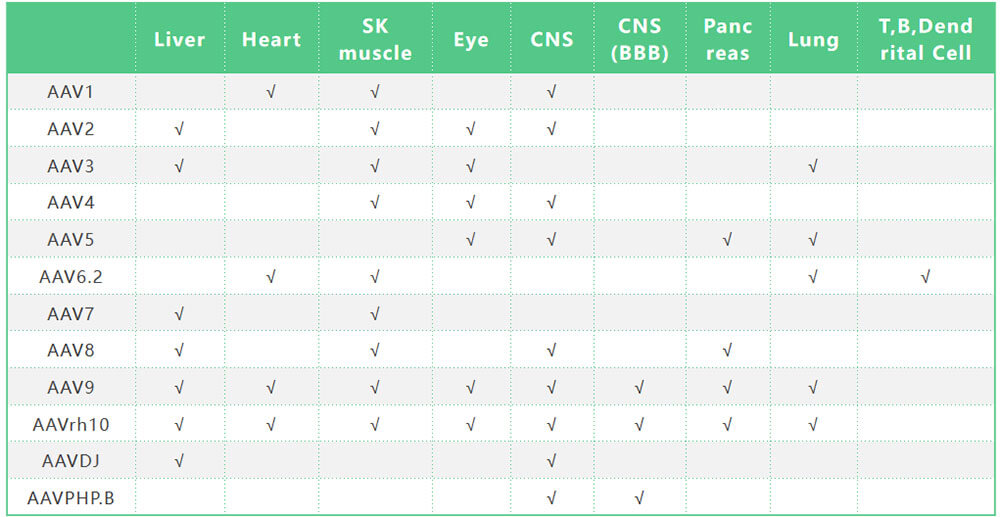
Table2 不同血清型rAAV的组织感染嗜性
可选择的病毒载体
详情见:基因过表达、基因干扰
应用:
- 1.介导目的基因 /RNAi 基因表达;
- 2.基因治疗载体;
- 3.神经环路研究中使用最广泛的表达工具。
现货列表
详情见:现货病毒产品中心
案例展示
案例一:AAV8 在视网膜研究中的应用(图1,PMID: 24744609)
- 病毒类型及滴度:实验组AAV2/8/SmVEGF-2,对照组AAV2/8/GFP;3.00E+14 vg/mL
- 感染动物及部位:C57BL/6 小鼠;视网膜下间隙
- 实验方法及结果:
将1μl siRNA实验组病毒(AAV2/8/SMVEGF-2;n=12)或对照载体(AAV2/8/gfp;n=14)注入C57BL/6小鼠的视网膜下腔。1week后,用半导体激光在每只眼的视神经周围制造4个不同的脉络膜烧伤,诱导脉络膜新生血管(CNV)。2week后,摘除眼睛进行视网膜平贴制剂CNV分析。
结果显示,视网膜下注射AAV2/8/SmVEGF-2与AAV8/GFP相比,激光损伤区的CNV显著减少(1597.3±2077.2比5039.5±4055.9µm(2);P<0.05)。使用酶联免疫吸附试验,我们发现AAV2/8/SmVEGF-2治疗组的VEGF水平降低了大约一半。
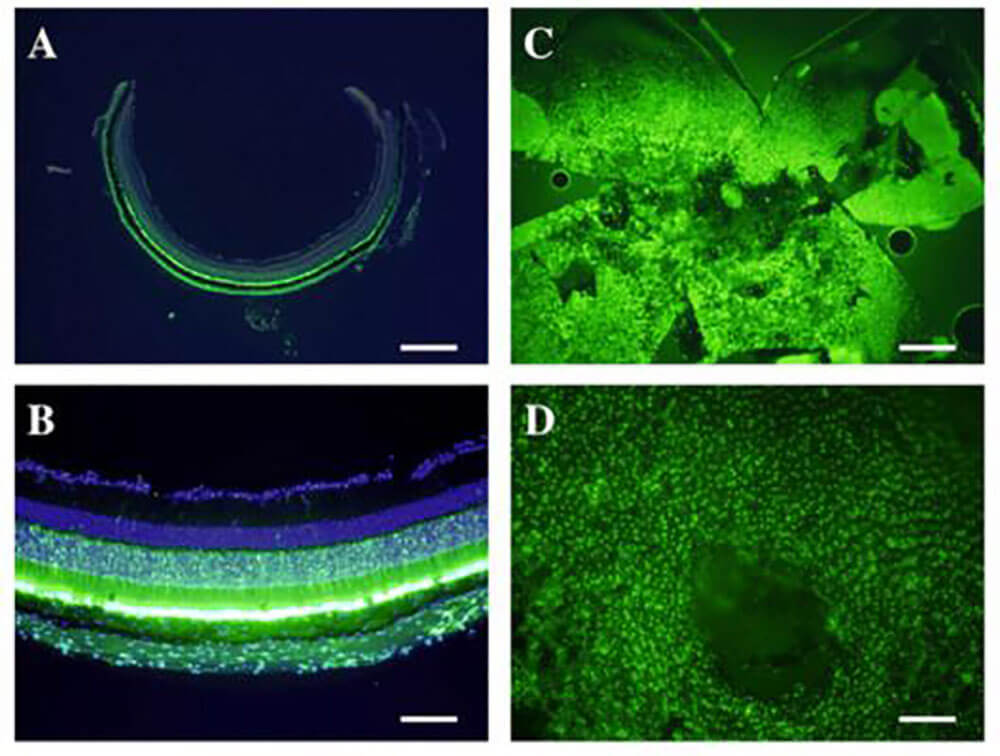
图1. 组织学分析AAV8/GFP转导特性。在冰冻切片中A、感光细胞;B、视网膜色素上皮细胞(RPE)均可检测到绿色荧光蛋白的表达。视网膜平贴制剂也显示绿色荧光蛋白在RPE细胞中的广泛表达(C和D)
案例二:AAV 在胰腺研究中的应用(图2,PMID:16567506)
- 病毒类型:dsAAV-CB-GFP,AAV1,AAV2,AAV5,AAV6,AAV8。
- 感染动物及部位:胰岛
- 实验方法及结果:
体外转导实验中,将分离的胰岛分别感染不同血清型的dsAAV(剂量:10000个病毒基因组颗粒/细胞)。7d后,观察GFP在体外胰岛中感染情况。体内转导实验中,将不同血清型dsAAV(剂量:5×1011vg)腹腔注射(i.p.)感染成年老鼠。2个月后,从病毒载体处理的小鼠中分离胰岛,观察GFP的表达。
结果显示,1)AAV 在体外感染分离出来的胰岛时,AAV6 的感染能力是最强的,其次是AAV1,再次AAV8 和AAV2,AAV5 的感染效果最差。2)腹腔体内注射时,AAV8感染腺泡细胞的能力是最强的。
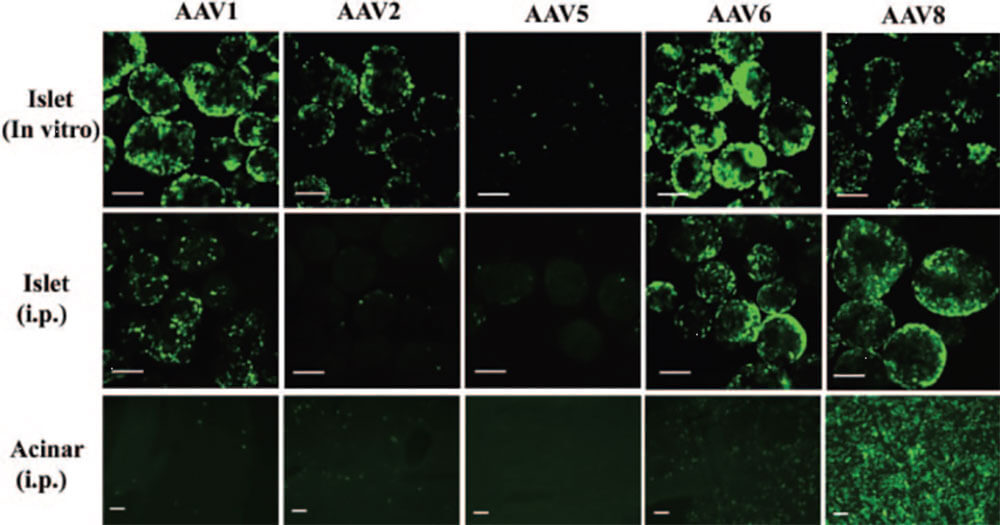
图2. 不同血清型dsAAV-CB-GFP载体对离体胰岛和体内胰腺的转导作用
案例三:AAV 在神经系统中的应用(图3,PMID:29251597)
- 病毒类型及滴度:AAV9-EF1a-floxed-ChR2-mCherry,AAV9-EF1a-floxed-mCherry;2.00E+12 vg/mL,
- 感染动物及部位:DAT-Cre 小鼠,C57BL/6 对照鼠;VTA脑区。
- 实验方法及结果:用病毒载体AAV9-EF1a-floxed-ChR2-mCh-erry / AAV9-EF1a-floxed-mCherry分别注射300 nl感染DAT-Cre小鼠和对照小鼠的VTA脑区,结果显示在VTA区表达mCherry的多巴胺能神经元占比94.39%,在mOT区也观察到大量表达mCherry的多巴胺能神经元,表明VTA区到mOT区存在多巴胺能神经元投射。作者继续用蓝光刺激VTA到mOT的多巴胺能神经元投射,发现在嗅结节(OT)、伏隔核(NAc)和梨状皮层(PCX)中c-fos表达增加,而后位置偏好选择实验发现DAT-Cre小鼠在“light on”区域的停留时间明显高于对照小鼠。实验利用光遗传学很好地揭示了VTA到mOT的多巴胺能神经元的激活会导致动物的奖赏行为。
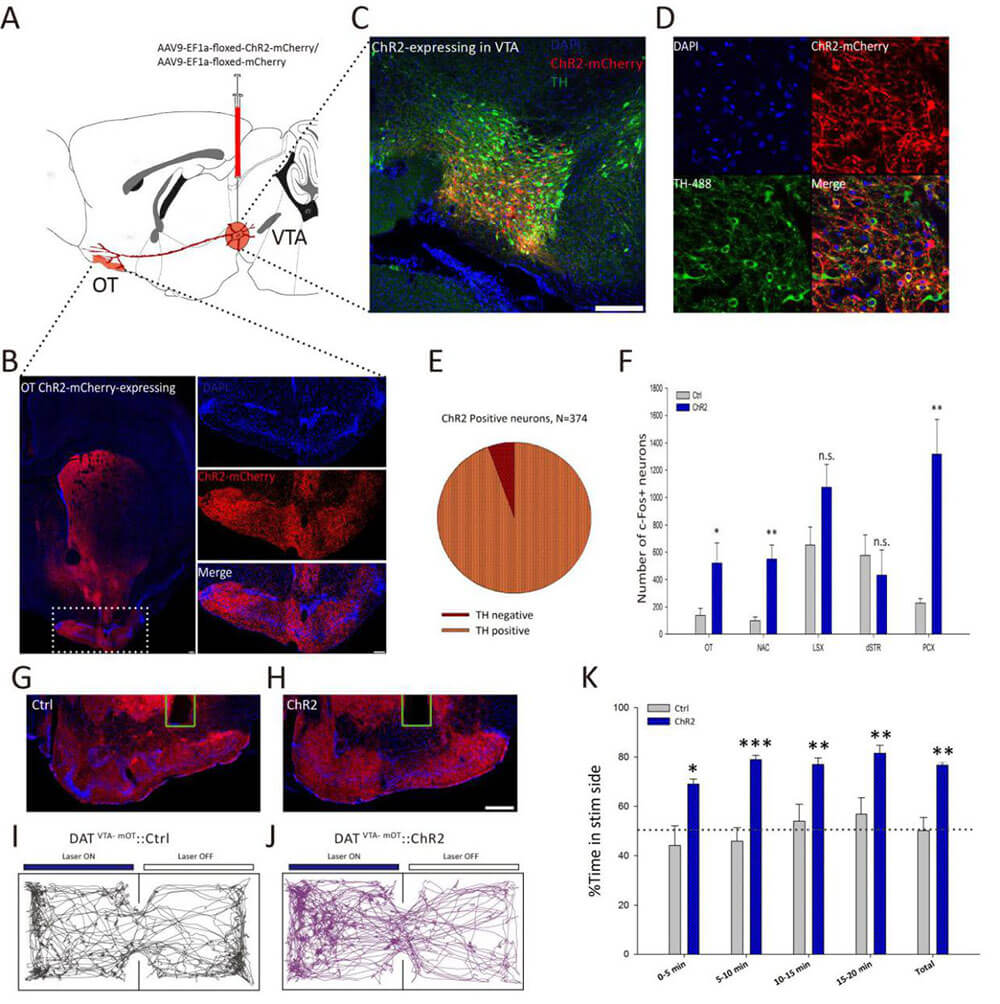
图3. VTA到mOT的多巴胺能神经元的激活会导致动物的奖赏行为