溶瘤病毒(oncolytic virus,OVs)通过不同的调控机制在肿瘤细胞内复制、裂解肿瘤细胞,而不影响正常细胞生长[1]。与传统免疫治疗相比,溶瘤病毒治疗具有靶向性好、不良反应小、杀伤肿瘤途径多、不易产生耐药性等优势。多项临床研究显示,溶瘤病毒可为不同类型、不同进展阶段,甚至转移性和无法治愈的肿瘤患者带来临床获益 [2-3] 。更重要的是,其与化疗、放疗、免疫治疗等联合应用时,具有协同增效的作用,可使原先对免疫检查点抑制剂等免疫治疗药物反应欠佳的瘤种变得敏感[2, 4]。
现今,用于临床治疗的溶瘤病毒大体可以分为以下两大类:一类是天然存在的,未经基因编辑的病毒,主要包括呼肠孤病毒(reovirus)、新城疫病毒(newcastle disease virus,NDV)、天然柯萨奇病毒A21(eoxsaekie virus A21,CVA21)等[5]。另一类是经过基因改造的病毒,主要包括腺病毒(adenovirus)、牛痘病毒(vaccinia virus)、单纯疱疹病毒(herpes simplex virus)、水疱性口炎病毒(Vesicular Stomatitis Virus)等。而大多数OV都经过基因修饰,以增加病毒向肿瘤细胞的向性、提高病毒的选择性复制和裂解潜能,并增强宿主的抗肿瘤免疫。
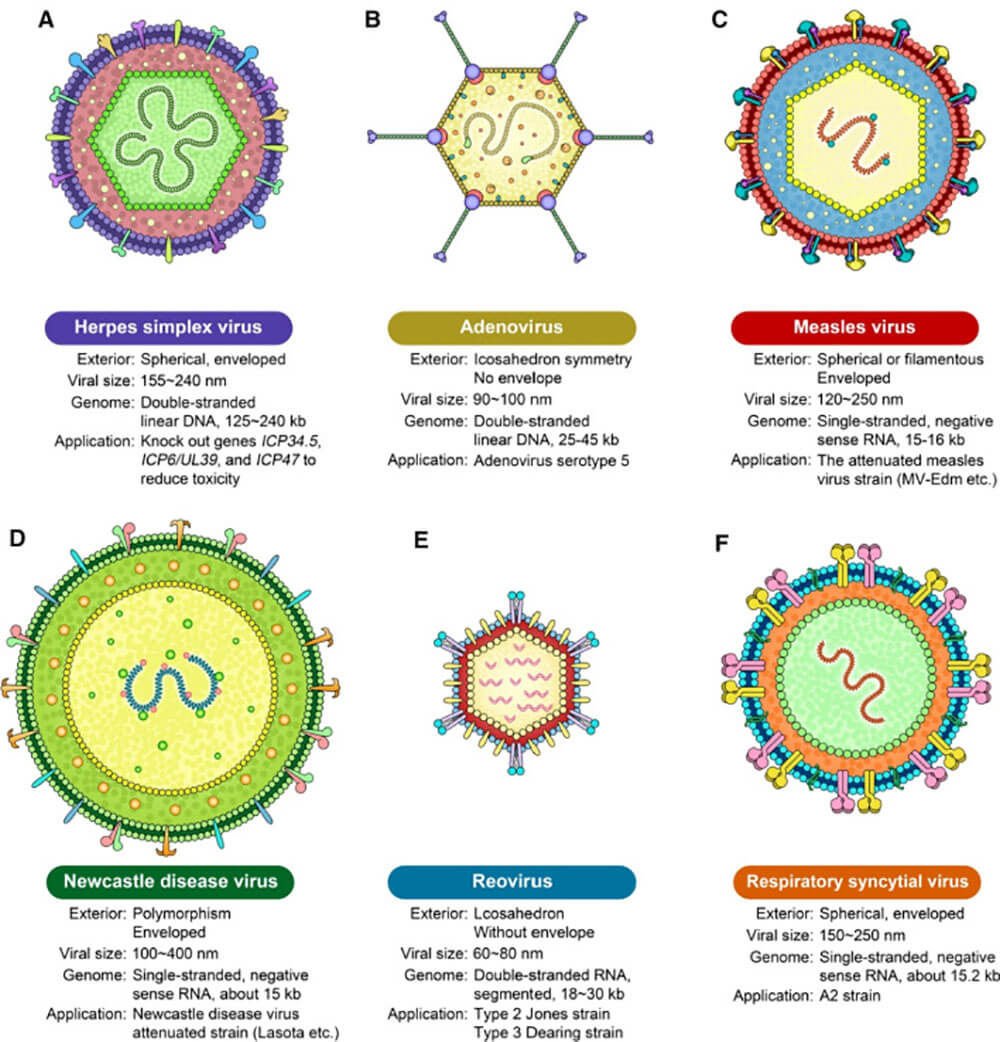
图1:溶瘤病毒的种类
根据溶瘤病毒的定义,溶瘤病毒选择性地在肿瘤组织中复制,对正常细胞无杀伤作用。但溶瘤病毒种类繁多,其肿瘤特异性杀伤的机制各不相同。溶瘤病毒选择性感染肿瘤细胞,在肿瘤细胞内进行自我复制来破坏肿瘤细胞,通过释放病原体相关分子( pathogen-associated molecular pattern molecules, PAMP)、肿瘤相关抗原( tumor-associated antigen, TAA)、炎性因 子、趋化因子等物质,激活机体免疫系统,直接或间接杀伤肿瘤细胞,将冷肿瘤转变为热肿瘤,如图1所示。
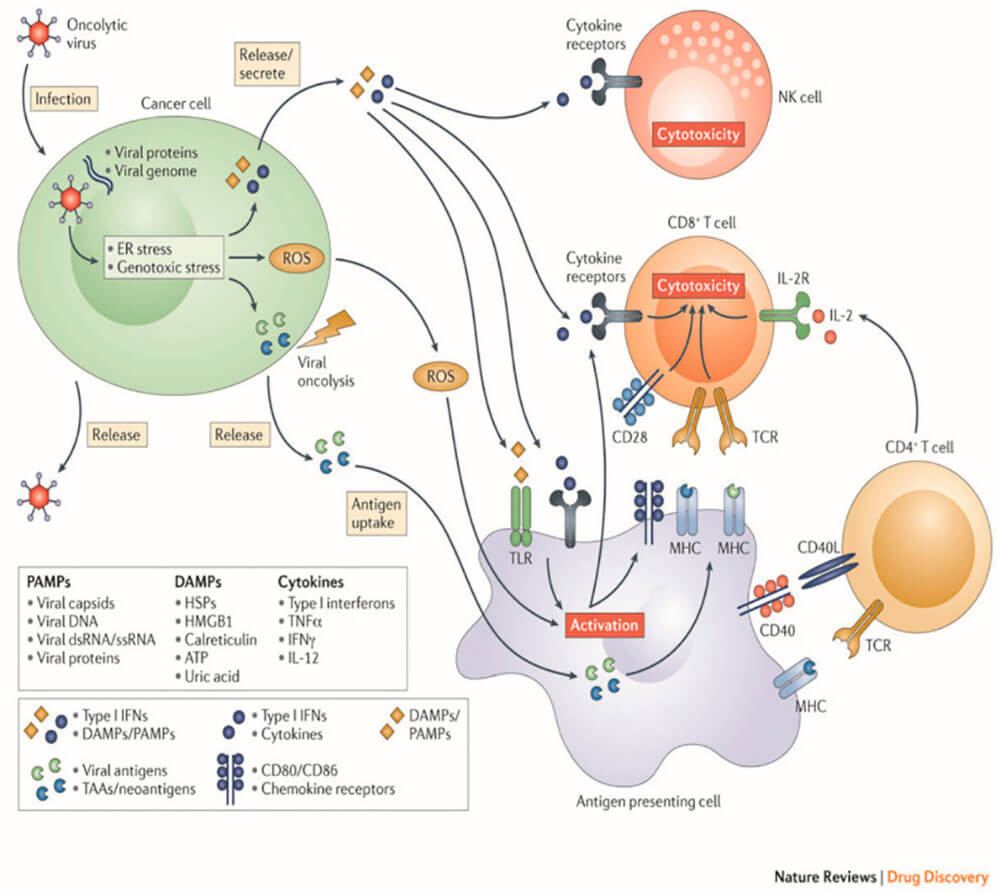
图2:溶瘤病毒作用机制
在2017年所有临床试验中,有78项是溶瘤病毒用于多种恶性实体瘤中的干预试验,这表明溶瘤病毒具有较好的抗肿瘤研究前景。
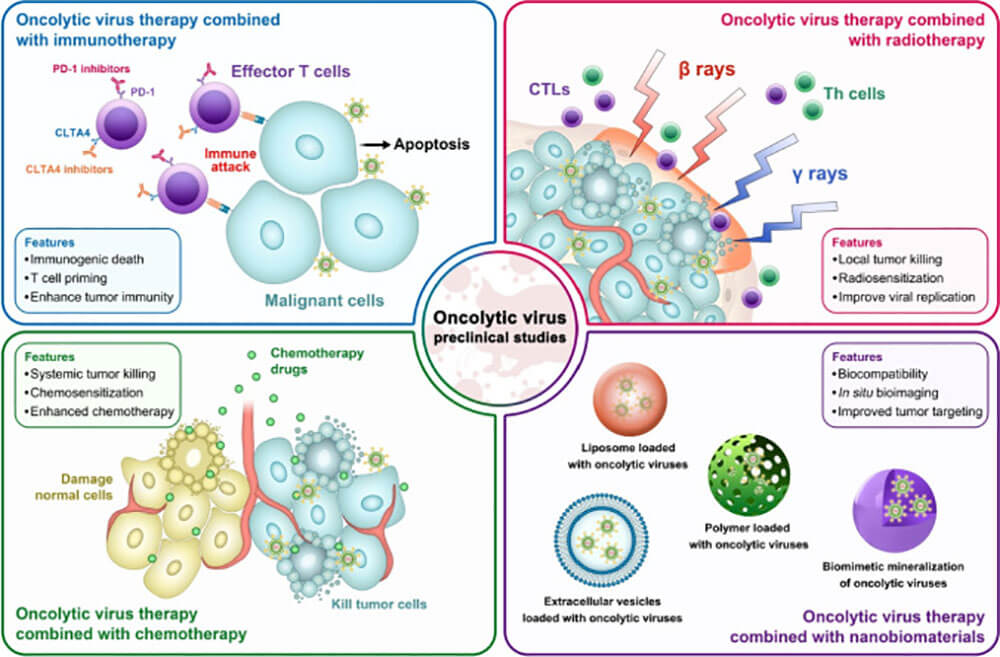
图3:溶瘤病毒联合治疗的临床前特征:联合免疫疗法(左上);联合放射治疗(右上);联合化疗(左下);纳米生物材料联合治疗(右下)
溶瘤病毒是一种多功能抗癌药,选择性感染、复制并杀死肿瘤细胞,该过程取决于表面受体、肿瘤细胞对病毒复制的允许性。溶瘤病毒在多个临床试验中显示出不同的治疗效果,但很少长期诱导体内肿瘤的完全消退。而且,异质性肿瘤的选择性压力导致对溶瘤病毒的抗性。为了克服这些不足,临床上建立起许多新颖溶瘤病毒联合疗法,增强对肿瘤的杀伤力。
靶向治疗与联合化疗的原理相同,同样是抑制癌细胞内异常的信号通路。
溶瘤病毒联合放疗
溶瘤病毒和放疗是肿瘤治疗的两个不同领域,具有不重叠的细胞毒性谱。辐射增强病毒的溶瘤作用,病毒提高细胞放疗敏感性,二者具有协同作用[6,10]。溶瘤病毒是一种极具潜力的肿瘤治疗策略。最初认为溶瘤病毒的细胞毒性是增加病毒复制、增强肿瘤细胞感染和溶瘤作用,但目前许多溶瘤病毒研究数据均不支持这一假设;大多认为溶瘤病毒阻止DNA修复,使肿瘤细胞对辐射敏感,诱导细胞凋亡。
溶瘤病毒虽然能够快速减少局部肿块大小,但不易产生持续性抗肿瘤免疫应答。免疫应答是 OV疗法的关键组成部分,初始诱导很强,随后效应细胞的抗肿瘤活性被多种免疫调节剂(如 CTLA-4和PD-L1)抑制。在恶性黑色素瘤小鼠模型中,溶瘤麻疹病毒将抗CTLA-4和抗PD-L1抗体,靶向递送至TME,诱导较强的特异性抗肿瘤免疫反应,未发现免疫相关毒性[11]。另一种黑色素瘤小鼠模型中,瘤内注射NDV联合抗CTLA-4抗体导致肿瘤消退,存活时间延长[12]。PDL1产生于肿瘤细胞和浸润肿瘤细胞的过表达,与T细胞上的PD-1结合,诱导T细胞凋亡,使肿瘤细胞逃逸[11-12];而阻断PD-1改善T细胞功能。OV感染增强免疫调节剂的表达,增强肿瘤细胞对PD-1或PD-L1阻断的敏感性,引起抗肿瘤免疫反应。因此,溶瘤病毒联合免疫具有治疗价值。
近年来,随着纳米技术领域的快速发展,生物纳米材料在肿瘤治疗中的应用受到广泛关注[13]。他们具有良好的载药能力。集生物成像、激活肿瘤免疫等功能于一体,经过一定修饰后,可特异性靶向肿瘤细胞。无论是在肿瘤诊断还是治疗方面都显示出很高的潜在应用前景。因此,生物材料可用于负载溶瘤病毒,以达到阻断病毒免疫原性并实现肿瘤靶向递送的目的。目前用于运载溶瘤病毒的主要是脂质体、细胞或外泌体,以及一些非生物物质载体,如高分子聚合物[14-16]。
参考文献
[1] GUJAR S, BELL J, DIALLO J S. SnapShot: cancer immunotherapy with oncolytic uses [J] . Cell, 2019, 176(5):1240-1240. el.
[2] 夏忠军, 常建华, 张力,等. 基因工程腺病毒(H101)瘤内注射联合化疗治疗头颈部及食管鳞癌的Ⅲ期临床研究[J]. 癌症, 2004, 23(12): 1666-1670.
[3] ANDTBACKA R H, KAUFMAN H L, COLLICHIO F, et al. Talimogene laherparepvec improves durable response rate in patients with advanced melanoma[J]. J Clin Oncol, 2015,33(25): 2780-2788.
[4] HARRINGTON K J, KONG A, MACH N, et al. Talimogene laherparepvec and pembrolizumab in recurrent or metastatic squamous cell carcinoma of the head and neck (MASTERKEY-232): a multicenter, phase 1b study [J] . Clin Cancer Res, 2020, 26(19): 5153-5161.
[5] CAO G D, HE X B, SUN Q, et al. The oncolytic virus in cancer diagnosis and treatment [J] . Front Oncol, 2020, 10: 1786.
[6] Choi AH, O'leary MP, Fong Y, et al. From Benchtop to Bedside: A Review of Oncolytic Virotherapy[J]. Biomedicines, 2016, 4(3):18.
[7] Ko JS, Rayman P, Ireland J, et al. Direct and differential suppression of myeloid-derived suppressor cell subsets by sunitinib is compartmentally constrained[J]. Cancer Res, 2010, 70(9):3526-3536.
[8] Vincent J, Mignot G, Chalmin F, et al. 5-Fluorouracil selectively kills tumor-associated myeloid-derived suppressor cells resulting in enhanced T cell-dependent antitumor immunity[J]. Cancer Res, 2010,70(8):3052-3061.
[9] Roulstone V, Pedersen M, Kyula J, et al. BRAF- and MEK-targeted small molecule inhibitors exert enhanced antimelanoma effects in combination with oncolytic reovirus through ER stress[J]. Mol Ther, 2015, 23(5):931-942.
[10] Kyula JN, Khan AA, Mansfield D, et al. Synergistic cytotoxicity of radiation and oncolytic Lister strain vaccinia in (V600D/E)BRAF mutant melanoma depends on JNK and TNF-alpha signaling[J]. Oncogene,2014, 33(13):1700-1712.
[11] Engeland CE, Grossardt C, Veinalde R, et al. CTLA-4 and PD-L1 checkpoint blockade enhances oncolytic measles virus therapy[J]. Mol Ther, 2014, 22(11):1949-1959.
[12] Zamarin D, Holmgaard RB, Subudhi SK, et al. Localized oncolytic virotherapy overcomes systemic tumor resistance to immune checkpoint blockade immunotherapy[J]. Sci Transl Med, 2014,6(226):226ra32.
[13] 115. Kyle MP, William RM, Kyle PC, et al. The evolution and future of targeted cancer therapy: from nanoparticles, oncolytic viruses, and oncolytic bacteria to the treatment of solid tumors. Nanomaterials (Basel) 2021;11(11):3018. doi: 10.3390/nano11113018.
[14] 116. Tong M, Xiyu L, Yiqun L, et al. Aptamer-based biosensors and application in tumor theranostics. Cancer Sci. 2022;113(1):7–16. doi: 10.1111/cas.15194.
[15] 117. Briolay T, Petithomme T, Fouet M, et al. Delivery of cancer therapies by synthetic and bio-inspired nanovectors. Mol Cancer. 2021;20(1):1–24. doi: 10.1186/s12943-021-01346-2.
[16] 118. Robles-Planells C, Sánchez-Guerrero G, Barrera-Avalos C, et al. Chitosan-based nanoparticles for intracellular delivery of ISAV fusion protein cDNA into melanoma cells: a path to develop oncolytic anticancer therapies. Mediators Inflamm. 2020;2020.