逆转录病毒是一类具有RNA基因组的包膜病毒。在进入宿主细胞后,它们依靠逆转录酶,将基因组从RNA逆转录为DNA,然后整合到处于分裂期的宿主基因组中,并且作为宿主细胞DNA的一部分进行复制。因此,逆转录病毒可作为外源基因转移的有效载体,已被广泛开发并用于研究基因功能和治疗、发育过程、肿瘤发生等。迄今为止,鸟类逆转录病毒载体(RCAS)及其受体(TVA)系统在哺乳动物转基因模型中得到广泛应用。
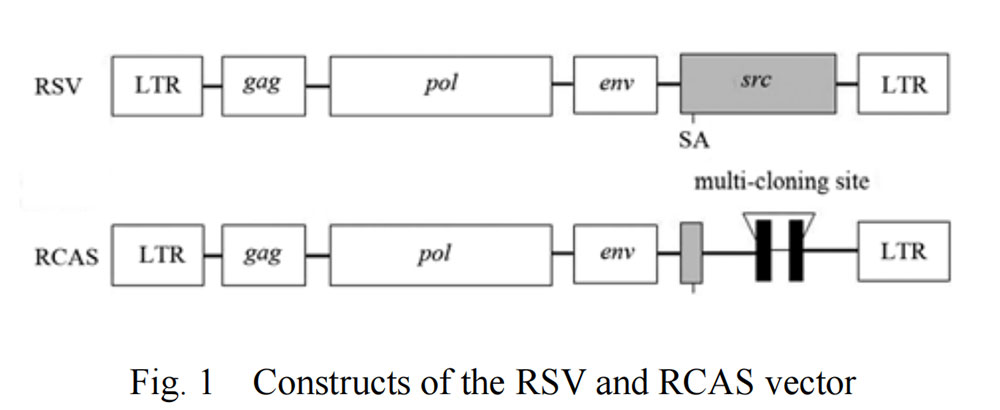
RCAS病毒是来源于Rous肉瘤病毒(RSV)SR-A株的逆转录病毒家族一员,具有剪接受体的复制型禽肉瘤-白血病病毒(ASLV)长末端重复序列(LTR)。删除RSV的src致癌基因并插入多克隆位点,该位点可以稳定地容纳高达2.5kb的插入片段(图1)。所插入基因的表达可以是由病毒长末端重复序列(LTR)或适当的内部启动子驱动。
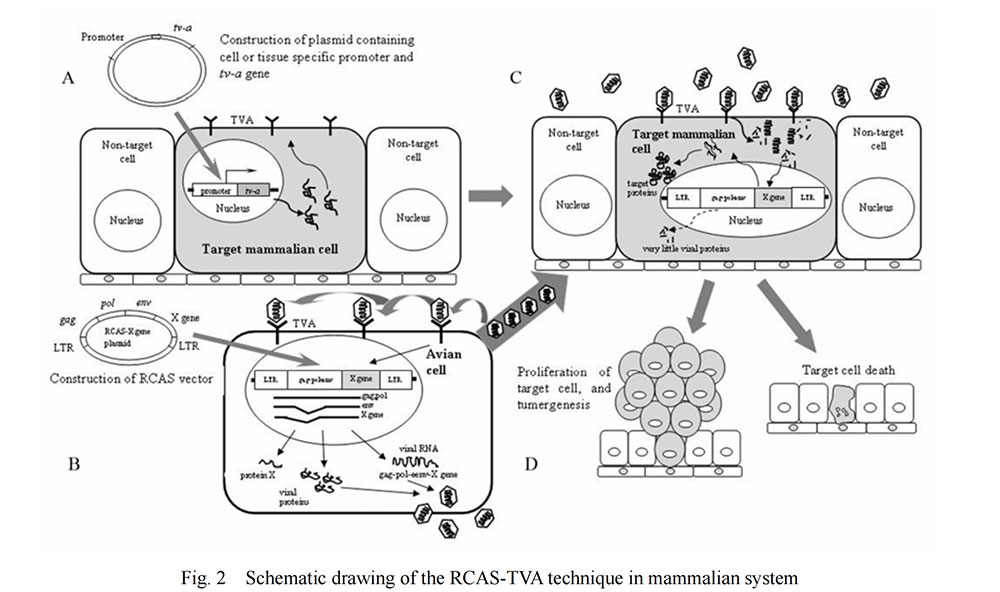
RCAS-TVA基因递送系统的基础是RCAS病毒特异性识别禽肉瘤白血病病毒亚组A(ASLV-A)受体(TVA),进入并感染细胞。TVA是低密度脂蛋白受体家族一员,由tv-a基因编码。tv-a基因转录的mRNA被选择性剪接产生至少两种蛋白质,一种跨膜蛋白和一种GPI-锚定亚型,均能被ASLV-A识别。哺乳动物细胞缺乏编码TVA的基因,通常对ASLV-A或RCAS病毒感染具有抵抗力;然而,将TVA转基因靶向特定类型细胞或小鼠组织可使这些细胞易受到基于ASLV-A的RCAS病毒感染。
RCAS病毒保留了复制所需的所有病毒基因,当RCAS载体进入细胞后可直接编码感染性颗粒并组装成所需的蛋白质,因此不需要辅助细胞。直接将RCAS载体转染鸟类细胞,如DF1细胞,可获得高滴度的RCAS病毒。基于RCAS-TVA模型的生成过程如图2所示[1]。 利用RCAS表达特定的原癌基因,可诱导特定类型细胞或小鼠组织发生癌变,形成肿瘤。
大多数人类癌症属于衰老疾病,因此理想情况下以可控的方式,在成年小鼠中模拟癌症至关重要。如针对乳腺肿瘤的一系列研究为利用RCAS-TVA系统在时空调控基因表达提供了一个很好的例子。MMTV-TVA转基因小鼠在乳腺管上皮中表达TVA,通过乳头导管将表达多瘤病毒T抗原(PyMT)的RCAS病毒注射到乳腺,可诱发乳腺肿瘤[3]。如怀孕对人类乳腺癌的影响,在交配前4-7天,通过导管内注射RCAS-caErbB2病毒转染MMTV-tva小鼠,这种乳腺癌在人类妊娠期间或分娩后5年内被才诊断出来[4]。
RCAS-TVA系统为研究人类癌症小鼠模型中的基因功能提供了一种简单快速的方法。 这些模型为特定肿瘤的起源细胞以及起始遗传病变在决定肿瘤类型中的作用提供了重要的见解。RCAS-TVA模型可与现有的转基因、敲除或敲入模型的结合,为扩展这些模型的效用提供了机会。