帕金森病作为继阿尔茨海默病之后第二常见的神经退行性疾病[1]患病人数庞大,数据显示我国现有帕金森病患者超过270万人,每年新发患者人数达10万人以上。65岁以上人群患病率为1%~2%,85岁以上的群体患病率甚至高达4%[2]。随着老年群体在世界人口中所占比例的增长,预计在未来的20年内该病的发病率将翻一番[3]。帕金森病的特征为静止性震颤、运动迟缓、僵硬和其他降低生活质量的症状,最终因无法控制运动功能而导致严重残疾[2]。其特征是黑质致密部(SNpc)多巴胺能神经元早期变性死亡,细胞内广泛存在α-突触核蛋白(α-Syn)聚集。
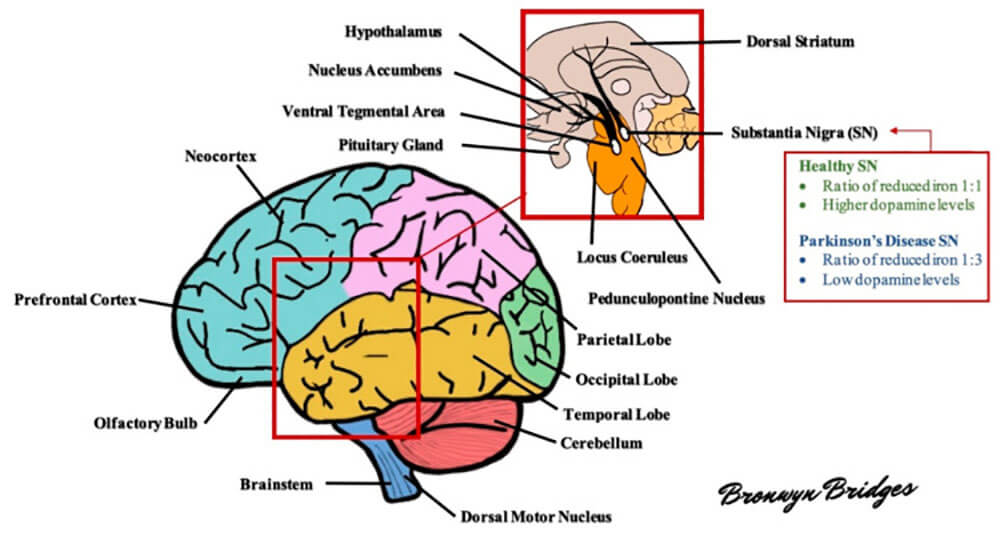
图1:帕金森病(PD)中受到不利影响的几个大脑区域
经临床研究证实帕金森病是遗传因素、环境因素,以及人口老龄化共同作用的结果,线粒体功能障碍和氧化应激等是目前临床证实其的具体机制。
线粒体为细胞提供能量,线粒体会通过呼吸作用、氧化磷酸化作用合成三磷酸腺苷,为细胞生命活动给予能量。具有线粒体呼吸抑制功能的神经毒素会导致帕金森病患者出现临床表现,从而确定了线粒体功能障碍同帕金森病发病密切相关,此结论首次确认是上世纪80年代。研究发现,出现帕金森病临床症状的患者,均进食了含有副产物的毒品,致使成分通过静脉注射从而通过脑血屏障并生成MPP物质,MPP物质联合多巴胺转运体被中脑神经元摄取[4]。截至目前,MPTP及其他线粒体复合物抑制剂(鱼藤酮),仍是目前制备帕金森病动物模型的常用环境毒素。
氧化应激反应是由体内氧化作用、抗氧化作用失衡而导致的,在氧化应激反应的影响下,机体会产生大量活性氧自由基,触发细胞损伤。近年来,临床诸多文献报道证实了氧化应激反应与帕金森病的发生和发展,具有密切关系[5]。研究证实,活性氧自由基的生成,会导致帕金森病患者脑中多巴胺能神经元丢失;而多巴胺代谢、谷胱甘肽水平降低均可导致活性氧自由基大量产生。经证实:线粒体复合物Ⅰ受到抑制后,也会对活性氧自由基的合成产生影响,而活性氧自由基又可导致线粒体DNA(mt DNA)损伤。而神经元具备一定的高代谢特性,自身承受的氧化负担较高,因此随氧化应激程度增加,黑质多巴胺对神经元的损伤程度也会大幅增加。
在帕金森病患者中,可溶性α-Syn单体最初形成低聚物,然后逐渐结合形成小的原纤维,最终形成大的且不溶性的α-Syn纤维(即构成路易小体的主要成分)[6],而在中脑特定脑区黑质致密部形成路易小体是原发性帕金森病的主要病理特征之一[7]。此外,有毒低聚物可激活小胶质细胞,诱发神经炎症,最终导致帕金森病的发生[8]。目前已证明在α-Syn的小鼠模型中能复制出帕金森病的主要病理特征[9]。
神经炎症是帕金森病的特征之一,与帕金森病风险相关的基因如LRRK2存在密切的关系。实验表明,神经炎症能促进α-Syn错误折叠、聚集从而诱导帕金森病的先天免疫和适应免疫[10]。研究认为,嗅觉系统或肠道中的组织炎症可以触发较高水平的α-Syn错误折叠,使得一些α-Syn聚集体最终逃脱了正常的降解机制[11].Sampson等人的实验证据表明,肠道微生物区系在促进小胶质细胞活化和α-Syn病理以及运动缺陷方面起着重要作用[12]。
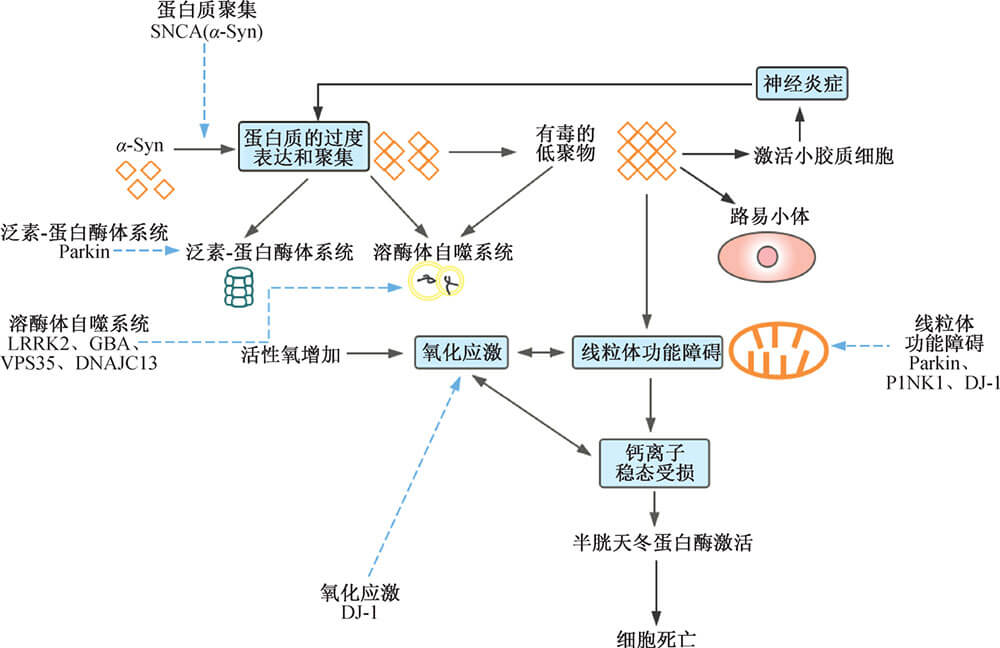
图2帕金森病的主要致病因素
迄今为止,全世界超过639万人受其影响,但却没有有效的方法可以阻止或延缓这种神经退行性变的过程。为了更好地研究PD的发病机制及临床治疗,动物模型的制备成为必不可少的研究手段。
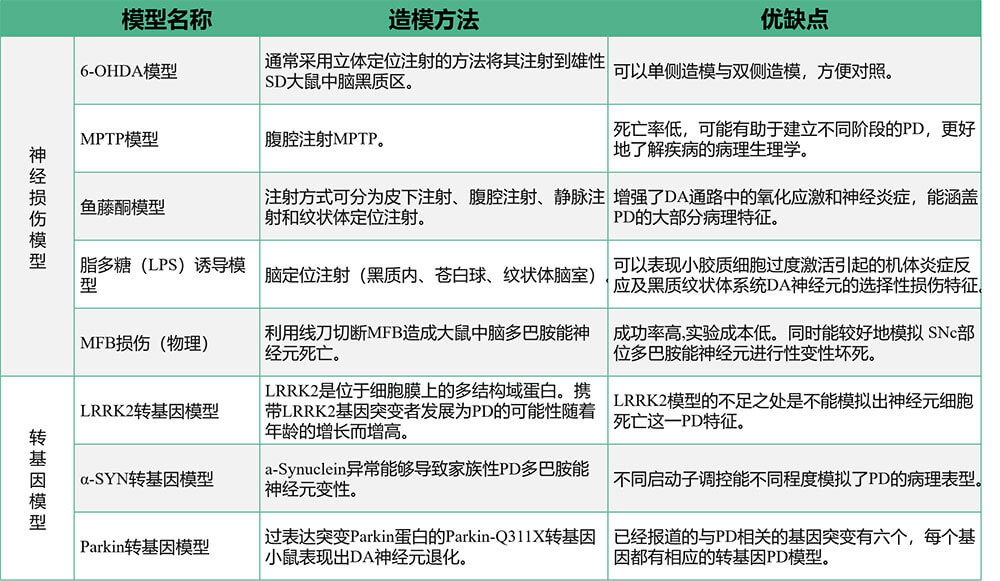
大体上,PD的动物模型可以分为三类:
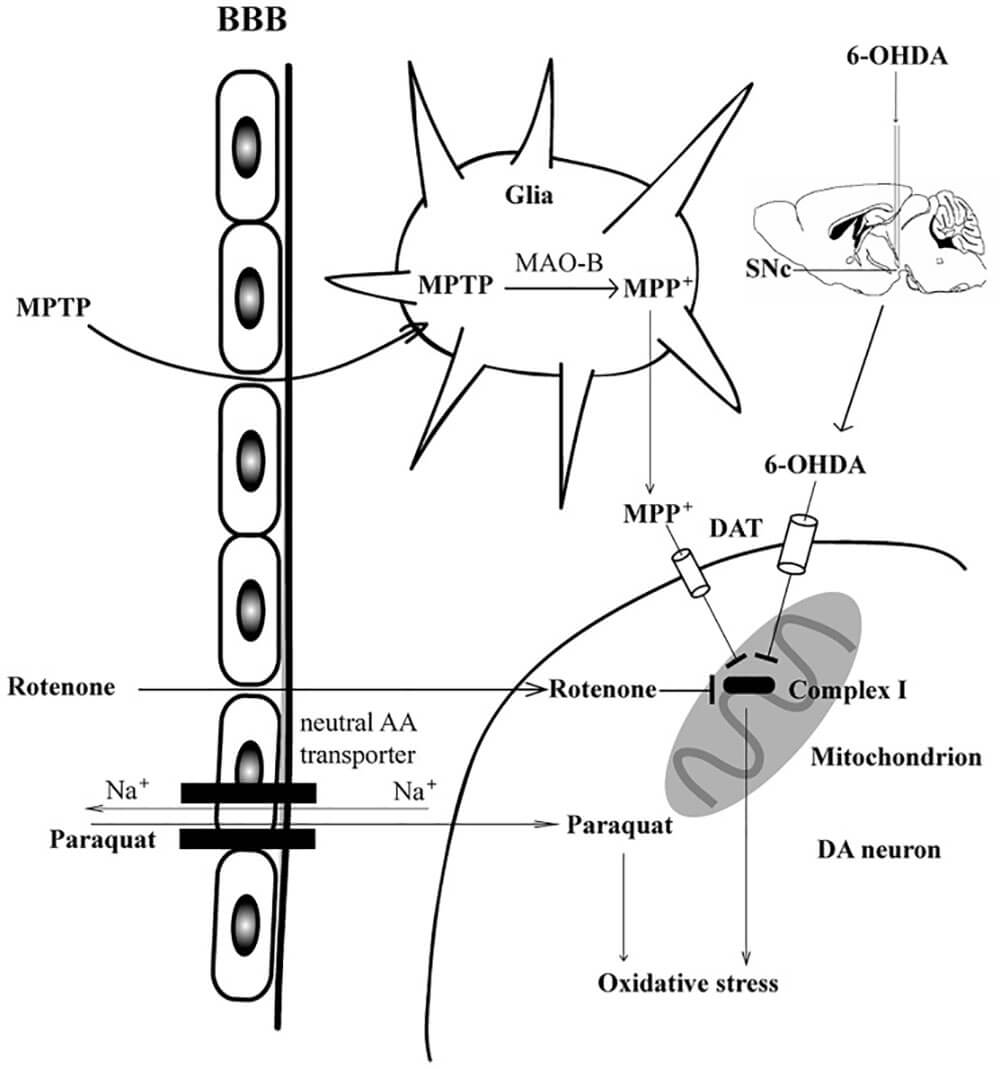
图3:多巴胺能神经毒素的给药途径和病变机制
参考文献:
[1] Spatola M, Wider C. Genetics of Parkinson’s disease: the yield[J]. Parkinsonism & Related Disorders, 2014, 20: S35-S38.
[2] Harris M K, Shneyder N, Borazanci A, et al. Movement disorders[J]. Medical Clinics of North America, 2009, 93: 371-388.
[3] Chen J J. Parkinson’s disease: health-related quality of life, economic cost, and implications of early treatment[J]. The American Journal of Managed Care, 2010, 16:S87-S93.
[4] Kin K, Yasuhara T, Kameda M,et al. Animal Models for Parkinson's Disease Research: Trends in the 2000s [J]. International Journal of Molecular ences, 2019, 20(21):5402.
[5] 赵颖,戴惟葭,刘大川.不同程度帕金森病患者视盘参数及视网膜神经纤维层厚度定量分析[J].中华眼底病杂志,2020,36(1):15-19
[6] Melki R. Role of different alpha-synuclein strains in synucleinopathies, similarities with other neurodegenerative diseases[J]. Journal of Parkinson’s Disease, 2015, 5(2): 217-227.
[7] 陈加俊, 田明秀, 李兴安, 等. 帕金森病路易(小)体的蛋白质生物信息学数据分析[J]. 生物化学与生物物理进展,2013, 40 (11): 1100-1106.
[8] 游静, 顾乔乔, 余子云, 等. 帕金森病发病机制的研究进展[J]. 赣南医学院学报,2019, 39 (7): 733-737.
[9] Hasegawa M,Nonaka T,Masuda-Suzukake M.Prion-like mechanisms and potential therapeutic targets in neurodegenerative disorders[J]. Pharmacology & Therapeutics, 2017, 172:22-33.
[10] Gao H M, Kotzbauer P T, Uryu K, et al. Neuroinflammation and oxidation/nitration of alpha-synuclein linked to dopaminergic neurodegeneration.[J]. Journal of Neuroscience, 2008, 28(30): 7687-7698.
[11] Carla M L T, Tyson T, Rey N L, et al. Inflammation and α-synuclein’s prion-like behavior in Parkinson’s disease--is there a link?[J]. Molecular Neurobiology, 2012, 47(2): 561-574.
[12] Sampson T, Debelius J, Thron T, et al. Gut microbiota regulate motor deficits and neuroinflammation in a model of Parkinson’s disease[J]. Cell, 2016, 167(6): 1469-1480.
布林凯斯在神经系统疾病相关药效药理评价领域能为您提供一站式从基因分子层次到细胞组织层次再到神经环路最后到动物作为整体的行为学评价平台。
在基因分子层次,通过基因编辑,基因干扰,原位杂交,免疫组化等技术手段,验证基因或蛋白对于细胞生理代谢信号转导、基因表达调控等影响进行研究,并在此基础上结合行为实验验证某分子的功能。
在神经环路层次,我们可以通过环路示踪、光遗传学、化学遗传学、电生理等手段分析不同脑区、不同类型神经元之间形成的神经环路结构和功能。此类研究是目前神经科学的重点发展方向之一。理解神经元联系变化带来的巨大表型差异,并对其进行深入的操作和分析。
同时,布林凯斯也提供神经系统疾病造模后的高精度动物行为检测平台包括但不限于:认知功能检测,运动功能检测,清醒动物多通道在体电生理记录、呼吸记录、听觉、痛觉、焦虑、抑郁、嗅觉功能相关的行为学检测等。
还可提供MRI/fMRI/PET-CT的小动物活体成像,心脏超声,X光片,组织荧光成像(全脑玻片扫描、组织免疫荧光成像)、钙成像、共聚焦双光子成像。