AAV是基因治疗领域最常用的病毒载体之一,近年来,AAV基因疗法已在多种适应症上取得了进展,包括罕见眼科疾病、血友病、罕见肌肉疾病、中枢神经系统疾病、溶酶体贮积症等。AAV作为一种小型无包膜细胞病毒在递送系统中有很多优势,比如无致病性、高效持续表达、易于操作以及免疫原性低等。由于物种间的生物学差异性,但全身给药后的副作用并没有在小鼠或临床前动物模型中观察到。因此,改进病毒载体以应对AAV在不同物种间的转译差异,减轻潜在风险,改善与AAV基因治疗相关的治疗窗口,并且能够更好地预测建模,从而导致有效的临床转化。
杜克大学医学院Aravind Asokan团队在“Nature Communications”发表文章“Cross-species evolution of a highly potent AAV variant for therapeutic gene transfer and genome editing”,研发了一种高效的、跨物种兼容的AAV变体(AAV.cc47),实验结果表明在正常小鼠和患病小鼠模型中,相比于AAV9,变体AAV.cc47处理组报告基因和治疗基因表达量更高,Cre重组和CRISPR基因组编辑效率也更高。AAV.cc47载体增强的转导效率在猕猴和猪中得到进一步证实,为潜在临床转化和人类基因治疗提供了强有力的理论依据。

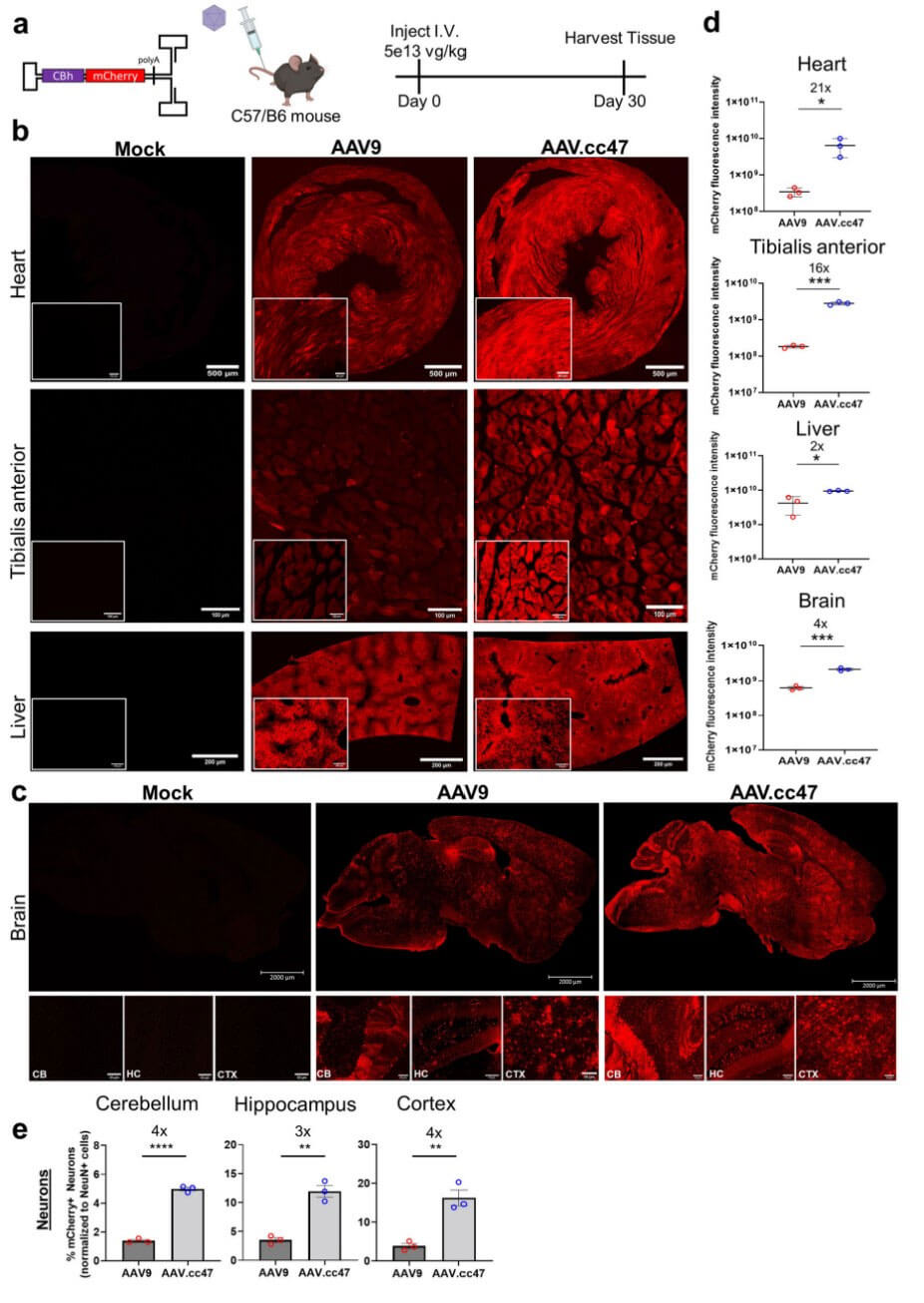
在正常鼠中,比较AAV.cc47和AAV9的转导效率,结果显示心脏、胫骨前肌和大脑中AAV.cc47的转导效率增加,另外AAV.cc47在肝脏转导效率的增加存在统计学意义(图2b,c)。对心脏、胫骨前肌和肝脏的荧光强度进行定量分析,结果显示AAV.cc47的荧光强度分别高出21倍、16倍和2倍(图2d)。相比于AAV9,AAV.cc47在皮层(CTX)、小脑(CB)和海马体(HC)中转导神经元数量更多,转导量分别增加了4倍、3倍和4倍。在Ai9小鼠心脏、胫骨前肌和大脑中,AAV.cc47的转导效率增加,而肝脏的转导效率没有明显差异。研究表明,AAV.cc47和AAV9在各组织中生物分布没有差异(图3e),而组织中载体基因组拷贝数存在载体剂量依赖性。
此外,研究表明AAV.cc47对大脑神经元细胞的靶向性更强。在Ai9小鼠中检测两种AAV血清型的基因组编辑效率,结果显示心脏和骨骼肌中AAV.cc47-CRISPR基因组编辑效率更高。有趣的是,与AAV9相比,AAV.cc47处理组小鼠三种组织中gRNA的表达量都增加了3-4倍。
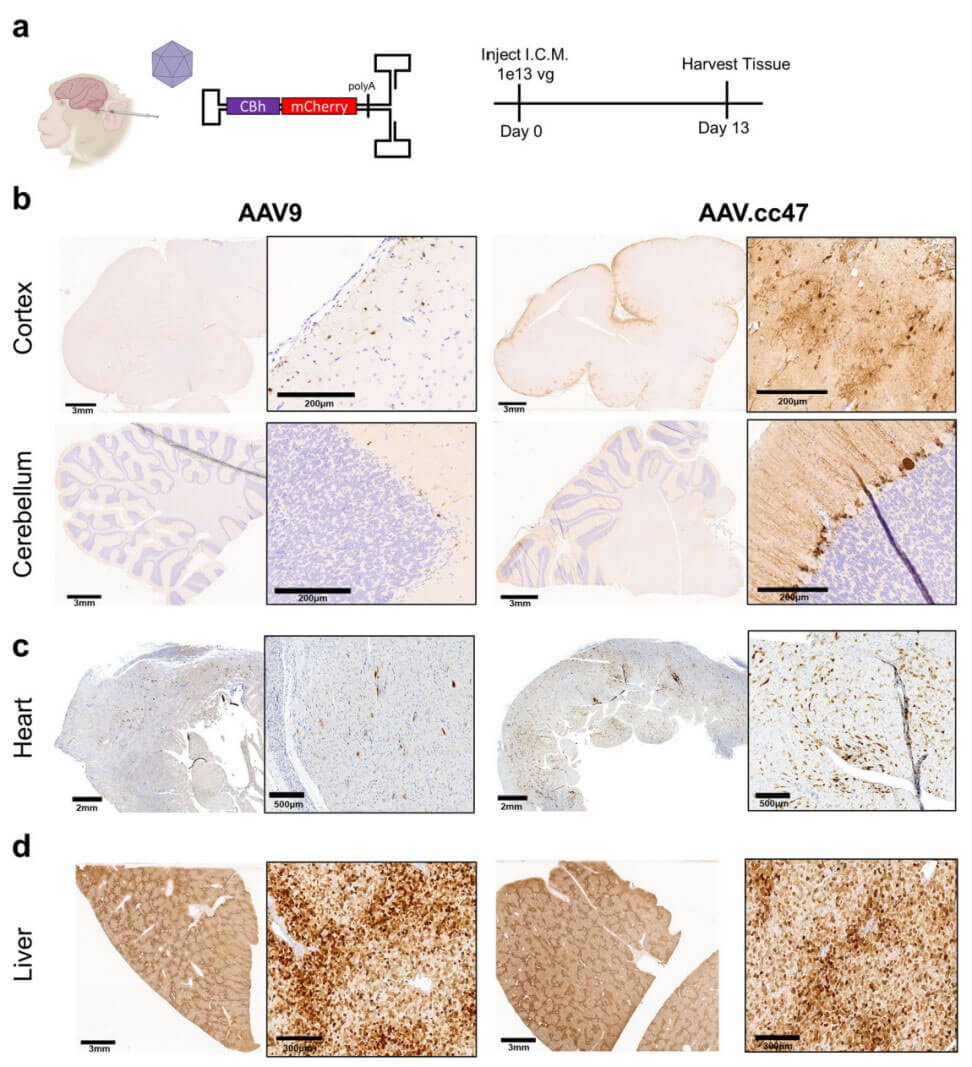
通过脑室注射方式比较AAV.cc47和AAV9在非人灵长类食蟹猴中的转导效率,结果显示在猴子大脑皮质和小脑中AAV.cc47表达和扩散能力更强,而在大脑皮质中AAV.cc47表现出更高的渗透能力。与AAV9相比,AAV.cc47对皮质神经元、胶质细胞和浦肯野细胞有更高的转导效率。为了评估AAV.cc47在其他物种的转导效率,研究人员在新生鼠和猪上进行了测试,结果说明AAV.cc47是一种跨物种兼容的载体,能够在小鼠、猪和NHPs大脑中实现更高的转导效率。
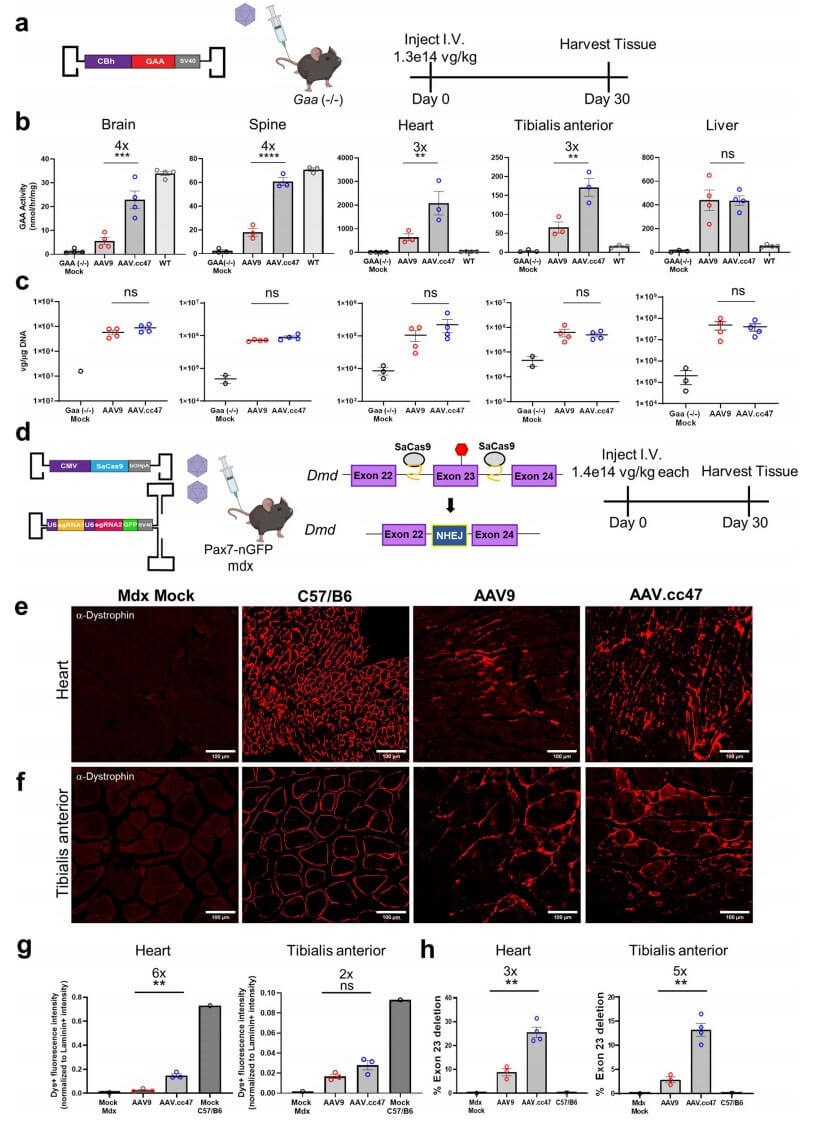
庞贝氏症(Pompe disease)是一种罕见疾病,又称为酸性α-葡萄糖苷酶缺乏症 或糖原贮积症Ⅱ型(GSDⅡ)。由于溶酶体内缺乏酸性α-葡萄糖苷酶(GAA),使糖原及麦芽糖不能转化为葡萄糖而被利用,以致体内大量糖原在骨骼肌、心肌和平滑肌等组织细胞内聚积而致病。为了探究AAV.cc47载体在小鼠疾病模型中递送治疗基因的能力,研究人员在庞贝病(Gaa−/−)小鼠模型中对AAV.cc47和AAV9载体递送能力进行了比较。给药后4周小鼠脑组织中GAA酶水平分析结果显示,AAV.cc47-GAA处理组GAA表达量更高,而且酶活性水平达到WT小鼠的67%,而在AAV9-GAA处理组的小鼠中只有WT水平的16%。在小鼠心脏和胫骨前肌中,只有AAV.cc47-GAA处理组酶活性显著增加。
杜氏肌营养不良是一种进行性的骨骼肌衰弱疾病,本病的发生是由于X染色体上编码肌营养不良蛋白的DMD基因的突变所引起。在mdx小鼠心脏中,AAV.cc47-CRISPR处理组比AAV9组的抗肌肉萎缩蛋白表达高6倍。在mdx小鼠的胫骨前肌,AAV.cc47-CRISPR处理组抗肌萎缩蛋白恢复率比AAV9组高2倍。定量结果表明与AAV9相比,AAV.cc47介导的基因组编辑使心脏和胫骨前肌第23外显子缺失的转录本分别增加了3倍和5倍。
本研究证实了跨物种进化可以产生高效的AAV变体,并且能够在不同临床前动物模型中转导多种组织。在三种不同的动物模型中,通过VR-IV残基饱和诱变进化了衣壳库,显著改善了AAV9的转导谱。这种跨物种方法适用于AAV文库的进化和筛选,当与启动子特异性选择策略结合时,可以提高下一代AAV载体的临床可转译性。