近年来,基因治疗成为医学研究的热点,尤其是针对遗传性眼病的治疗。然而,如何高效、安全地将治疗基因传递到眼部细胞,一直是该领域面临的挑战。重组腺相关病毒(rAAV)因其高效性和安全性,在临床应用中显示出巨大潜力。但现有的rAAV载体在剂量限制性、免疫毒性和组织特异性靶向方面存在局限。
四川大学华西药学院孙逊教授在Nature Communications期刊发表了题为“An adeno-associated virus variant enabling efficient ocular-directed gene delivery across species”的研究论文,本研究提出了一种新型AAV载体——AAVv128,它在跨物种的眼部基因传递中展现出更高的转导效率和更广泛的视网膜组织分布。这一发现不仅为眼科基因治疗提供了新的工具,还可能减少治疗过程中的注射频率,提高患者的生活质量。

研究人员通过改良自然衍生的AAV8衣壳,设计出AAVv128,并在小鼠、兔子和非人灵长类动物模型中展示了其对光感受器和视网膜色素上皮细胞的显著转导效率提升。在激光诱导的脉络膜新生血管(CNV)非人灵长类动物模型中,AAVv128携带的抗VEGF基因完全抑制了CNV病变,相比AAV8表现出更优的治疗效果。通过冷冻电镜分析,揭示了AAVv128在AAV结合、核摄取和体内逃逸方面的关键残基,展现了更强大的优势。
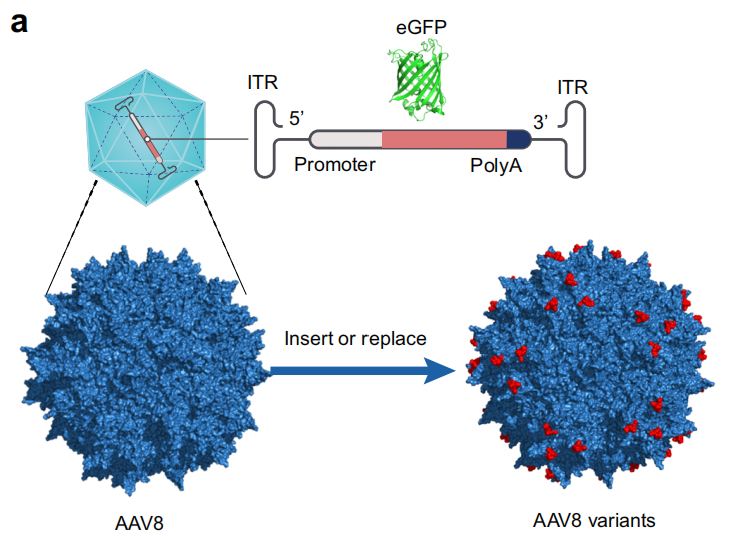
图1 与胜利或失败相关的dmPFC下游脑区
AAVv128的优势主要体现在以下几个方面:
1、提高的转导效率:AAVv128在视网膜的光感受器和色素上皮细胞(RPE)中显示出比AAV8更高的转导效率,无论是通过哪种给药途径(玻璃体腔、脉络膜上腔和视网膜下腔)。
2、更广泛的视网膜组织分布:AAVv128在视网膜不同层的转导更为广泛,这一现象在小鼠、兔子和非人灵长类动物模型中一致观察到,突出了AAVv128跨物种的转导特性。
3、更强的治疗效果:在激光诱导的脉络膜新生血管(CNV)非人灵长类动物模型中,AAVv128通过脉络膜上注射并表达抗VEGF蛋白,相比AAV8展现出更有效的治疗效果。
4、结构优势:冷冻电镜(cryo-EM)分析显示,AAVv128在AAV结合、核摄取和内体逃逸方面的关键残基表现出更显著的优势,可能形成“海绵效应”,增强了与细胞表面受体的相互作用。
5、热稳定性和细胞转导:AAVv128的热稳定性与AAV8相当,并且在体外显示出更强的细胞转导能力。
6、更高的感染能力:AAVv128在HeLaRC32细胞中的感染能力是AAV8的10倍,这进一步支持了AAVv128在小鼠模型中观察到的优越转导效率。
7、特异性转导:AAVv128在ARPE19、HeLaRC32和HEK293细胞中显示出比AAV8更特异性的转导。
8、减少注射频率的潜力:AAVv128通过提供持续和针对性的蛋白质表达,可能减少治疗年龄相关性黄斑变性(nAMD)所需的频繁注射次数,提高治疗的便利性和有效性。
9、预防nAMD的潜力:在激光诱导的CNV模型中,AAVv128-抗VEGF载体通过脉络膜上注射可以有效预防nAMD,并且在NHP视网膜组织中产生更强健的转导和VEGF抑制。
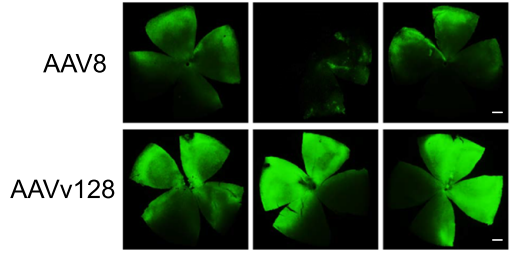
AAVv128作为一种新一代的眼部基因治疗载体,其高效的转导能力和广泛的组织分布,为治疗年龄相关性黄斑变性等眼科疾病提供了新希望。这一突破性研究不仅推动了基因治疗领域的发展,也为患者带来了更安全、更有效的治疗选择。
本文未经授权禁止转载
如有需要,可联系小编获取原文