胰腺包含外分泌和内分泌两部分。外分泌部分占胰腺质量的95%,产生消化酶;内分泌部分由胰岛组成,包含β细胞、α细胞等,共同维持血糖水平。胰腺对于正常的代谢和消化至关重要,神经信号在调节这些功能中扮演关键角色。然而,由于缺乏对胰腺神经输入的详细了解,以及缺乏特异性调节胰腺神经功能的特异性工具,胰腺神经在调节代谢和消化过程中的具体作用尚未得到充分阐明。
研究者使用组织透明化技术(tissue clearing)和逆行示踪(retrograde tracing)技术,结合腺相关病毒(AAVs)的靶向递送,绘制了胰腺的神经节输入,并验证了胰腺副交感神经和交感神经在血糖调节中的作用。通过优化AAVs的血清型、启动子和递送途径以特异性地靶向胰腺神经。研究发现AAV8和9更倾向于转导传出神经,而rAAV2-retro主要靶向传入神经。这项研究提供了一种方法来精确调节特定的胰腺神经,以研究它们在代谢和消化中的作用,并为糖尿病、胰腺炎和胰腺癌等胰腺疾病提供了潜在的治疗途径。

外周神经节可以调节器官功能,整合输入,并可能独立于中枢控制,因此描述参与胰腺神经支配的神经节为其神经调节提供了重要的信息。胰腺受交感神经节(如腹腔神经节,CG)、副交感神经节(如迷走神经节,NG)和感觉神经的高度支配。通过整个胰腺组织透明化技术和特异性神经标记物染色,证实了外分泌和内分泌神经纤维的密集网络。具体来说,囊泡性乙酰胆碱转运体(VAChT)被用来标记传出副交感神经纤维,而酪氨酸羟化酶(TH)则用于标记传出交感神经纤维。为了确定自主神经和感觉输入对胰腺神经支配的投射,研究人员在胰腺内注射非病毒示踪剂,霍乱毒素β(CTB),并定量了外源性和内在神经节中的CTB+胰腺投射神经元:CG、NG、DRG组成外源性神经节,胰腺内神经节组成内源性神经节。研究发现在小鼠中,CG对胰腺的大量输入投射,实质感觉神经支配来自迷走神经和脊髓的感觉神经元,胰腺由左右感觉神经节的不同神经群支配。
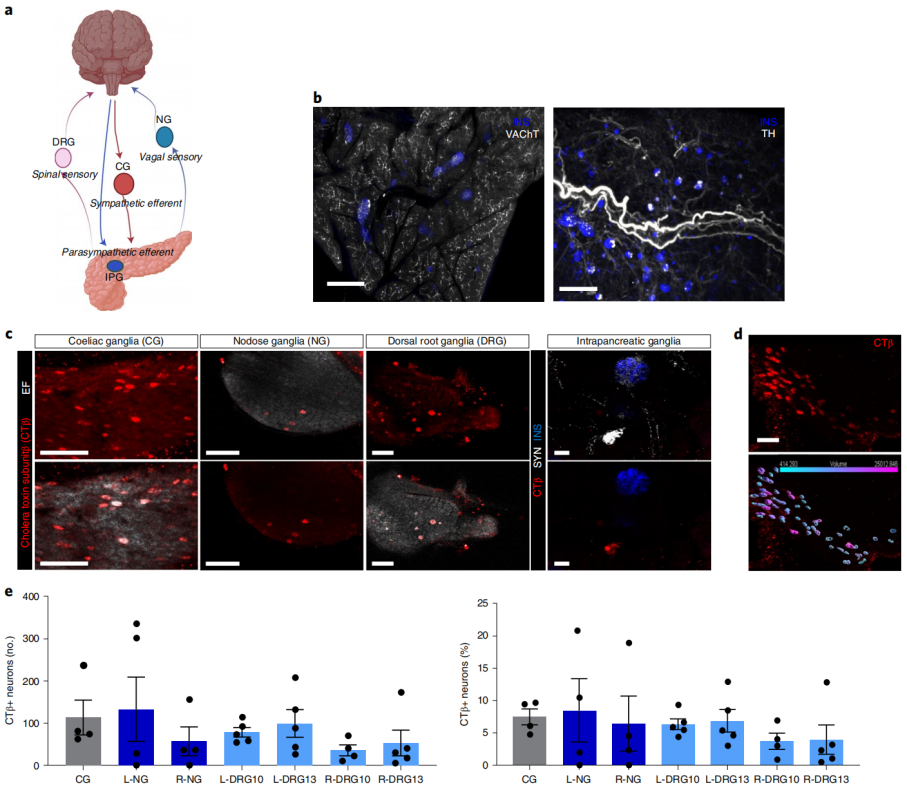
图1 胰腺由腹腔、结节、背根和胰腺内神经节的神经元支配
使用染料和CTB等非病毒示踪剂进行的神经示踪可能有部分顺行扩散和注射位点的荧光亮度过高,使得可视化短距离神经连接如胰内神经节的连接变得困难。相比之下,病毒示踪剂可以通过表达荧光蛋白提供特异性的逆行示踪和明亮的长程连接。因此,可以用AAV优化逆行病毒示踪,以更好地绘制支配胰腺的内在和外在神经节。研究者们通过胰腺内注射不同的AAV血清型(包括AAV6、AAV8、AAV9和rAAV2-retro),来确定哪些血清型能够有效地转导胰腺神经节。研究发现AAV8和AAV9血清型能够有效地转导传出神经节(如腹腔神经节CG和胰腺内神经节),而rAAV2-retro血清型主要靶向传入神经节(如迷走神经节NG),但其转导效率较低。AAV6血清型在CG、NG和DRG中的转导效率较低。增加AAV8的滴度可以提高CG和胰腺内神经节中的mCherry表达。通过结合神经元特异性启动子和miR122靶位点,研究者们成功地将基因表达限制在胰腺神经节中,减少了非靶器官(如肝脏)的基因表达。
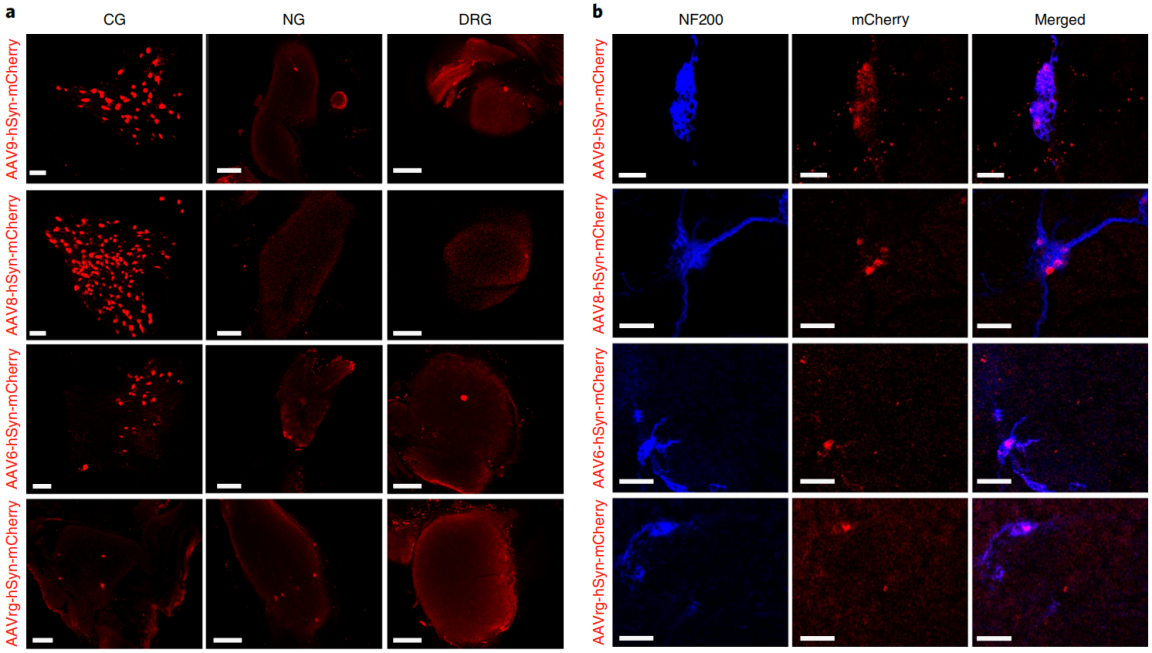
图2 AAV血清型选择性地靶向胰腺自主传出神经和传入神经
接下来,研究人员应用了上述识别的病毒血清型、启动子和滴度,以实现对胰腺神经支配的高度靶向调控。首先评估了胰腺副交感神经支配是否足以调节葡萄糖稳态。在小鼠中,胰腺胆碱能传出神经元的细胞体位于胰腺内神经节,并且其纤维密集地支配着胰腺组织,包括胰岛。迷走神经刺激调节了传入和传出纤维,而电刺激和药理学方法同时影响多个代谢活跃的器官(肝脏、肠道、肌肉、脂肪)。为了精确探究胰腺副交感神经传出纤维的生理功能,研究人员采用了优化的血清型、启动子、病毒滴度和递送路径,使用化学遗传学工具,实现对特定神经网络的靶向调控。通过胆管内灌注(剂量5倍)的方式,将依赖于cre的激活型hM3D(Gq)化学遗传构建物(AAV-Syn-DIO-hM3D(Gq)-mCherry)使用AAV8血清型递送至ChAT-IRES-CRE小鼠中,胰腺内神经节的胆碱能神经元被标记。数据表明,选择性激活胰腺副交感神经传出神经支配显著增加了雄性小鼠的血浆胰岛素和改善葡萄糖耐量,而不加重低血糖。
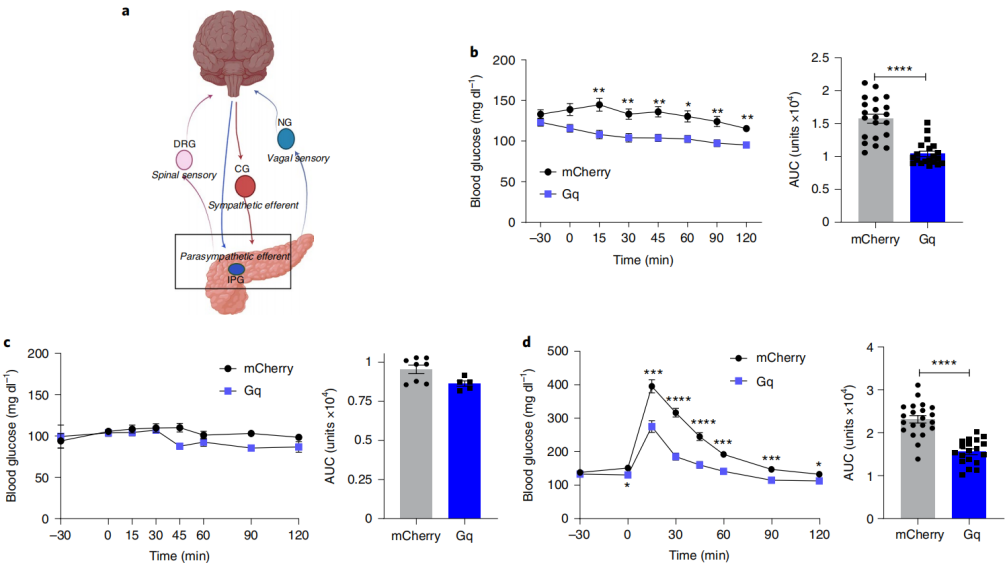
图3 胰腺副交感神经的激活可改善血糖调控
已有研究表明,刺激腹腔神经可以增加胰高血糖素并抑制胰岛素的释放。然而,这种方法调节的是到腹腔神经节的前交感神经输入,因此会影响到多个腹腔内器官。腹腔神经还携带来自多个器官的感觉传入信号,因此即使在体外研究中,也不可能隔离传出交感神经激活对胰腺功能的影响。为了确定投射到胰腺的交感神经节对血糖控制的作用,研究人员采用了双病毒方法来特别激活胰腺投射的交感神经元。胰腺内注射血清型AAV8-hSyn-cre-GFP,将cre重组酶传递到腹腔神经节和CG中的投射到胰腺的神经元,以及腹腔内注射AAVdj-hSyn-DIO-hM3D(Gq)-mCherry或hSyn-DIO-mCherry,在CG中的胰腺投射交感神经元中特异性表达hM3D(Gq)或mCherry。结果显示在CG中的交感神经元中有hM3D(Gq)-mCherry表达,在胰腺内神经节中没有hM3D(Gq)-mCherry的表达。使用CNO激活胰腺投射的交感神经显著损害了糖耐受能力,与注射AAV8-hSyn-DIO-mCherry的对照组动物相比,AUC(曲线下面积)增加了20%,且对基础血糖没有影响,在胰岛素耐受性试验中,靶向刺激胰腺投射的交感神经并没有改变血糖。由于一个交感神经元亚群同时投射到胰腺和肝脏,研究人员使用丙酮酸耐受性测试评估了激活胰腺投射的交感神经元对肝脏糖异生的影响,在丙酮酸耐受性试验中,hM3D(Gq)-mcherry表达组与对照组在丙酮酸耐受性试验期间的血糖无差异。
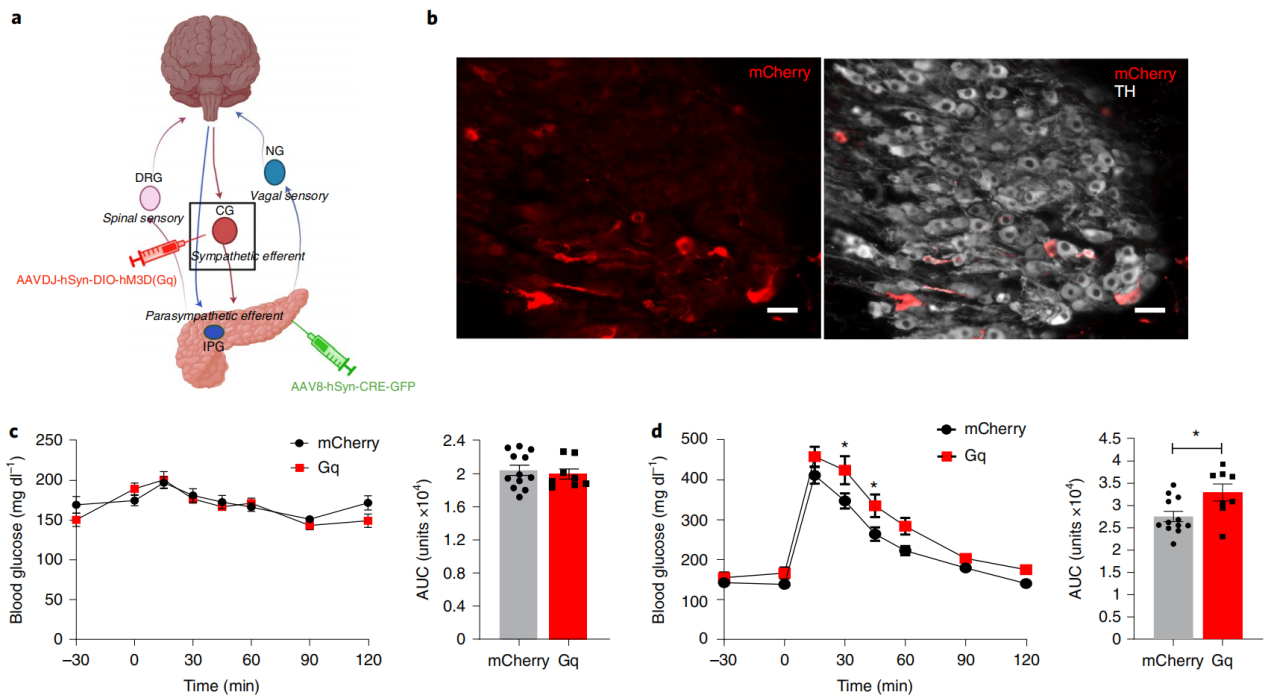
图4 胰腺交感神经激活干扰葡萄糖稳态
通过精确映射和特异性激活胰腺神经节,可以明确胰腺副交感神经和交感神经在调节血糖稳态中的作用。不仅增进了我们对胰腺神经调控机制的理解,而且为开发针对特定神经途径的治疗方法提供了新的策略,这对于治疗糖尿病等代谢性疾病具有潜在的重要临床价值。
本文未经授权禁止转载
如有需要,可联系小编获取原文