rAAV(重组腺相关病毒)非常适合眼部基因治疗。眼睛的免疫特权环境结合rAAV的低免疫原性,不会引发强烈的先天免疫反应,降低了不良免疫反应的风险。此外,rAAV能够靶向广泛的视网膜细胞,包括光感受器、视网膜色素上皮(RPE)和节细胞,目前已经开发出各种AAV衣壳以优化特定细胞类型的转导。AAV1、AAV2、AAV5和AAV8血清型均可有效转染光感受器和视网膜色素上皮细胞。AAV2是眼科基因治疗中研究和应用最广泛的血清型之一,在许多临床试验中被成功用作载体,包括针对Leber先天性黑蒙(LCA)和脉络膜病变的试验。其他常用的血清型包括AAV5和AAV8,每种都提供了独特的优势。AAV5-hRKp.RPGR的眼底注射是安全的、耐受性良好,并改善了携带XLRP-RPGR的男性患者的视网膜敏感性和功能性视力。AAV8可以通过眼底注射给药,比AAV2更能有效地转导光感受器。

在眼科治疗中,rAAV(重组腺相关病毒)可以通过三种常见的给药途径来传递到视网膜:视网膜下注射(subretinal injection)、玻璃体腔注射(intravitreal injection)和脉络膜上注射(suprachoroidal injections)。
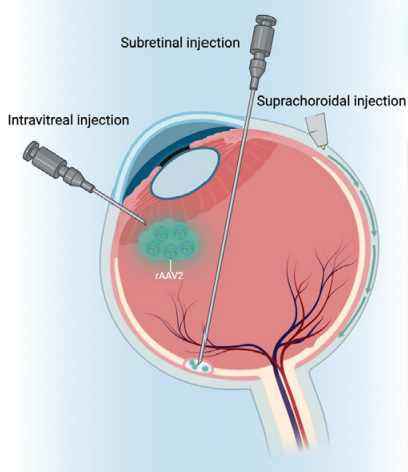
图1 AAV眼部基因治疗注射示意图【1】

实例一
AAV传递的光感受细胞特异性CRISPR/Cas9系统【2】
血清型:AAV8
启动子:RK(human rhodopsin kinase promoter)
实验动物:Nrl-L-EGFP小鼠,2周龄
注射方案:视网膜下注射,表达10周
实验结果:AAV-CRISPR/Cas9系统的敲低效率是使用增强型绿色荧光蛋白(EGFP)基因作为目标进行评估的。将AAV8(AAV-sgRNA-EGFP)与AAV-Cas9混合注射到2周大的Nrl-L-EGFP小鼠,视网膜下注射2.5×10^9 vg/eye AAV-Cas9和2.5×10^9 vg/eye AAV-sgRNA-EGFP。估计被sgRNA转导的杆细胞中有43%被成功敲除了EGFP基因。其余57%细胞未能被敲除EGFP的原因可能是缺乏Cas9表达、框内插入缺失无法消除EGFP表达和/或小鼠体内存在多个EGFP基因拷贝超出CRISPR介导基因消除的能力。
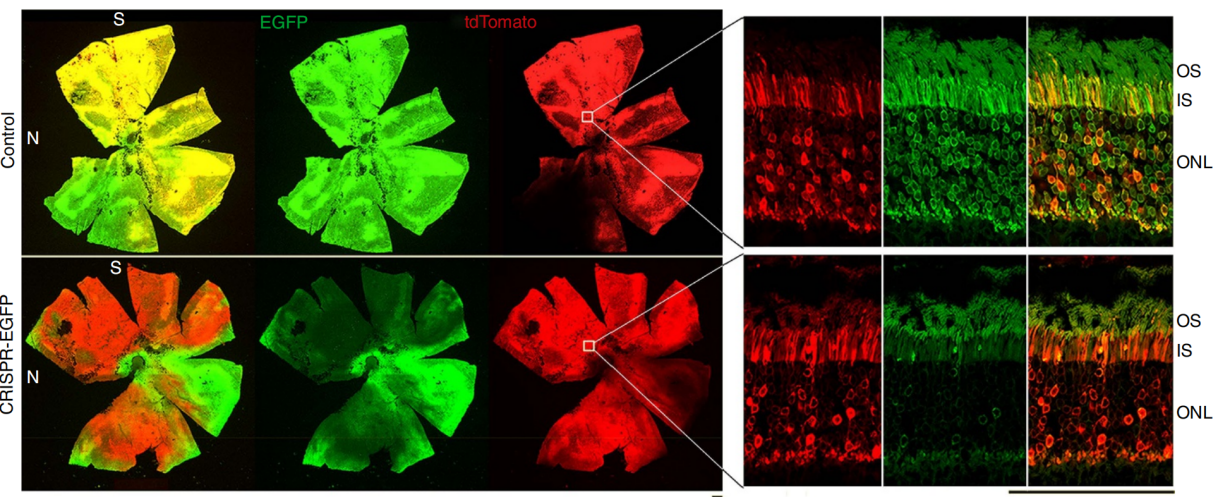
图2 AAV-CRISPR/Cas9在小鼠视网膜中抑制EGFP
实例二
CaMKII的重新激活可以保护RGC免受兴奋性毒性或轴突损伤【3】
血清型:AAV2
启动子:mSncg(mouse g-synuclein promoter),CAG
实验动物:C57BL/6小鼠,8周龄
注射方案:玻璃体腔注射,表达2周
实验结果:为了研究增强CaMKII的活性是否足以保护RGCs免受兴奋毒性或轴突损伤,在损伤开始前2周通过玻璃体腔注射AAV2(AAV-CaMKIIa T286D,滴度2×10^13 vg/ml),介导CaMKII突变基因在RGCs中表达。AAV2可有效转导95%以上的视网膜神经节细胞(RGCs),结果显示在RGCs中CaMKIIa T286D突变体的表达水平是内源性CaMKII的60%,CaMKIIa T286D突变体对RGC具有很强的保护作用。在小鼠损伤和疾病模型中,通过AAV基因治疗重新激活CaMKII活性可以保护RGCs,并保留视觉功能。

图3 AAV介导RGCs基因转导
实例三
TASK-3介导的非图像形成行为和图像形成行为【4】
血清型:AAV2
启动子:NEFL(the RGC-specific promoter Ple345)
实验动物:TASK-3 KO小鼠
注射方案:玻璃体腔注射,2×10^10 vg/eye,表达3周
实验结果:为了检测RGCs中的TASK-3通道是否足以维持PLR的敏感性,使用病毒载体和RGC特异性启动子在TASK-3 KO小鼠的RGCs中过表达TASK-3通道。包装生产出AAV2-Ple345(NEFL)-kcnk9-HA(AAV2-TASK-3)和AAV2-Ple345(NEFL)-EGFP(AAV2- control),并通过玻璃体腔注射到TASK-3 KO小鼠的双眼,3周后检测其表达特异性。结果显示TASK-3在RGC中特异性表达,接受TASK-3过表达的TASK-3 KO小鼠与接受对照病毒注射的TASK-3 KO小鼠相比,PLR的敏感性增强。
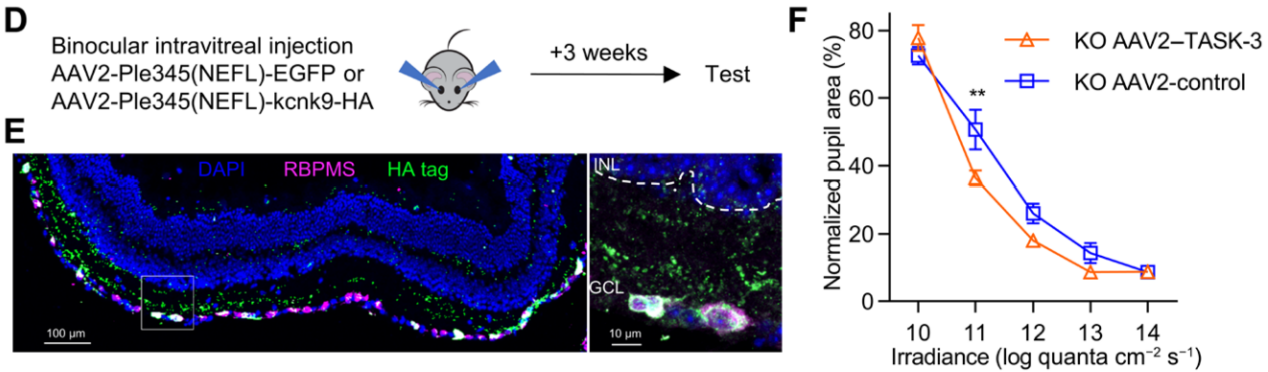
图4 AAV介导TASK-3在RGCs中过表达
实例四
高效跨物种眼部基因传递AAV病毒【5】
血清型:AAVv128
启动子:CMV
实验动物:食蟹猴
注射方案:脉络膜上注射,2×10^10 vg/eye,表达3周
实验结果:通过脉络膜上注射评估了AAV8和AAVv128- eGFP载体在NHPs中的视网膜转导效率,在注射后第14天可检测到eGFP的表达。通过扫描激光检眼镜(SLO)对动物进行体内视网膜荧光成像,以检测eGFP的表达,然后进行免疫荧光分析。通过食蟹猴脉络膜上注射AAV,剂量为3.5×10^12 vg/eye时,荧光成像显示,使用AAVv128载体时外周血眼底的eGFP荧光显著增加。
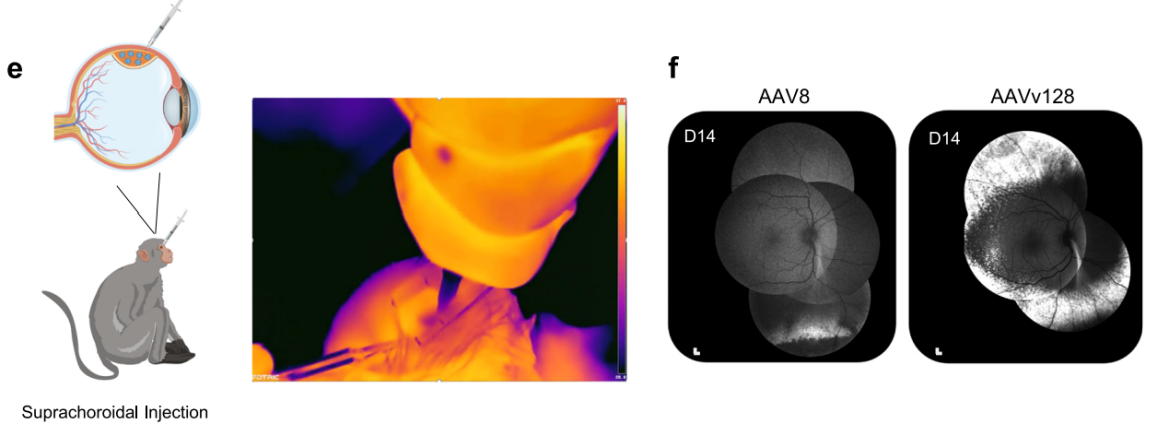
图5 NHPs眼内注射评价AAV8和AAVv128的转导效果
布林凯斯可提供各类病毒包装定制化服务
请联系小布18971216876(微信同号)
或咨询当地销售经理获取更多信息
本文未经授权禁止转载
如有需要,可联系小编获取原文
参考文献
1、Wang JH, Zhan W, Gallagher TL, Gao G. Recombinant adeno-associated virus as a delivery platform for ocular gene therapy: A comprehensive review. Mol Ther. Published online October 28, 2024.
2、Yu W, Mookherjee S, Chaitankar V, et al. Nrl knockdown by AAV-delivered CRISPR/Cas9 prevents retinal degeneration in mice. Nat Commun. 2017;8:14716.
3、Guo X, Zhou J, Starr C, et al. Preservation of vision after CaMKII-mediated protection of retinal ganglion cells. Cell. 2021;184(16):4299-4314.e12.
4、Wen X, Liao P, Luo Y, et al. Tandem pore domain acid-sensitive K channel 3 (TASK-3) regulates visual sensitivity in healthy and aging retina. Sci Adv. 2022;8(36):eabn8785.
5、Luo S, Jiang H, Li Q, et al. An adeno-associated virus variant enabling efficient ocular-directed gene delivery across species. Nat Commun. 2024;15(1):3780.