神经肽作为一类重要的生物活性分子,在神经系统中扮演着不可或缺的角色。它们通过与特定的受体结合,参与调节神经元的发育、突触可塑性以及多种行为和情绪反应。神经肽的异常表达或功能失调与多种神经疾病,包括疼痛、抑郁症、焦虑症、精神分裂症以及神经退行性疾病等,有着密切联系。传统的神经肽研究方法,如免疫组织化学、放射免疫分析和分子生物学技术,虽然在一定程度上揭示了神经肽的分布和功能,但这些方法往往缺乏在活体动物中实时监测神经肽释放的能力。因此,研究者迫切需要一种能够特异性监测和操纵神经肽释放的工具,以便加深对神经肽在生理和病理状态下动态变化的理解。
2024年7月22日,美国索尔克生物研究所的Sung Han研究组在Cell杂志在线发表题为"Presynaptic sensor and silencer of peptidergic transmission reveal neuropeptides as primary transmitters in pontine fear circuit"的研究论文,该研究创建了两种新型的基因编码工具LDCV传感器(CybSEP2)和LDCV沉默器(NEPLDCV),分别用于监测和抑制神经末梢神经肽的释放。
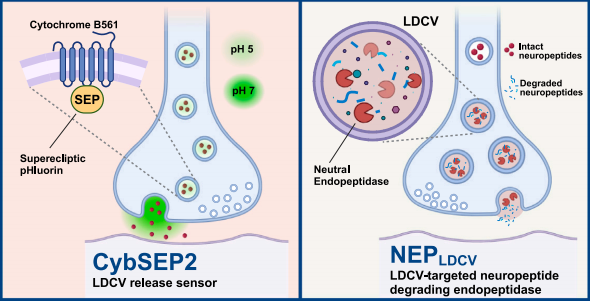
研究人员通过将SEP(Superecliptic pHluorin)锚定到LDCV特异性膜蛋白细胞色素b561 (Cyb561) 的腔侧,构建Cyb561 - SEP融合蛋白(CybSEP)。其中,SEP是GFP的pH敏感版本,它能够根据环境pH值的变化改变其荧光强度和光谱特征,它在pH 5时几乎完全淬灭,而在pH 7时绿色荧光强度提高约50倍。为了确定CybSEP是否响应pH变化而改变荧光,研究人员在PC12细胞中进行了实验,结果表明CybSEP在酸性条件下(pH 5.5)荧光几乎完全丧失,NH4Cl处理后信号恢复,而Cyb561 - GFP融合蛋白(CybGam)的荧光无变化。70mM KCl处理可使CybSEP荧光增强,且荧光变化与电刺激频率相关(10 -100Hz,100Hz时最强),EGTA处理可消除100Hz刺激引起的荧光,TetTox可抑制荧光变化。此外,通过将两个SEPs合并到Cyb561(CybSEP2)中,进一步修改CybSEP,其荧光变化幅度更大,响应电刺激的上升和衰减时间更快。
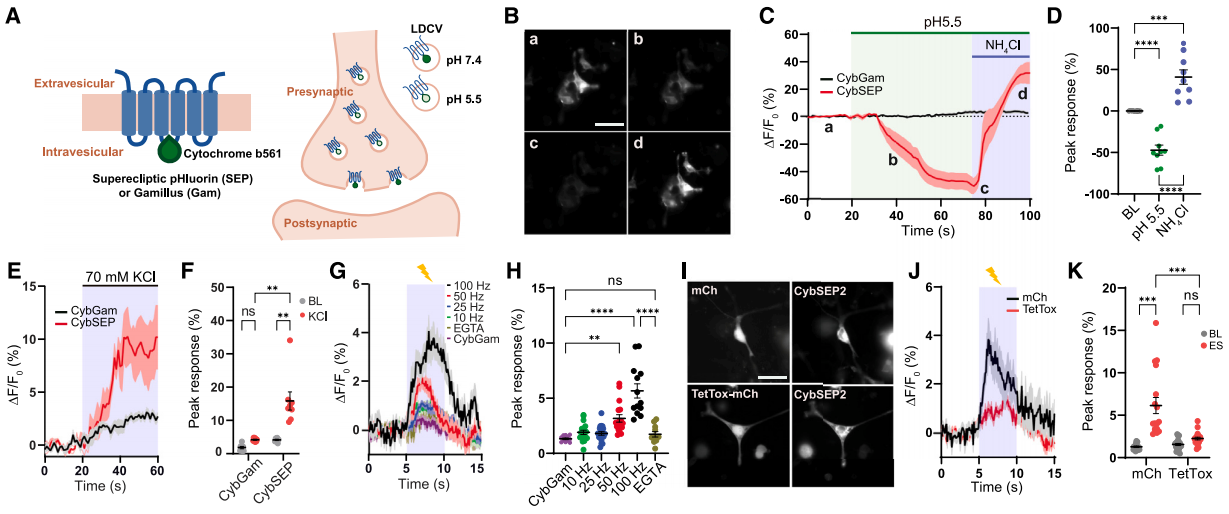
图1 CybSEP作为LDCV传感器的设计和表征
接下来,研究人员通过使用微型单线态氧发生器(miniSOG)观察臂旁核(PBel)中降钙素基因相关肽(CGRP)阳性神经元投射至中央杏仁核(CeAl)的CybSEP定位,miniSOG在光刺激下催化二氨基联苯胺(DAB)聚合可以用于电子显微镜(EM)观察。首先,miniSOG被插入到SEP的C端和Cyb561的第二环之间,并被包装在一个腺相关病毒(AAVDJ-DIO-CybSEP-miniSOG)中,然后将病毒注射到CalcaCre/+小鼠的PBel中,光刺激下EM成像显示在LDCV中有miniSOG标记。
此外,通过在CalcaCre/+小鼠的PBel双侧注射AAVDJ-DIO-CybSEP2或AAVDJ-CybGam,观察PBel内的神经元投射到CeAl的轴突中CybSEP2的表达,电刺激显示CybSEP2荧光变化频率依赖性增加(100Hz时最强),EGTA可消除此反应,且重复刺激信号不衰减。不同脉冲数电刺激可引起CybSEP2荧光增加,TetTox共表达可减弱100Hz电刺激引起的荧光变化。综上所述,这些结果表明CybSEP2可以可靠地检测到急性分离的脑切片中轴突终末LDCV的释放。
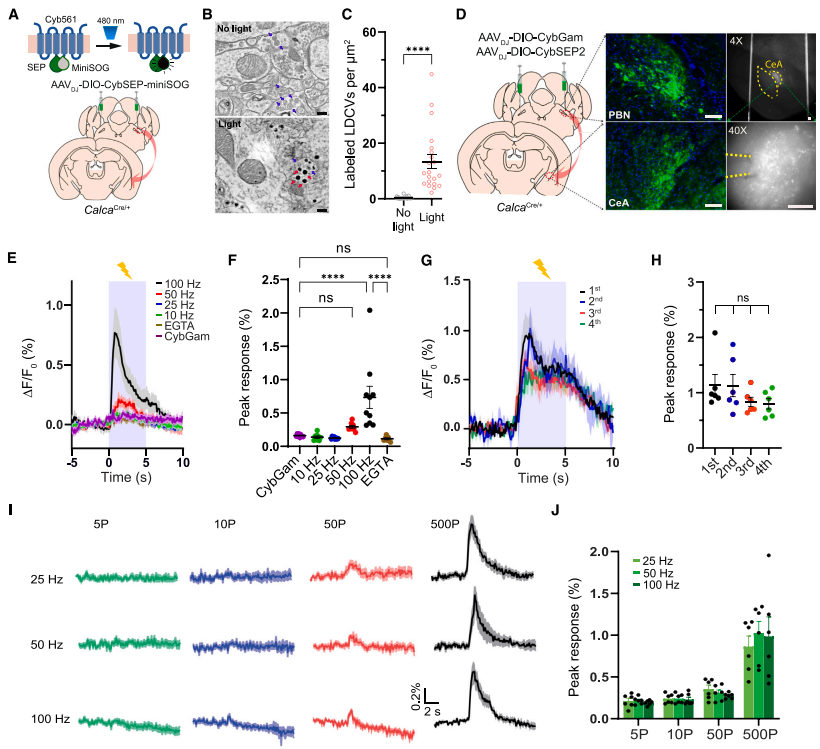
图2 成像脑切片中PBel→CeAl轴突末端神经肽的释放
为了进一步检测在威胁条件反射情况下自由运动小鼠CGRPPBel→CeAl末端神经肽的释放,研究人员将AAVDJ-DIO-CybSEP2或AAVDJ-DIO-CybGam注射到CalcaCre/+小鼠的PBel中,然后在CeAl上植入光纤,借助CMOS光纤测光系统监测神经肽的释放。结果发现不同强度电刺激、52°C热刺激、奎宁刺激均可使CybSEP2表达小鼠CGRPPBel→CeAl末端荧光增加,而CybGam表达小鼠无荧光变化。
此外,研究人员还测试了LDCV循环动力学,通过两次尾捏,间隔2或3分钟,可引起CybSEP2活性的增加,而1分钟内则无反应。最后,为了检测CybSEP2对光遗传刺激的反应,我们将CybSEP2和ChrimsonR-mRuby2-ST表达到CalcaCre/+小鼠的PBel中,并通过CMOS纤维光度法测定清醒小鼠CeAl中CybSEP2的活性。我们观察到CybSEP2荧光在光刺激增加时迅速增加。综上所述,这些结果表明,厌恶感觉刺激可导致CGRPPBel→CeAl末端释放LDCV。
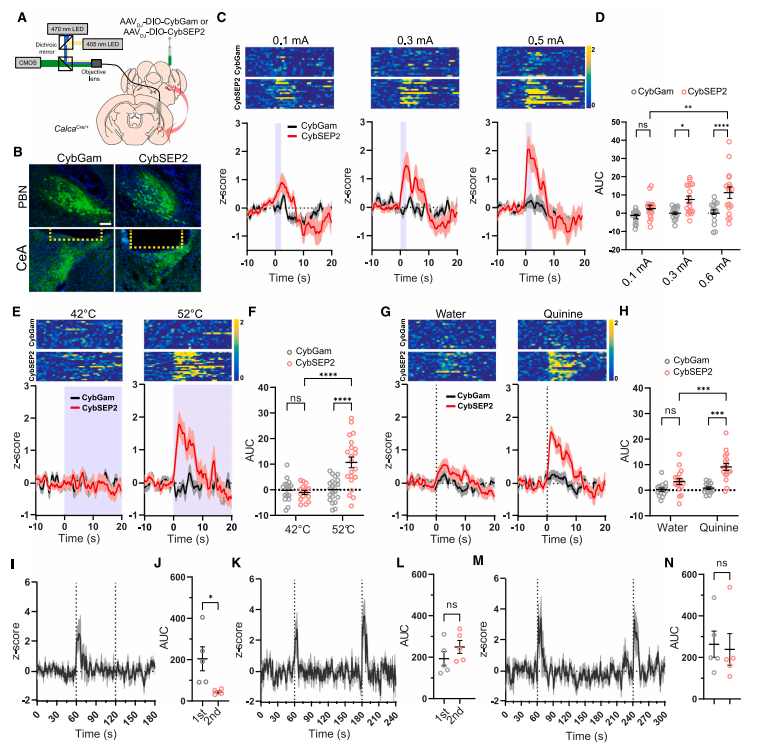
图3 监测行为小鼠突触末梢神经肽的释放
尽管现有的药物阻断和基因敲除等方法为抑制肽能信号传导提供了有价值的手段,但缺乏一种通用的工具,可以特异性地减弱特定细胞类型中的肽能传递。研究人员通过将神经肽特异性肽酶—中性内肽酶 (neutral endopeptidase,NEP)特异性地转运到LDCV的腔内侧,构建了一种LDCV沉默器(NEPLDCV),它通过切断疏水氨基酸链,特异性诱导多种神经肽失活,包括但不限于脑啡肽、缓激肽、降钙素基因相关肽 (CGRP)、P物质、神经紧张素和催产素。通过miniSOG标记验证NEPLDCV在LDCV中的定位,EM成像显示其在胞体和轴突末端的LDCV中密集标记。
研究人员将AAVDJ-DIO-NEPLDCV-P2A-mRuby3或AAVDJ-DIO-mCherry双侧注射到CalcaCre/+的PBel中,结果发现大多数表达mCherry的神经元与CGRP免疫荧光信号共标记,而在表达mRuby的神经元中几乎没有检测到CGRP免疫荧光信号,这表明NEPLDCV有效抑制CGRP的表达。同时,电生理记录显示NEPLDCV对光刺激诱发的兴奋性突触后电流(oEPSCs)无影响,但显著减弱了40Hz刺激诱导的oEPSP,表明NEPLDCV选择性地减弱了神经肽传递,而不改变谷氨酸能传递。
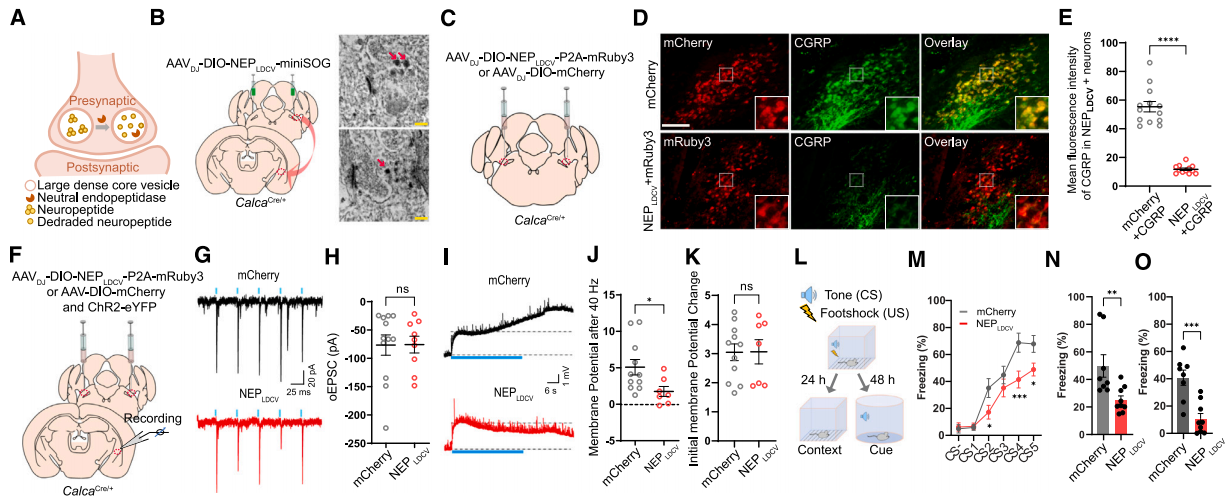
图4 NEPLDCV降低神经肽的释放,减弱威胁学习
在证实了CybSEP2可以用于监测行为小鼠的CGRPPBel→CeAl末端的LDCV神经肽释放后,研究人员进一步将CybSEP2应用于脑啡肽的肽能通路,以测试其多功能性。脑啡肽是一类内源性阿片肽,它们在体内分布广泛,并通过与不同类型的阿片受体结合发挥多样的生物调节作用。他们将AAVDJ-DIO-CybGam或AAVDJ-DIO-CybSEP2注射到PenkCre/+小鼠的CeAl中,并在PBL上插入光纤。在升高平台测试和经典听觉威胁条件测试中,CybSEP2表达组可以观察到显著的荧光强度增加,然而对照CybGam表达组中没有观察到任何荧光变化。
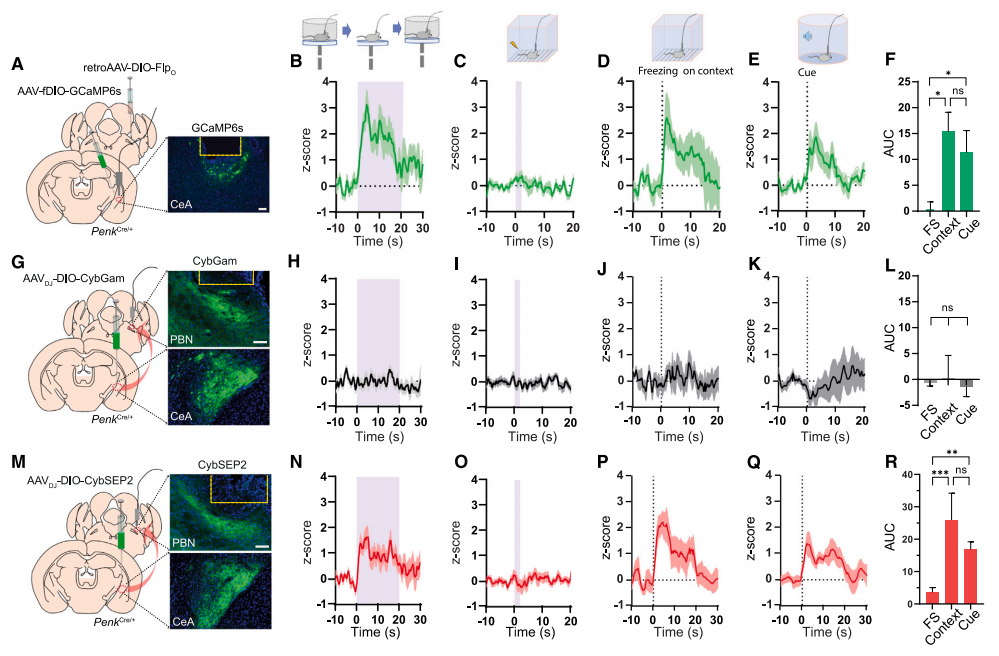
图5 监测行为小鼠中ENKCeA→PBL末端的内源性阿片类物质释放
综上所述,研究人员报告了两种用于研究活体小鼠肽能传递的遗传编码工具:一种是遗传编码的LDCV传感器CybSEP2,用于检测突触前神经肽释放,另一种是遗传编码的LDCV沉默器NEPLDCV,用于特异性降解LDCV内的神经肽。肽能传导的突触前传感器和沉默器工具的开发,为神经科学研究提供了新的视角和方法,有助于深入理解神经肽在大脑中的作用,以及它们在疾病状态下的变化。这些工具的进一步应用可能会揭示更多关于神经肽在大脑功能和疾病中的作用机制,为开发新的治疗策略提供科学依据。
参考文献
Kim DI, Park S, Park S, Ye M, Chen JY, Kang SJ, Jhang J, Hunker AC, Zweifel LS, Caron KM, Vaughan JM, Saghatelian A, Palmiter RD, Han S. Presynaptic sensor and silencer of peptidergic transmission reveal neuropeptides as primary transmitters in pontine fear circuit. Cell. 2024 Sep 5;187(18):5102-5117.e16. doi: 10.1016/j.cell.2024.06.035. Epub 2024 Jul 22. PMID: 39043179; PMCID: PMC11380597.
本文未经授权禁止转载
如有需要,可联系小编获取原文