胰腺是机体重要的内分泌功能器官,参与机体消化、血糖代谢,脂质代谢等。当其发生病变会导致糖尿病、胰腺癌的发生,因此在代谢和肿瘤研究中找到靶向胰腺的病毒载体非常重要。对胰腺进行体内遗传工程,特别是对β细胞的基因转移,可能有助于我们研究和剖析关键基因在糖尿病发病和发展过程中胰岛的生理病理学作用。已有研究发现AAV载体对胰腺的转导效率比腺病毒和慢病毒载体更优。单链AAV载体的8型和9型(AAV8和AAV9)在系统性给药、胰腺内、导管内或通过胰腺内血管给药时,对胰腺的外分泌和内分泌部分都有较强的转导效率。

目前常使用AAV8、Y447F+Y733F-AAV8感染胰腺。
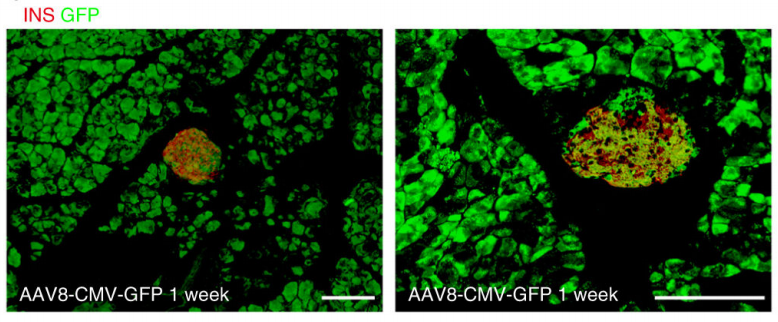
图1 不同血清型在腓肠肌中载体表达情况
当将Sox9(导管细胞特异性)启动子介导Cre重组酶表达的AAV注入R26RTomato报告小鼠时,导管细胞可以被特异性和有效地标记。注射RIP(胰岛素启动子)介导重组SMAD7表达的AAV时,会发现SMAD7在胰腺细胞中特异性过表达。注射CMV(巨细胞病毒启动子)介导GFP表达的AAV时,会发现GFP在整个胰腺中表达。

目前AAV感染胰腺的方式目前有两种,一种是通过胆管将病毒注射入胰腺,另一种是腹腔注射感染胰腺。其中通过胆管感染需要用微夹钳夹住胆胰管的近肝端和近十二指肠端,然后用泵将病毒注入胆管感染胰腺;而腹腔注射的方法更为便捷,但组织特异性较弱。
实例1:比较AAV6、AAV8和AAV9通过胰腺导管注射转导胰腺内分泌部的效率【1】
血清型:AAV6、AAV8和AAV9
启动子:CAG
实验动物:小鼠
注射方案:胰腺导管注射,3×10^10-3×10^12 vg/只,表达4周
实验结果:与AAV9相比,AAV6和AAV8在所有测试剂量(3E10/3E11/3E12)下都转导了更多的胰腺细胞,在注射3.0×10^12 vg/只的剂量下,实现了胰腺内所有胰岛的转导。
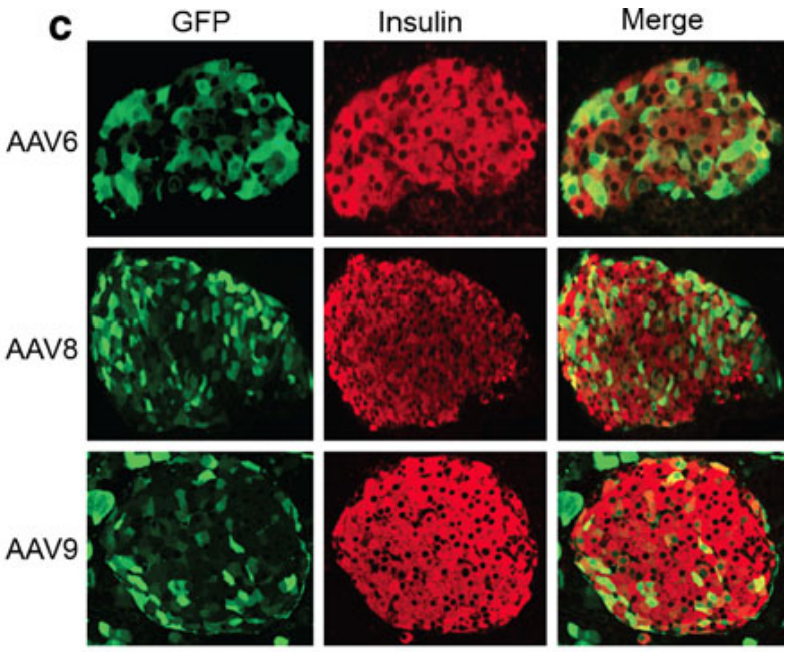
图2 通过胰腺导管注射AAV转导胰腺细胞
实例2:AAV8介导的白细胞介素-4基因在β细胞表达【2】
血清型:AAV2/8
启动子:mIP
实验动物:NOD小鼠
注射方案:腹腔注射,4.0×10^12 vg/只,表达2周
实验结果:小鼠胰岛素启动子(mIP)在dsAAV载体中显示是β细胞特异性,可以有效的让AAV介导绿色荧光蛋白(eGFP)在胰腺β细胞中特异性表达。在年轻雌性NOD小鼠中,dsAAV8-mIP-eGFP对胰腺β细胞的感染效率以及介导eGFP的表达效率,与正常BALB/C小鼠一样,并且能实现β细胞中特异性表达。
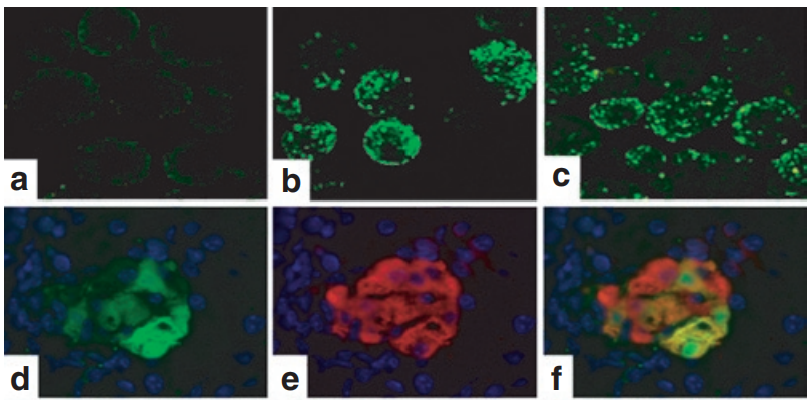
图3 胰岛中增强绿色荧光蛋白(eGFP)的表达
实例3:衣壳优化的AAV8载体在胰腺中表达效率更高【3】
血清型:AAV2/8
启动子:CBA
实验动物:小鼠
注射方案:腹腔注射,1.0×10^11-3.0×10^11 vg/只,表达2周
实验结果:与静脉注射相比,腹腔注射AAV8可显著提高胰腺的转导效率。与之前发表的AAV8载体剂量(3.0×10^11-5.0×x10^11 vg/只)相比,Y447F+Y733FAAV8载体(AAV2/8 pan-CBA-mCherry)的注射剂量低3倍(1.0×10^11vg/只)但是对胰腺的转导效率反而更高。
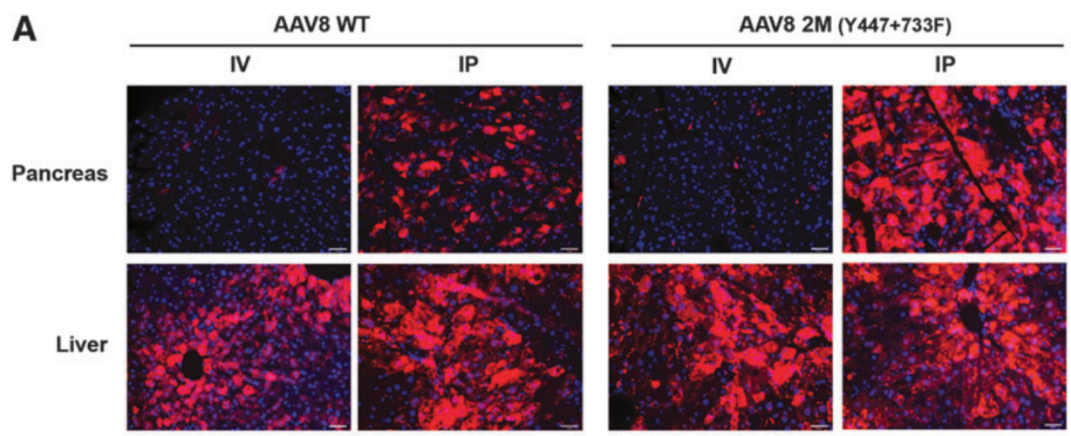
图4 腹腔注射Y447F+Y733F-AAV8比尾静脉注射有更高的转导效率和基因表达
实例4:AAV介导的Igf1胰腺过表达抑制了小鼠自身免疫性糖尿病的进展【4】
血清型:AAV2/8
启动子:mIP
实验动物:小鼠
注射方案:胰腺导管注射,滴度1.0×10^13 vg/ml,表达2周
实验结果:为了分析mPGES-2对β细胞功能和糖代谢的特异性影响,通过小鼠胰腺导管内注射AAV8-MIP-mPGES-2-GFP的方法实现了在β细胞中特异性过表达mPGES-2,结果表明,mPGES-2在调节糖代谢和β细胞衰老中发挥着重要作用。
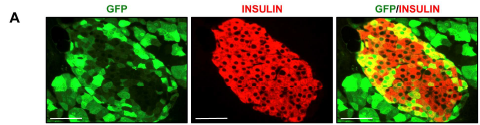
图5 胰腺内分泌部和外分泌部中病毒感染分布
布林凯斯可提供各类病毒包装定制化服务
请联系小布18971216876(微信同号)
或咨询当地销售经理获取更多信息
本文未经授权禁止转载
如有需要,可联系小编获取原文
参考文献
1、Jimenez V, Ayuso E, Mallol C, et al. In vivo genetic engineering of murine pancreatic beta cells mediated by single-stranded adeno-associated viral vectors of serotypes 6, 8 and 9. Diabetologia. 2011;54(5):1075-1086.
2、Rehman KK, Trucco M, Wang Z, Xiao X, Robbins PD. AAV8-mediated gene transfer of interleukin-4 to endogenous beta-cells prevents the onset of diabetes in NOD mice. Mol Ther. 2008;16(8):1409-1416.
3、Chen M, Maeng K, Nawab A, et al. Efficient Gene Delivery and Expression in Pancreas and Pancreatic Tumors by Capsid-Optimized AAV8 Vectors. Hum Gene Ther Methods. 2017;28(1):49-59.
4、Zhong D, Wan Z, Cai J, et al. mPGES-2 blockade antagonizes β-cell senescence to ameliorate diabetes by acting on NR4A1. Nat Metab. 2022;4(2):269-283.