腺相关病毒(AAV)是一种结构简单、安全性高的单链DNA病毒,广泛应用于基因治疗和基因功能研究。AAV的感染周期包括以下步骤:附着在细胞膜上、受体介导的内吞作用、内体运输、逃离晚期内体或溶酶体、进入细胞核、脱衣壳、基因组复制、Rep基因的表达、Cap基因的表达、后代ssDNA颗粒的合成、完整病毒体的组装,以及从受感染细胞中释放。
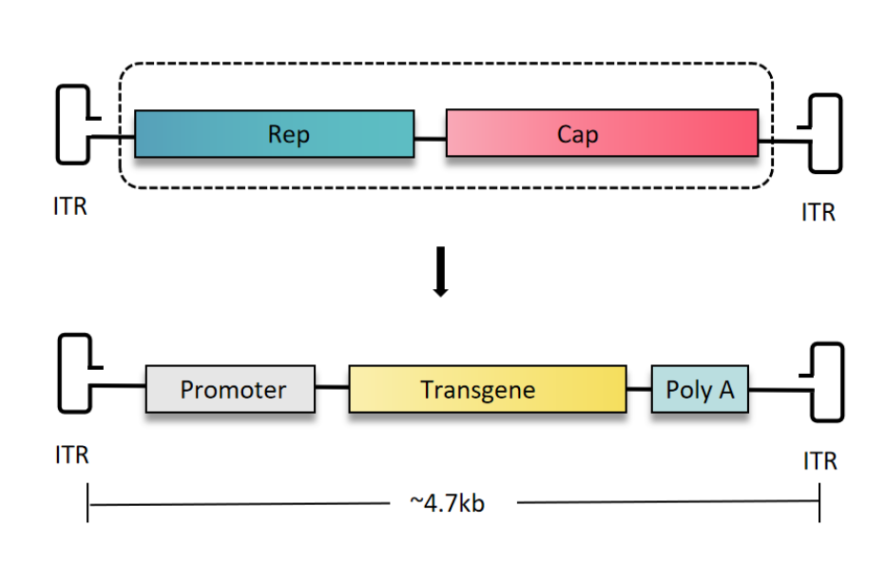
重组腺相关病毒(rAAV)是AAV的一种形式,去除了大部分病毒基因组,仅保留ITR和必要的Rep和Cap基因,使其成为一种安全的基因转移载体。通过不同的策略,如原位注射、组织特异性血清型、特异性启动子和Cre-loxp系统,可以实现AAV在特定组织或细胞中的特异性表达。
AAV在人体和其他灵长类动物中高度普遍存在,并且从各种组织样本中分离出了几种血清型。在人类细胞中发现了血清型2、3、5和6,而在非人灵长类动物样本中发现了AAV血清型1、4和7–11,其中对AAV2的研究最多。
不同血清型的区别在于由Cap基因编码的衣壳蛋白(主要是VP1、VP2和VP3)的氨基酸序列和空间结构的差异(即抗原性差异),这些结构特点影响AAV与宿主细胞表面受体的相互作用,进而使得不同血清型对特定组织或细胞具有不同的嗜性。
为提升AAV在临床与研究中作为载体的效率,研究人员研发了许多AAV的人工变型,以提升基因表达、适应不同的目标组织并使其更易逃避免疫系统的攻击。目前几乎所有重组AAV(rAAV)病毒载体的核心骨架都是来源于AAV2亚型,所以完整的AAV血清型如rAAV9可表示为rAAV2/9,表示具有AAV2的ITR和AAV9的衣壳。
启动子(promoter)是DNA分子上一个特殊区域,位于基因的上游,是RNA聚合酶识别并结合的位点,从而启动转录过程。某些启动子具有组织特异性或细胞类型特异性,这意味着它们只在特定的组织或细胞类型中被激活。这使得基因表达可以在特定的环境中进行调控。以下是一些常用的启动子类型及其应用:
广谱型启动子:如巨细胞病毒启动子(CMV)、CMV增强子融合的鸡β-肌动蛋白启动子(CAG)等,它们可以实现目的基因的高水平表达。
组织特异性启动子:这些启动子可以在特定组织或器官中实现基因的特异性表达。例如,TBG和Alb启动子是常用于特异性靶向肝细胞的启动子;GfaABC1D启动子用于靶向星形胶质细胞的研究。
诱导型启动子:如四环素启动子TRE,它可在特定条件下启动基因的表达,为基因表达提供可控性。

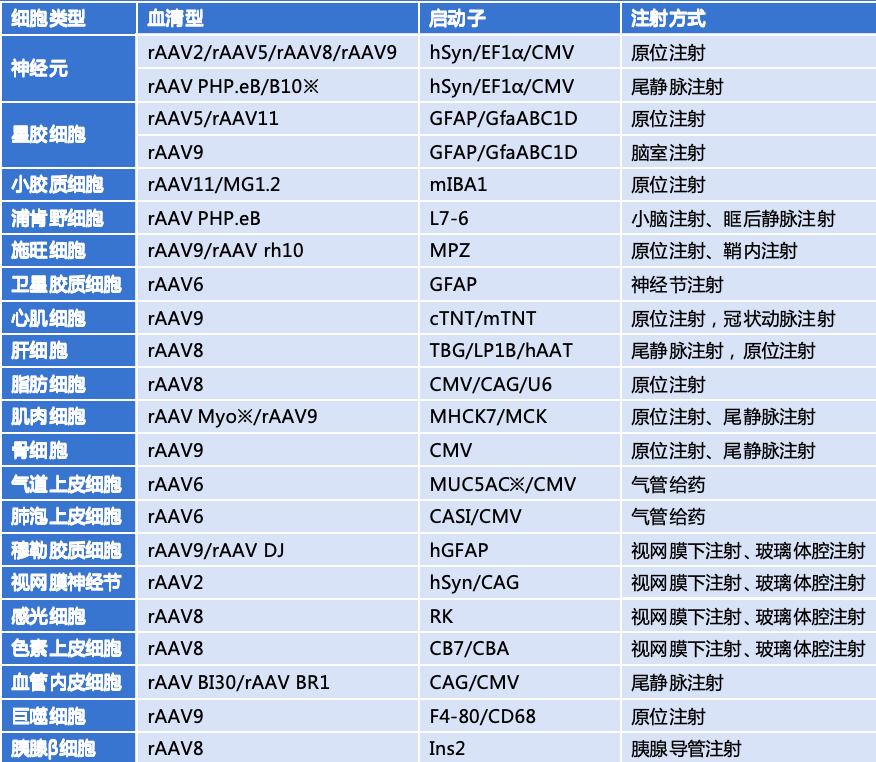
在选择启动子时,研究者需要根据自己的实验目的和所需的基因表达模式来决定使用哪种类型的启动子。例如,如果需要在特定细胞类型中进行基因表达,则可以选择相应的细胞类型特异性启动子;如果需要在多个组织中实现广泛表达,则可以选择广谱型启动子。此外,还需要考虑rAAV的血清型与启动子的组合,以实现最佳的感染效率和靶向特异性 。
利用rAAV特异性感染组织细胞,首先需要确定启动子和血清型类型,那么如何选择最佳的启动子和血清型呢?可以从已发表达文章着手,快来跟着小布一起学习文章中常用固定搭配吧!
以下是小布总结的一些常用启动子和血清型组合:
案例一
2024年3月27日,阿比盖尔·韦克斯纳研究所研究人员在Molecular Therapy期刊上发表题为“Evaluation of safety and early efficacy of AAV gene therapy in mouse models of vanishing white matter disease”的研究,描述了两种伴白质消失的白质脑病 (VWM) 小鼠模型,并研究星形胶质细胞靶向腺相关病毒血清型 9 (AAV9) 介导的基因补充疗法作为 VWM 的治疗选择,研究者设计了三种不同的AAV9载体,这些载体包含不同的启动子(GFAP、gfaABC(1)D和CAG),用于驱动目的基因的表达,这些载体被注射到新生小鼠的脑室中。结果表明,对体重、运动功能、步态正常化、寿命延长有显著的拯救作用,最后,有证据表明基因补充可减轻脱髓鞘作用。最后,使用AAV9-gfaABC(1)D 的载体获得了最大的拯救结果,从而支持星形细胞靶向对于疾病治疗至关重要。
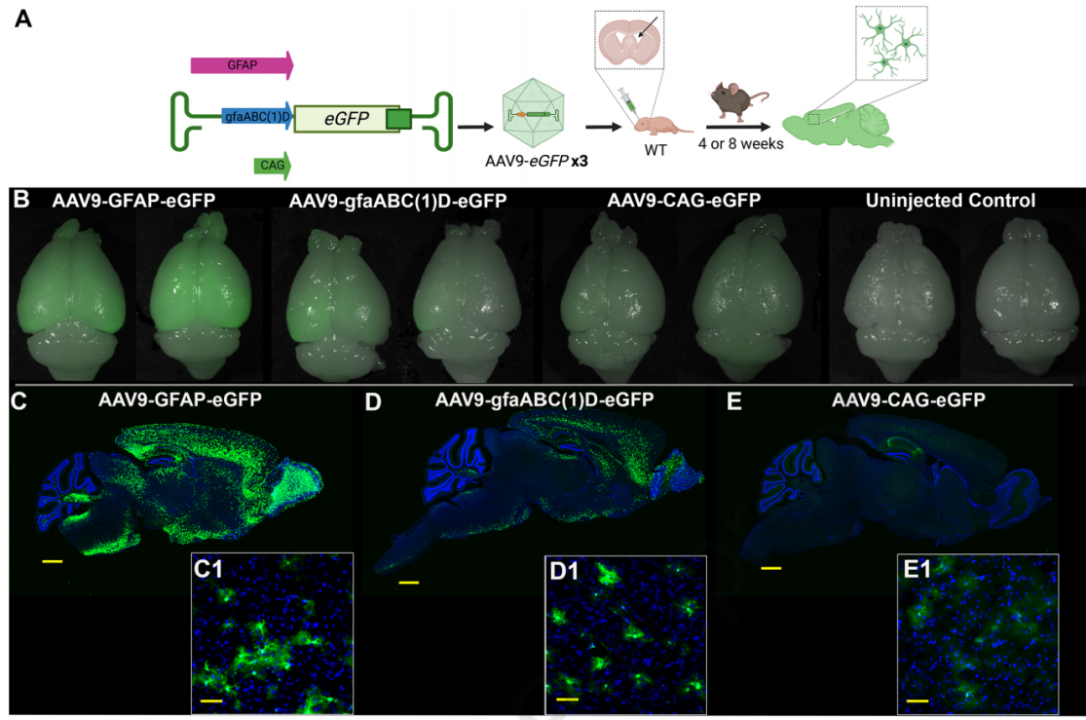
图1 AAV9介导的基因传递后小鼠组织中eGFP表达的比较
案例二
2021年9月,美国布罗德研究所团队与哈佛大学团队合作在Cell上发表了“Directed evolution of a family of AAV capsid variants enabling potent muscle-directed gene delivery across species”一文,研究人员建立了一种体内策略来进化和严格选择AAV的衣壳变体,这些变体能够有效地递送到所需的组织。使用这种方法,研究人员确定了一类含有RGD基序的衣壳,在小鼠和灵长类动物体内定向进化出一种工程化改造的AAV载体—MyoAAV,在小鼠和非人类灵长类动物静脉注射后,能够高效靶向肌肉组织,递送到肌肉组织的效率是传统病毒载体的10倍以上。同时,与传统递送载体相比,该载体在遗传性肌肉疾病中的治疗剂量降低大约100到250倍,这一研究成果极大地减少了肝脏损伤和其他严重副作用的风险。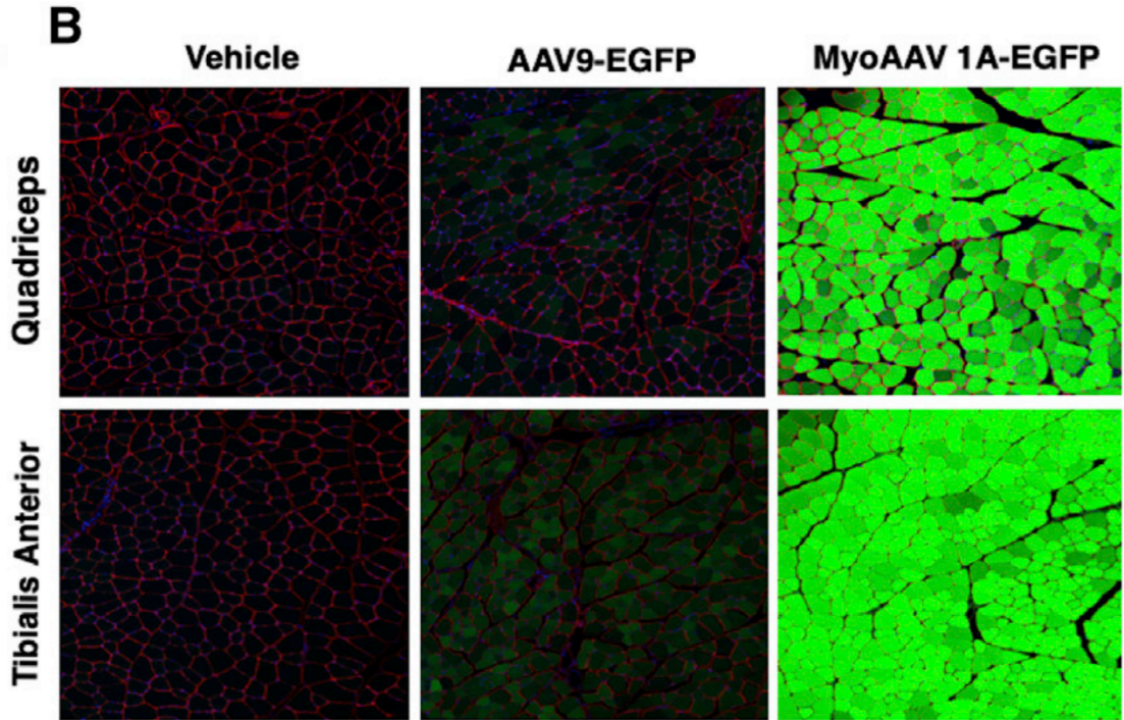
图2 MyoAAV在全身注射后能高效地转导小鼠骨骼肌
1、Aschauer, Dominik F et al. “Analysis of transduction efficiency, tropism and axonal transport of AAV serotypes 1, 2, 5, 6, 8 and 9 in the mouse brain.” PloS one vol. 8,9 e76310.
2、Chan, Ken Y et al. “Engineered AAVs for efficient noninvasive gene delivery to the central and peripheral nervous systems.” Nature neuroscience vol. 20,8 (2017): 1172-1179.
3、Goertsen, David et al. “AAV capsid variants with brain-wide transgene expression and decreased liver targeting after intravenous delivery in mouse and marmoset.” Nature neuroscience vol. 25,1 (2022): 106-115.
4、Griffin, Jarred M et al. “Astrocyte-selective AAV gene therapy through the endogenous GFAP promoter results in robust transduction in the rat spinal cord following injury.” Gene therapy vol. 26,5 (2019): 198-210.
5、Herstine, Jessica A et al. “Evaluation of safety and early efficacy of AAV gene therapy in mouse models of vanishing white matter disease.” Molecular therapy : the journal of the American Society of Gene Therapy vol. 32,6 (2024): 1701-1720.
6、Nengsong Luo et al. Microglia-specific transduction via AAV11 armed with IBA1 promoter and miRNA-9 targeting sequences.doi: https://doi.org/10.1101/2024.07.09.602653.
7、Nitta, Keisuke et al. “Minimal Purkinje Cell-Specific PCP2/L7 Promoter Virally Available for Rodents and Non-human Primates.” Molecular therapy. Methods & clinical development vol. 6 159-170.
8、Kagiava, A et al. “Efficacy of AAV serotypes to target Schwann cells after intrathecal and intravenous delivery.” Scientific reports vol. 11,1 23358.
9、Xiang, Hongfei et al. “Glial fibrillary acidic protein promoter determines transgene expression in satellite glial cells following intraganglionic adeno-associated virus delivery in adult rats.” Journal of neuroscience research vol. 96,3 (2018): 436-448.
10、Lin, Zhiqiang et al. “Pi3kcb links Hippo-YAP and PI3K-AKT signaling pathways to promote cardiomyocyte proliferation and survival.” Circulation research vol. 116,1 (2015): 35-45.
11、Ran, F Ann et al. “In vivo genome editing using Staphylococcus aureus Cas9.” Nature vol. 520,7546 (2015): 186-91.
12、Agudelo, Daniel et al. “Versatile and robust genome editing with Streptococcus thermophilus CRISPR1-Cas9.” Genome research vol. 30,1 (2020): 107-117.
13、Tabebordbar, Mohammadsharif et al. “Directed evolution of a family of AAV capsid variants enabling potent muscle-directed gene delivery across species.” Cell vol. 184,19 (2021): 4919-4938.e22.
14、Yang, Yeon-Suk et al. “Bone-targeting AAV-mediated silencing of Schnurri-3 prevents bone loss in osteoporosis.” Nature communications vol. 10,1 2958.
15、Chen, Honglin et al. “Population-wide gene disruption in the murine lung epithelium via AAV-mediated delivery of CRISPR-Cas9 components.” Molecular therapy. Methods & clinical development vol. 27 431-449.
16、örbelin, Jakob et al. “A brain microvasculature endothelial cell-specific viral vector with the potential to treat neurovascular and neurological diseases.” EMBO molecular medicine vol. 8,6 609-25.
17、Krolak, Trevor et al. “A High-Efficiency AAV for Endothelial Cell Transduction Throughout the Central Nervous System.” Nature cardiovascular research vol. 1,4 (2022): 389-400.
18、Dor, Yuval et al. “Adult pancreatic beta-cells are formed by self-duplication rather than stem-cell differentiation.” Nature vol. 429,6987 (2004): 41-6.