尽管光遗传学工具允许以较高的时间和空间精度操控神经元放电,但投射神经元通常通过分支影响多个下游区域,因此直接操控神经元胞体可能会对神经环路功能产生一些误导。相反,直接靶向远程连接的突触终端可以更精确地揭示神经元对特定环路的作用。氯离子传导通道视紫红质已被证明不适合作为突触沉默工具,因为它们会使轴突去极化并可能引发反向放电。相比之下,双稳态视紫红质通过靶向抑制性G蛋白偶联受体(GPCR)通路,在非激活状态(暗态)和激活状态(光态)之间转换,可以有效地以投射特异性的方式减弱突触释放。这些光激活的GPCR(称为optoGPCRs),类似于内源性抑制性GPCR,会触发G蛋白偶联内向整流钾通道的开启,并激活Gαi/o信号通路,从而有效抑制突触传递。
2024年5月29日,魏茨曼科学研究所脑科学和分子神经科学研究人员在Nature Methods上发表了一篇名为“A bistable inhibitory optoGPCR for multiplexed optogenetic control of neural circuits”的研究论文,系统地评估了多种双稳态视蛋白在光遗传应用中的潜力,并发现杜氏多毛虫Platynereis dumerilii的纤毛视蛋白(PdCO)在哺乳动物神经元中表达良好,在各种细胞类型和离体组织中实现强大、高效和快速可切换的突触前沉默。PdCO具有红移激活波长和较窄的失活光谱,非常适合与其他光遗传学执行器和报告基因进行多光谱复用。与AsOPN3和LcPPO相比,PdCO对突触抑制效果更明显,激发光谱红移,失活光谱更窄。

研究人员进行了全面的文献检索,以识别可能用于光控制抑制突触传递的optoGPCR候选物。根据相关实验结果,选择了表现最佳的变体,并测试了它们抑制突触传递的能力。例如,PdCO和AsOPN3在光刺激下显示出最强的突触传递抑制效果,但是AsOPN3的活性不能迅速恢复到非激活活性(暗态)状态,需要几分钟才能自发地恢复到其非激活状态。对于表现有前景的optoGPCR,如PdCO,研究人员进一步详细描述了其生物物理特性,包括光激活的光谱特性和光敏感性。PdCO因其红移的激活波长和狭窄的失活光谱,适合与其他光遗传学执行器和报告基因进行多光谱复用。
研究人员使用重组腺相关病毒血清型2/1(rAAV2/1)转导在自突触神经元(一种特殊的神经元,它们形成了自我连接的神经回路)中表达所选的optoGPCRs。在不同的光照条件下测量连续脉冲诱导的兴奋性突触后电流(EPSCs)。为了校正自发EPSC随时间的衰减,研究人员对非表达对照组应用了相同的协议。比较了不同optoGPCRs在光激活后对突触传递的影响,发现某些optoGPCRs(如PdCO和AsOPN3)能够显著减少动作电位(AP)诱发的EPSCs。PdCO和AsOPN3显示出最强的EPSC减少效果,而其他一些工具(如OlTMT1A和LcPPO)的抑制效果相对较弱。研究人员还测试了光遗传工具的可逆性,即通过不同波长的光来恢复突触传递。例如,PdCO和LcPPO可以通过绿光脉冲恢复突触传递。

图1 在自突触神经元中对optoGPCRs的基准测试
研究人员详细描述了PdCO在突触抑制方面的生物物理特性,并将其与LcPPO(来自日本七鳃鳗Lethenteron camtschaticum的视蛋白)和AsOPN3(来自斯氏按蚊Anopheles stephensi的视蛋白)进行了比较。通过改变激活光脉冲的波长,研究人员生成了视蛋白激活的行为光谱,并量化了在光照后35秒内平均EPSC抑制的程度。与LcPPO相比,PdCO需要的半最大EPSC抑制波长红移了40 nm,这表明PdCO在更长的波长下也能有效地被激活。PdCO在特定波长范围内对突触传递的抑制效果比LcPPO更有效。研究人员测试了不同持续时间的蓝光(470 nm)光脉冲对PdCO的影响,发现PdCO在蓝光(470 nm)下的激活表现出短暂的抑制作用,在时间常数为3.4±0.6 s时恢复。事实上,连续470 nm照明(2.83 mW/ mm2)持续60秒,使EPSCs减少了85%±1%;在停止光后自发恢复,时间常数为2.7±0.3 s。研究人员还详细描述了LcPPO、AsOPN3和PdCO的G蛋白信号特性,结果显示PdCO是一个有前途的光遗传学工具,可以用于精确控制神经回路的活动。
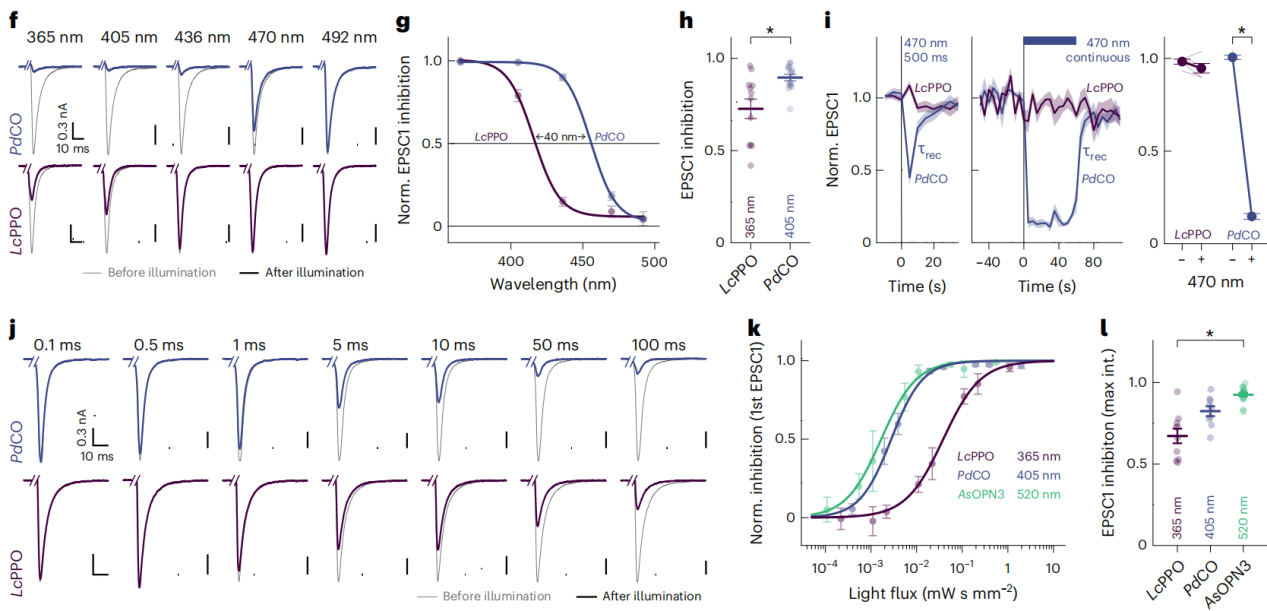
图2 optoGPCR性能与生物物理特性的比较
使用器官型海马切片培养来研究PdCO与其他光遗传工具(如LcPPO)在突触前抑制方面的效能。首先确认了PdCO和LcPPO在器官型海马切片中的生物物理特性,结果与之前在自突触神经元中的实验相似。通过单细胞电穿孔技术使CA3锥体神经元表达PdCO或LcPPO,并记录不同波长和持续时间的光脉冲诱导的GIRK介导电流。发现PdCO在405至435 nm波长范围内的GIRK电流响应最大,且即使在更低的光强度下,PdCO诱导的GIRK电流也比LcPPO强。作者研究了在两种optoGPCRs的最佳激活波长下,光脉冲持续时间对GIRK电流的影响,发现PdCO在50至100毫秒的光脉冲下响应最大。通过将PdCO或LcPPO与BiPOLES共表达,选择性地在轴突末梢激活optoGPCRs,以比较它们抑制突触传递的能力,发现PdCO在较低的光强度下就能实现更强的突触抑制。通过电刺激表达PdCO的Schaffer侧支,并在CA1神经元中记录EPSCs,来测量PdCO介导的突触释放抑制的稳定性,发现PdCO介导的抑制在25分钟的时间内没有自发恢复,且用525 nm光能恢复突触传递,再使用405 nm光可再次阻断突触传递。
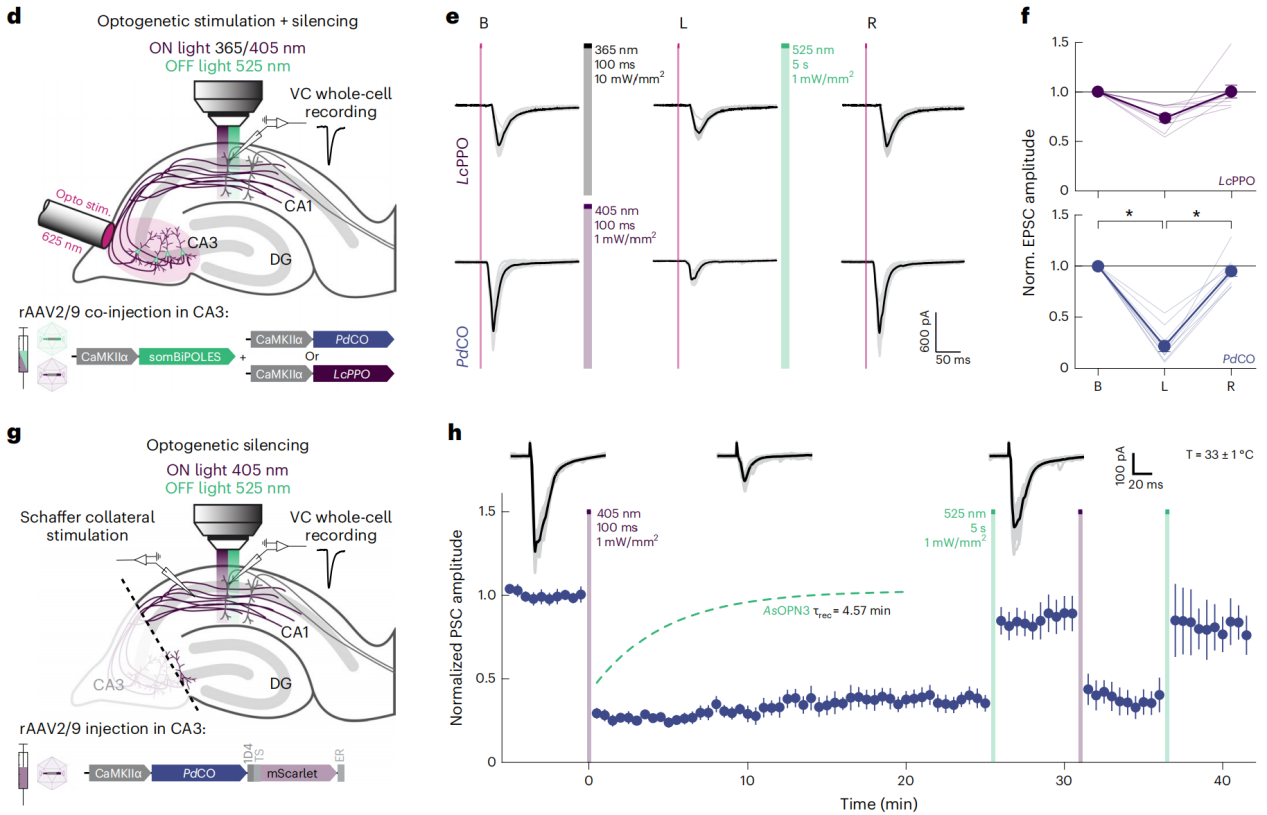
图3 optoGPCR在器官型海马切片培养中的特性和表现
光谱复用是一种技术,它允许在同一实验中使用多个光遗传工具,每个工具对不同波长的光响应,从而减少光谱交叉干扰。LcPPO失活光谱较宽,在436-560 nm之间;PdCO失活光谱较窄,在470-520 nm之间;PdCO的红移激活波长和较窄的失活光谱使其适合与红移的传感器或执行器进行光谱复用。通过在同一神经元中共表达PdCO和FR-GECO1c,能够在使用蓝光(445-470 nm)激活PdCO抑制突触传递的同时,使用红光激发FR-GECO1c来监测钙活动。研究人员分析了通过精确控制不同波长的光,展示了如何独立控制PdCO的激活和FR-GECO1c的荧光变化,这证明了PdCO在光谱复用实验中的潜力。通过结合使用PdCO和其他光遗传工具(靶向胞体的红光敏感通道蛋白ChrimsonR),研究人员能够在不同的波长下精确地控制和监测神经活动,这种方法大大提升了多重光遗传工具在同一实验中的应用能力。
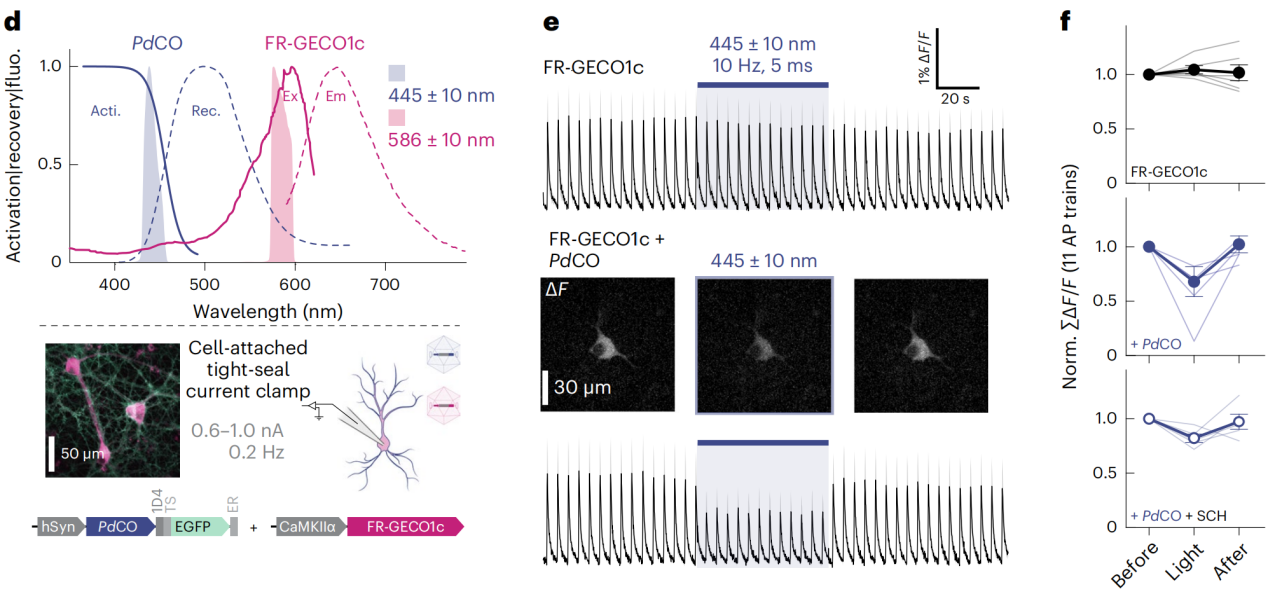
图4 PdCO的恢复性能和与FR-GECO1c的多路复用
研究人员探讨了PdCO在活体动物中调控特定神经通路的能力,特别是多巴胺能神经元从黑质到背内侧纹状体的投射,这些通路在动物的运动行为中起着重要作用。通过在特定脑区表达PdCO并使用光刺激,研究人员能够可逆地抑制这些神经通路的活动,并观察到动物行为的变化。研究人员设计了一系列实验来测试PdCO在活体内的效果,包括在小鼠中进行的光遗传抑制实验,以及使用不同的光刺激频率和持续时间,通过观察光刺激前后动物的行为变化,评估了PdCO在调控动物运动行为中的有效性。此外,研究人员探讨了PdCO的特异性和PdCO介导的光遗传抑制的长期效应,包括在停止光刺激后行为恢复的情况。研究特别关注了PdCO在调控多巴胺和去甲肾上腺素系统时的应用,这些系统与奖赏、动机和注意力等多种行为功能相关,展示了这种光遗传工具的多功能性,能够用于研究和调控多种不同类型的神经活动。
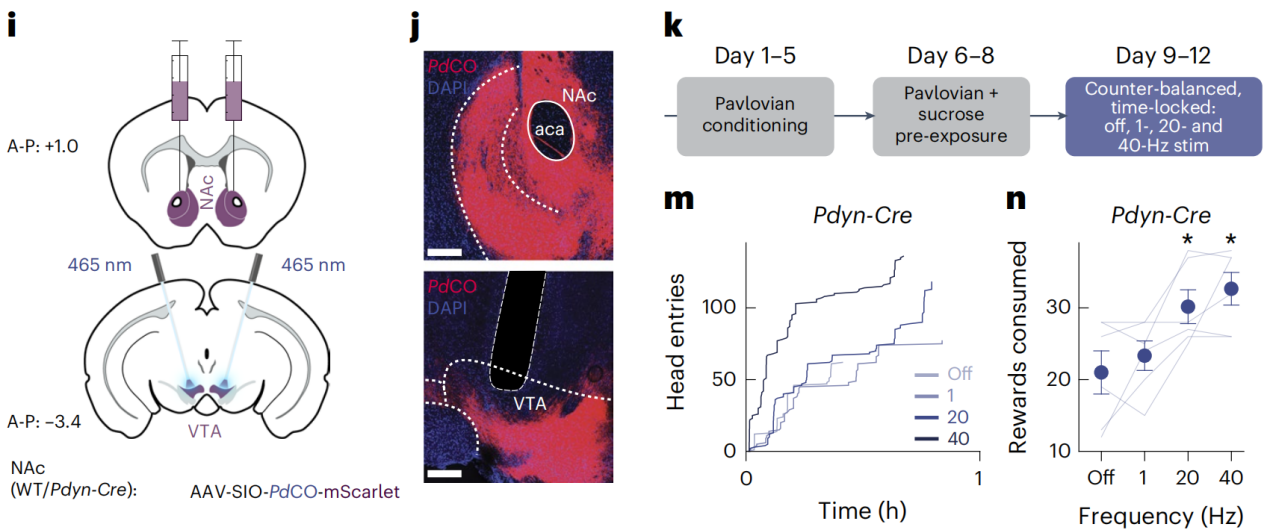
图5 PdCO在体内的应用
总体来说,PdCO作为一种新型的抑制性光遗传工具,具有高效、双稳态、红移激活波长、狭窄的失活光谱、快速和可逆的抑制以及光谱多路复用等多种优势。这些特性使得PdCO在神经科学研究中具有广阔的应用前景,特别是在需要精确控制和多光谱兼容性的复杂神经回路研究中。