小布解读 | 一文带你了解稳转细胞系的构建
发布时间:2024-11-08 16:55:48
导言:在生物医学研究与药物开发中,细胞模型作为不可或缺的基础工具,扮演着至关重要的角色。其中,稳转细胞系——特指那些能够长期稳定表达外源基因的细胞模型,凭借其卓越的基因或蛋白质持续表达能力,已成为科研探索中不可或缺的重要资源。构建稳转细胞系是生物技术领域中的一项重要技术,它在药物开发、基因功能研究以及疾病模型构建等方面发挥着重要作用。接下来跟小布一起学习构建稳转细胞系的原理、方法及其在理论研究中的应用吧!
稳转细胞系的构建基于基因工程和分子生物学两个学科的技术手段,通过将外源DNA克隆到具有某种抗性的载体上,载体被转染到宿主细胞并整合到宿主染色体中,用载体中所含的抗性标志进行筛选混合阳性克隆(针对转染效率较高的细胞株),最终使得外源DNA能够在细胞分裂过程中被稳定地遗传和表达。
1.目的基因的选择与克隆:根据研究目的,选择合适的基因序列,并将其克隆到具有某种抗性的表达载体中,最常用的表达载体抗性筛选标志物有新霉素(Neomycin)、杀稻瘟菌素(Blasticidin)、嘌呤霉素(Puromycin)、遗传霉素G418(Geneticin)。
2.载体设计:设计能够整合到宿主细胞基因组中的表达载体,通常包含启动子、增强子、选择标记等元件。
3.转染:利用物理或化学方法将表达载体导入宿主细胞,使其具有表达外源基因的能力。
4.筛选与鉴定:通过抗生素筛选或其他筛选标记,初步筛选成功整合外源基因的阳性细胞,并进行RNA及蛋白水平的鉴定,进一步确认稳转细胞系的成功构建与功能表达。
1.质粒介导的细胞转染
瞬时转染是指携带外源DNA的质粒或其他载体在细胞内以非整合状态存在,只在一段时间内表达其携带的基因,常通过短暂的基因表达进行基因功能研究,普通载体骨架的质粒如pcDNA3.1、pUC57即可满足需求;而稳定转染则需将外源基因整合到宿主细胞的基因组中,以实现长期稳定的基因表达。稳转细胞系需借助基因编辑技术进行构建,主要包括以下2种技术:
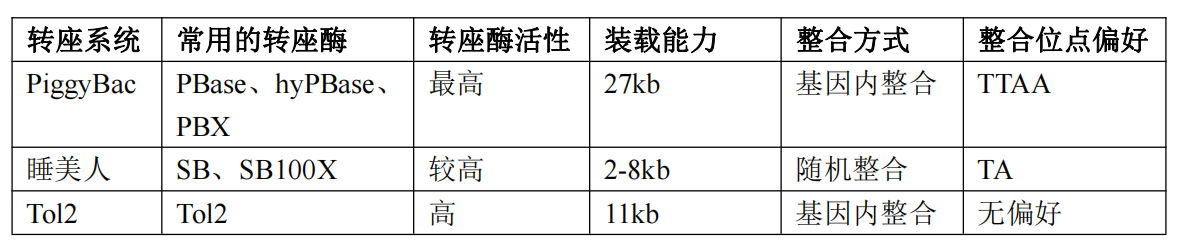
DNA转座子技术:在自然界中,DNA转座子系统包含转座酶,该酶负责识别并催化转座子在基因组中的移动,其编码序列两端具有末端反向重复序列(TRs)。转座酶可在TRs位点和基因组位点引入双链断裂,从而使整个转座子区域发生转位。对于基因编辑应用,可以将转座酶组分进行分离,一个辅助质粒:编码转座酶;一个转座子质粒:含优化的两端TRs,中间是被转座区域,可插入我们想转座到宿主基因组中的目的基因序列。常用的转座系统包括:PiggyBac、睡美人(Sleeping Beauty)和Tol2,其特点见下表。
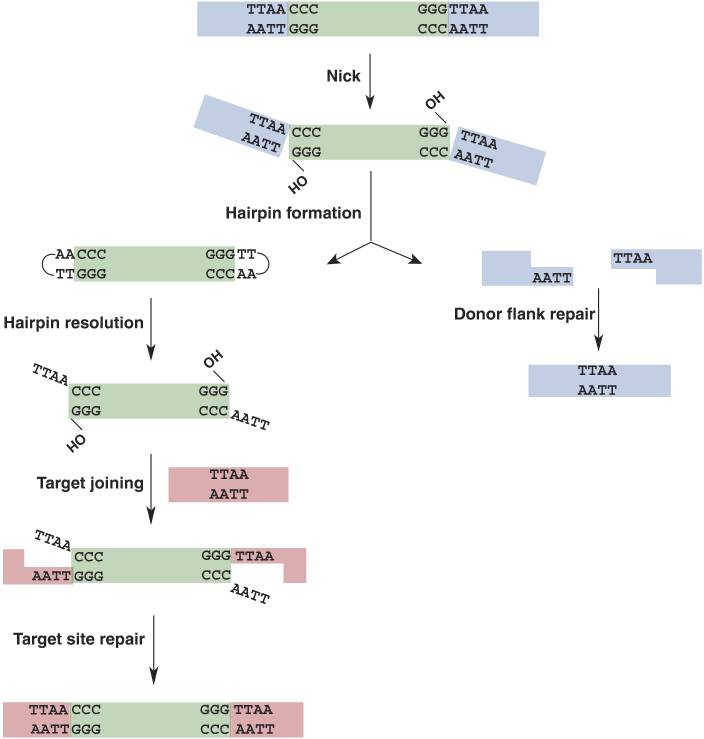
其中,PiggyBac是最受欢迎的转座子系统之一,可用于递送转基因、shRNA、重组抗体等。PiggyBac转座子在发现后经过了一系列优化和改造,优化后的转座酶(hyPBase)使转座效率进一步提高,具有剪切活性但是整合活性缺失,确保在移除整合的序列后,该位置不会再次被转座子重新插入,实现无痕剪切。此外,PiggyBac转座子的一个显著优势在于其大装载量,可以在5’和3’ TR之间携带长达27 kb的DNA。PiggyBac转座子介导基因整合时会在染色体TTAA位点切割DNA,并且优先选择基因内区域。以PiggyBac系统为例,具体的整合过程如下图所示:
CRISPR/Cas9技术:CRISPR/Cas9属于CRISPR系统中的II型,对于外源基因的剪切只需要一个剪切蛋白(Cas9蛋白),因其设计及操作相对简单,在基因编辑中得到了广泛应用,可以实现目的基因的敲除(knock out)、敲入(knock in)和转录激活。
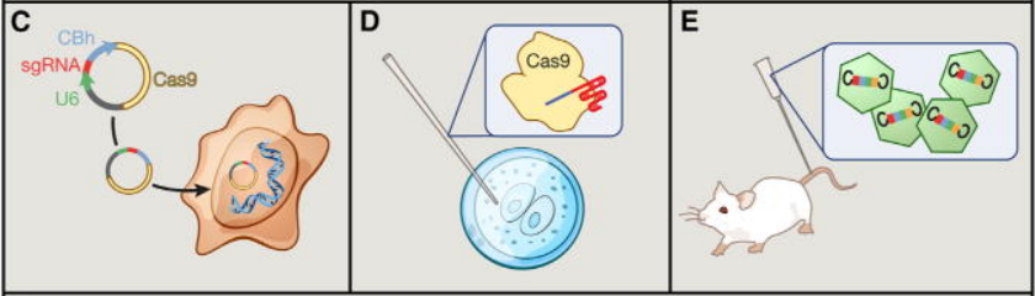
在构建基因敲除稳转细胞系时,首先进行质粒的结构设计,其中包括向导RNA(sgRNA,靶向目的基因)、Cas9酶基因、EGFP或其他标记蛋白等。质粒转染细胞后会在细胞内发挥基因编辑作用:在sgRNA的引导下,Cas9核酸内切酶会在PAM序列紧邻上游(即5'端)的特定位置切割DNA双链,导致DNA双链断裂。
图2 Cas9作为基因编辑工具在细胞中的应用[2]
(左:细胞系;中:受精卵;右:在体细胞)
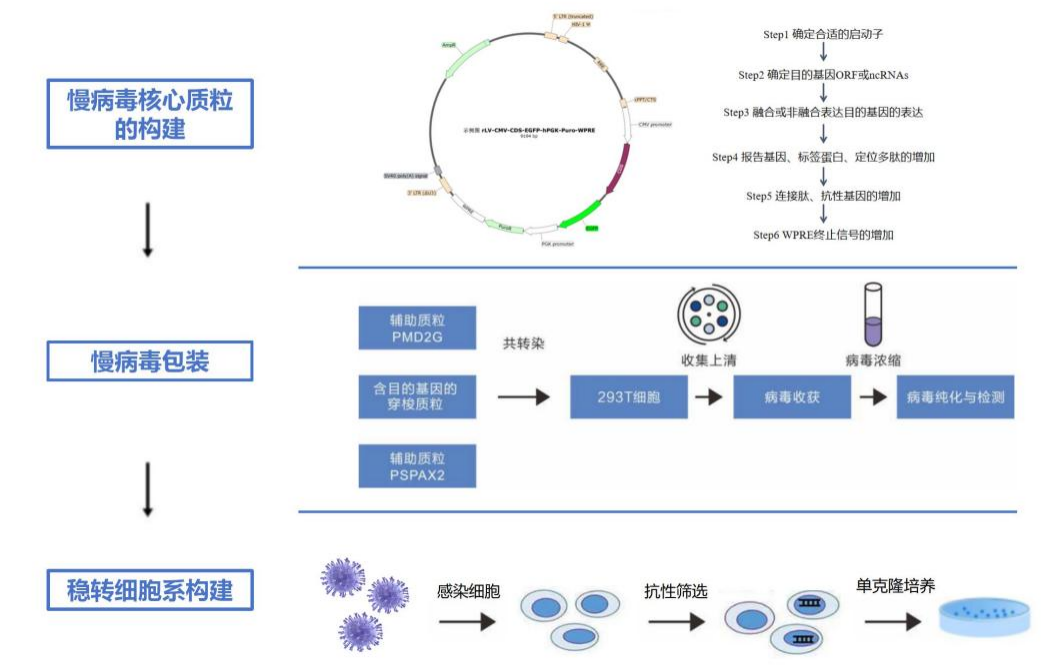
2.慢病毒介导的细胞感染:直接使用质粒转染并筛选的方法是最早采用的细胞系构建方案之一,但这种方法效率相对较低且稳定性较差。相比之下,慢病毒几乎可以感染所有类型的细胞(在分裂和不分裂的细胞),并且能够将遗传物质高效地整合到宿主细胞基因组中,实现长时间的稳定表达。由于其感染效率高、操作简便等优点,慢病毒介导的方法已成为目前构建稳转细胞株的主流技术。
慢病毒介导的稳转细胞株构建主要分为三大步:慢病毒表达载体构建、慢病毒包装及稳转细胞株构建。
1.长期稳定表达:稳转细胞系能够在长时间内稳定表达外源基因,这为长期实验及科研研究提供便利,且大部分用于科研实验的细胞可稳定重复传代。
2.重复性和准确性:稳转细胞系的遗传背景一致,可提供高度的实验重复性和结果的准确性。
3.功能研究:稳转细胞系可用于深入研究特定基因的功能,通过稳定表达目的基因,进而研究其在细胞生理和病理过程中的作用。
4.基因编辑验证:稳转细胞系可用于验证基因编辑技术的效果,如CRISPR/Cas9等,通过稳定表达报告基因来评估编辑效率。也可通过CRISPR/Cas9技术实现基因的敲除、敲入、转录激活或抑制从而进行基因的功能探究。
5.疾病模型构建:稳转细胞系可用于模拟疾病相关的基因表达变化,构建疾病模型,为疾病机理研究和治疗策略开发提供平台。
6.药物筛选和开发:在药物筛选中,稳转细胞系可以作为模型系统,用于高通量筛选和评估化合物的药效和安全性。
7.生产生物制品:在生物技术产业中,稳转细胞系可用于生产重组蛋白、抗体和其他生物制品。
案例一
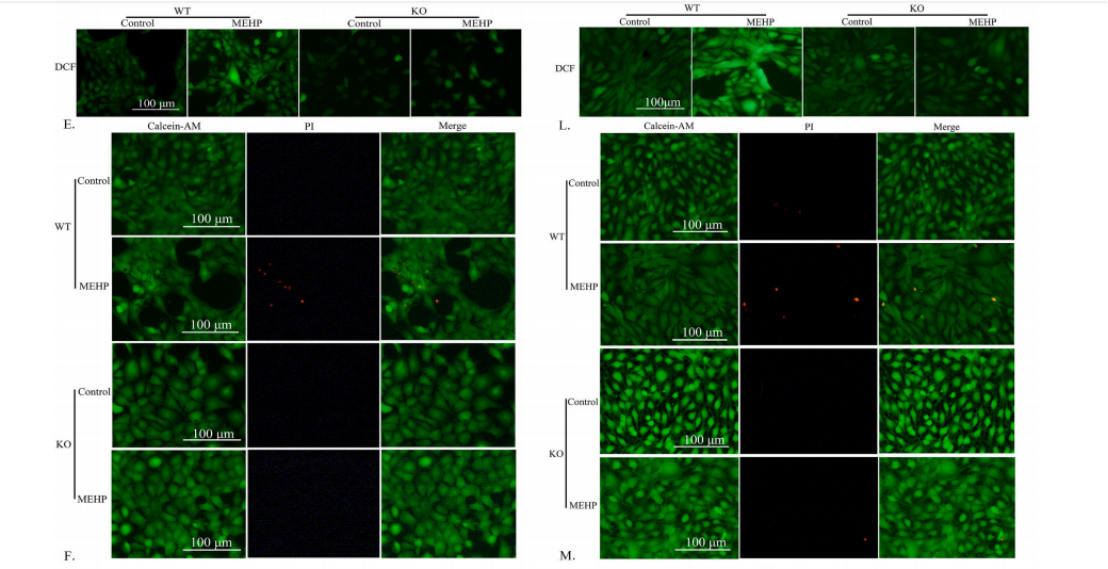
2021年12月,重庆医科大学附属儿童医院吴盛德课题组在Journal of Hazardous Materials发表了“Di-(2-ethylhexyl) phthalate exposure leads to ferroptosis via the HIF-1α/HO-1 signaling pathway in mouse testes”一文[3]。文章研究了环境内分泌干扰物邻苯二甲酸二(2-乙基己基)酯(DEHP)对小鼠睾丸的损伤作用,特别是其诱导的铁死亡现象。研究发现,围产期DEHP暴露导致小鼠血清中DEHP及其主要代谢产物MEHP浓度升高,利用RNA测序等技术揭示了铁死亡和HIF-1信号通路在DEHP诱导的睾丸损伤中的潜在作用。文章中通过CRISPR/Cas9技术构建了敲除Hif-1α基因的TM3 Leydig和TM4 Sertoli细胞系,证实了HIF-1α在DEHP诱导的铁死亡中发挥关键作用,其敲除可逆转由MEHP诱导的铁死亡。论文研究结果为理解DEHP诱导的睾丸损伤机制提供了新的见解,并指出了HIF-1α/HO-1信号通路在其中的重要性。
图4 HIF-1α基因敲除挽救了MEHP诱导的铁死亡
案例二
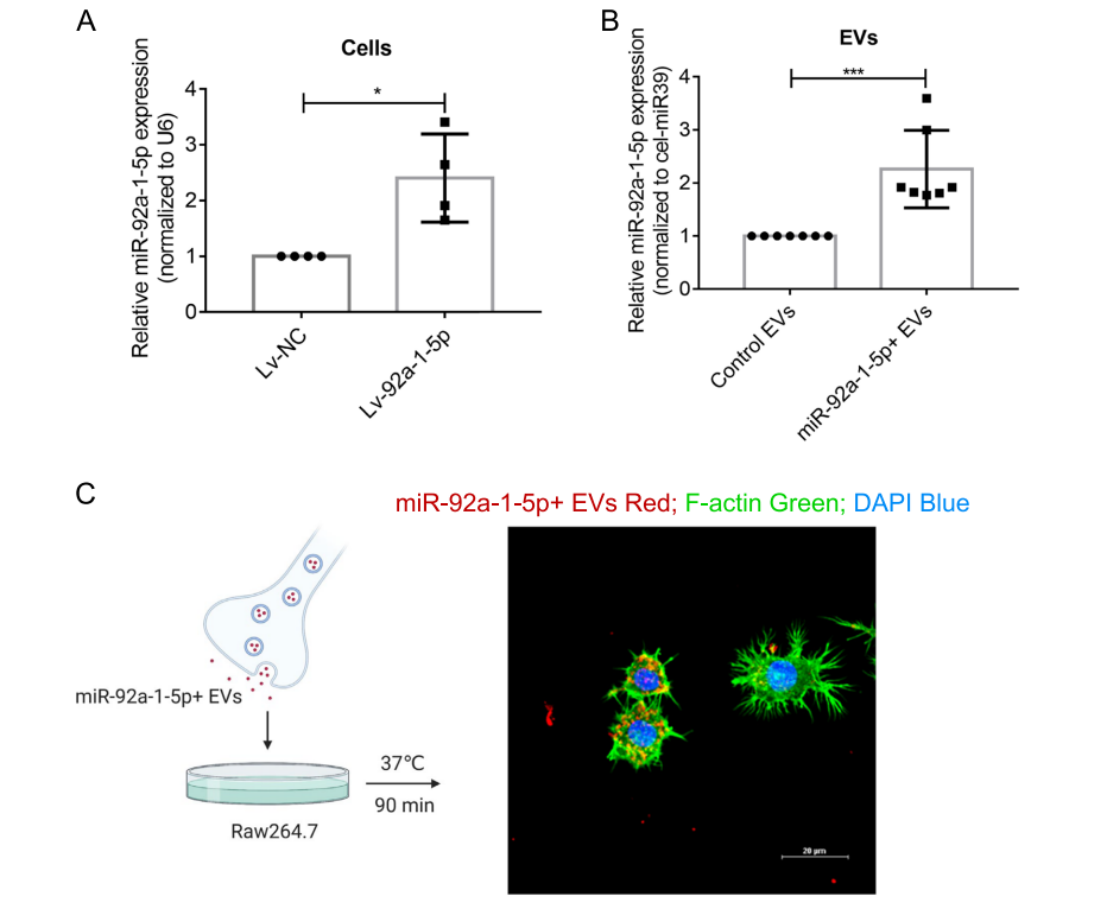
2023年5月,南方医科大学郑磊教授、第四军医大学郝晓柯教授团队在Journal of Experiment and Clinical Cancer Research发表“miR-92a-1-5p enriched prostate cancer extracellular vesicles regulate osteoclast function via MAPK1 and FoxO1”一文[4]。该论文在前期研究基础上,探究前列腺癌细胞来源的细胞外囊泡(EVs)特别是富集miR-92a-1-5p的EVs在调控破骨细胞功能方面的作用及其分子机制。文章通过构建miR-92a-1-5p过表达的前列腺癌细胞系(MDA PCa 2b),并发现这些工程化的EVs能够通过降低MAPK1和FoxO1的表达来促进破骨细胞的分化,与体内外骨吸收功能的增强有关。同时,体内实验也证实了miR-92a-1-5p富集的EVs能够促进骨质疏松。这些发现表明,miR-92a-1-5p富集的EVs可能通过MAPK1和FoxO1调控破骨细胞功能,为治疗骨疾病提供了新的视角和潜在的治疗策略。
图五 成功构建miR-92a-1-5p过表达稳转MDA PCa 2b细胞系
布林凯斯可以为客户提供全套的稳转细胞系构建(转座子、慢病毒),如果各位老师对构建稳转细胞系有相关需求的话,可以联系小布了解详情或下单定制~
参考文献:
[1]Mitra R, Fain-Thornton J, Craig NL. piggyBac can bypass DNA synthesis during cut and paste transposition. EMBO J. 2008 Apr 9;27(7):1097-109.
[2]Hsu PD, Lander ES, Zhang F. Development and applications of CRISPR-Cas9 for genome engineering. Cell. 2014 Jun 5;157(6):1262-1278.
[3]Wu Y, Wang J, Zhao T, Chen J, Kang L, Wei Y, Han L, Shen L, Long C, Wu S, Wei G. Di-(2-ethylhexyl) phthalate exposure leads to ferroptosis via the HIF-1α/HO-1 signaling pathway in mouse testes. J Hazard Mater. 2022 Mar 15;426:127807.
[4]Yu L, Sui B, Zhang X, Liu J, Hao X, Zheng L. miR-92a-1-5p enriched prostate cancer extracellular vesicles regulate osteoclast function via MAPK1 and FoxO1. J Exp Clin Cancer Res. 2023 May 2;42(1):109.