在神经退行性疾病的研究中,小胶质细胞作为中枢神经系统(CNS)的常驻免疫细胞,逐渐成为了科学家们深入探索的焦点。这些细胞在多种生理过程中发挥着不可或缺的作用,包括突触修剪、损伤修复、稳态维持、吞噬作用,以及支持其他神经胶质细胞和与其他细胞间的沟通。尤为重要的是,小胶质细胞与多种神经退行性疾病的发生和发展存在着密切联系。
当中枢神经系统受到损伤或疾病侵袭时,小胶质细胞会展现出复杂的反应,这种反应通常被称为“激活”或“活化”。在早期的小胶质细胞研究中,科学家们主要通过形态学观察来检测这些细胞的活化状态,即观察它们从正常脑中的分支表型转变为患病脑中的阿米巴状形态外观。然而,随着研究的深入,科学家们发现小胶质细胞的激活过程远比预期更加多样和动态,无论是在组学特征还是功能结果上都有所体现,这表明小胶质细胞在不同的疾病中会呈现出不同的反应模式。目前研究发现,在多种神经退行性疾病中观察到小胶质细胞的激活现象,包括阿尔茨海默病(AD)、帕金森病(PD)、多系统萎缩症(MSA)、肌萎缩侧索硬化(ALS)、额颞叶痴呆(FTD)、进行性核上性麻痹(PSP)、路易体痴呆(DLB)以及亨廷顿舞蹈病(HD)等。
1 . 阿尔茨海默病(AD)
研究表明,小胶质细胞在AD的发展中起着双刃剑的作用。一方面,它们能够吞噬并清除Aβ和tau蛋白,限制这些病理物质的传播,对早期病情可能具有保护作用。另一方面,当病理沉积物长期刺激小胶质细胞时,这些细胞可能发生功能障碍,转而促进神经炎症,加速Aβ和tau的扩散,导致神经退行性变。
大量证据表明,小胶质细胞通过多种方式对Aβ和tau蛋白产生影响。①Aβ结合小胶质细胞TREM2,TREM2促进小胶质细胞向DAM表型转化,激活TREM2信号传导,导致小胶质细胞吞噬功能增强。相反,TREM2功能的丧失损害了小胶质细胞对Aβ的吞噬作用,并增加了淀粉样蛋白的表达。②小胶质细胞中LC3相关的内吞作用(LANDO)促进了Aβ受体的再循环,增加Aβ表面受体,从而促进了Aβ的清除。相反,LANDO缺陷的AD小鼠诱导了神经变性和记忆缺陷。③随着年龄的增长,小胶质细胞上Nogo受体(NgR)的表达增加,削弱小胶质细胞的吞噬作用和Aβ的清除。相反,NgR缺陷的AD小鼠减少了淀粉样蛋白负担,改善了认知障碍。④小胶质细胞中BACE-1的抑制促进了小胶质细胞表型从稳态向I期疾病相关小胶质细胞(DAM-1)信号的转变,从而增强了淀粉样蛋白的清除并改善了AD小鼠的认知能力。⑤小胶质细胞与星形胶质细胞相互作用,识别Aβ沉积后,小胶质细胞增加了IL-3特异性受体IL-3Rα的表达。星形胶质细胞衍生的IL-3与小胶质细胞中上调的IL-3Rα结合,增强小胶质细胞向Aβ沉积的迁移和Aβ聚集物的清除。⑥APOE3脂蛋白诱导小胶质细胞更快地向Aβ迁移,促进Aβ摄取,并改善认知。
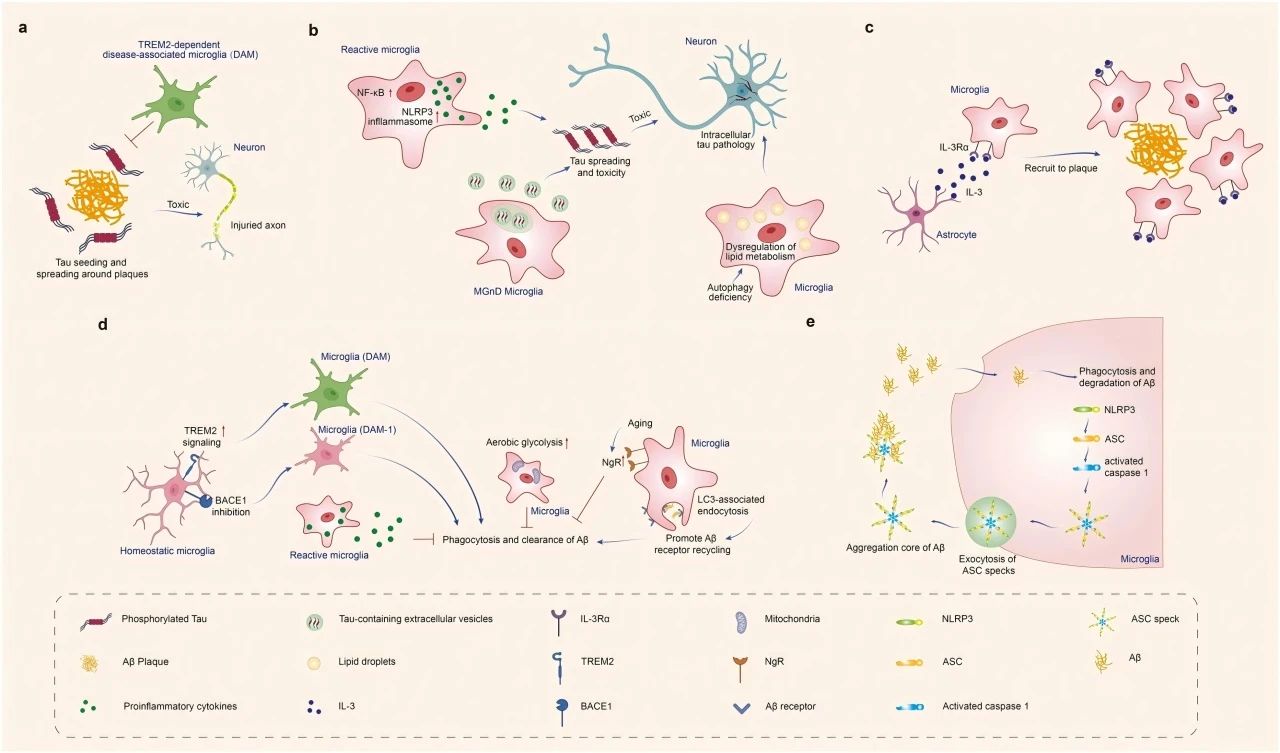
图1 小胶质细胞对阿尔茨海默病中Aβ和tau病理的影响。小胶质细胞吞噬Aβ和tau,限制Aβ和tau病理的传播。然而,在病理条件下,小胶质细胞也可能加速Aβ和tau的扩散,导致神经退行性病变。
2 . 帕金森病(PD)
小胶质细胞具有模式识别受体(PRRs),如TLRs、NLRs、SRs,使其能够检测和响应不同的刺激。当α-syn在细胞外积聚并且没有被适当清除时,它可以通过PRRs激活小胶质细胞,然后α-syn与膜受体相互作用启动促炎反应,膜受体通过各种介质激活NF-κB并组装NLRP3炎症体,导致炎症介质和自由基的产生,引发神经炎症。
此外,小胶质细胞与神经元之间的通路连接,也与PD的进展密切相关。CX3CL1-CX3CR1信号通路对于维持小胶质细胞活性的健康平衡、调节化学吸引和突触可塑性以及减少小胶质细胞介导的炎症和神经毒性至关重要。CD200-CD200R通路的失调与小胶质细胞活化增加和多巴胺能神经元变性有关。此外,CB1受体在神经元中丰富,而CB2受体主要在大脑中的小胶质细胞中表达,帕金森病动物模型表明,小胶质细胞CB2受体激活具有神经保护作用,并改善运动症状。
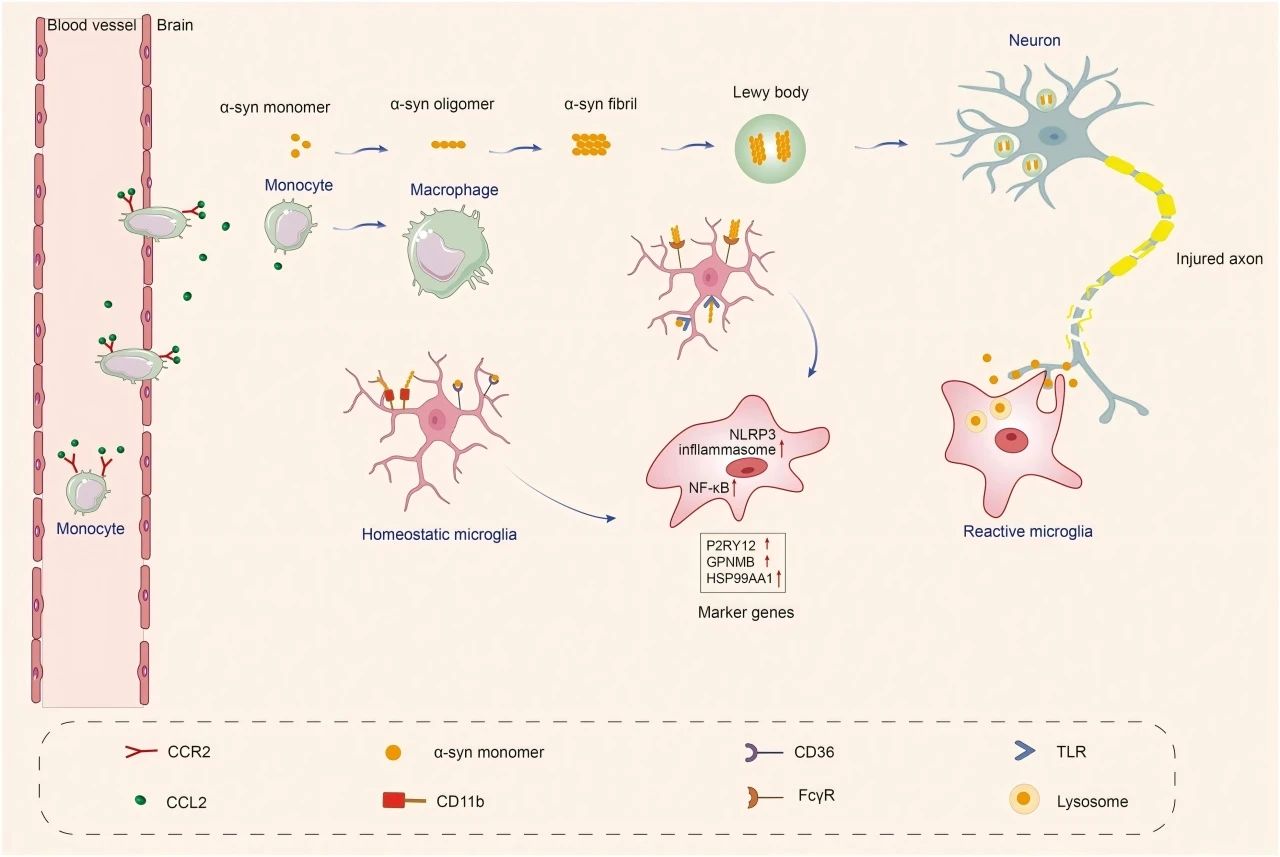
图2 α-syn在帕金森病中导致小胶质细胞反应。
3 . 多系统萎缩(MSA)
研究发现,α-syn诱导的小胶质细胞激活依赖于小胶质细胞toll样受体TLRs 1/2信号和TLR4信号。在MSA小鼠模型中,α-syn可与TLRs相互作用,然后被小胶质细胞吞噬。但小胶质细胞过度摄取α-syn也会导致小胶质细胞吞噬能力显著下降,引发小胶质细胞的炎症反应,包括NF-κB和NLRP3炎症小体信号激活、活性氧产生、促炎细胞因子上调,从而形成毒性环境,最终诱导神经退行性变。此外,CD4和CD8 T细胞的去除减轻了α-syn诱导的MSA小鼠的炎症和脱髓鞘。见图3。
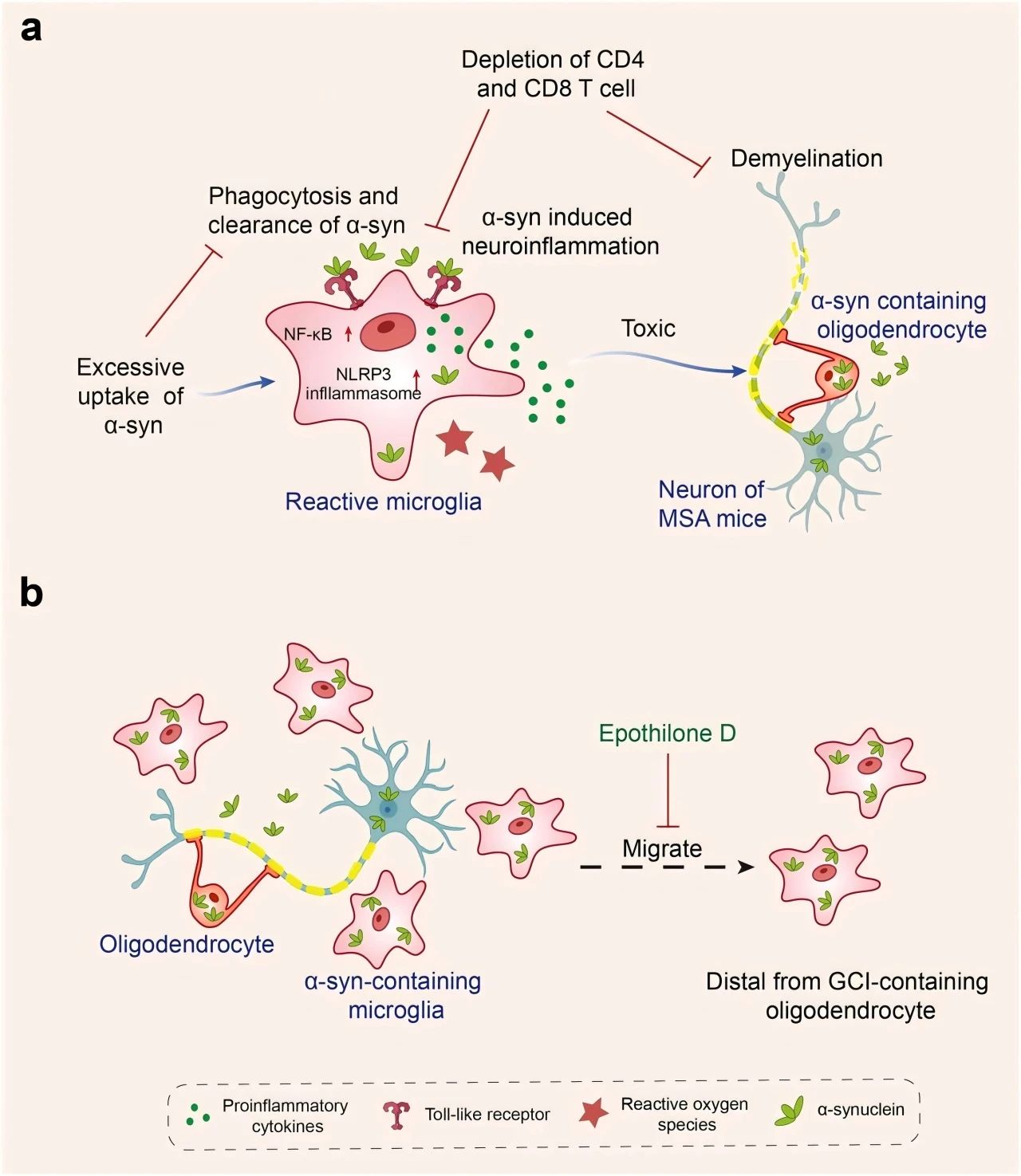
图3 小胶质细胞在多系统萎缩症(MSA)发病机制中的作用。
4 . 肌萎缩侧索硬化 (ALS)、额颞叶痴呆(FTD)
研究发现,小胶质细胞可以吞噬TDP-43等病理性蛋白沉积,TDP-43与小胶质细胞TREM2的相互作用促进了小胶质细胞对它们的吞噬和清除。相反,小胶质细胞对TDP43聚集体的吞噬作用导致小胶质细胞活化,当这种激活过度,会引起小胶质细胞NLRP3炎症小体活化和促炎标记物上调,对运动神经元具有神经毒性作用。此外,小胶质细胞中的前颗粒蛋白缺陷激活了小胶质细胞NF-κB信号,并促进了促炎细胞因子的释放,导致了中等多棘神经元的过度兴奋。见图4。
在疾病状态下,前颗粒蛋白缺乏还会导致小胶质细胞溶酶体发生功能障碍,减少沉积蛋白和髓鞘碎片的清除,并在白质中积累髓鞘碎片。此外,小胶质细胞通过与补体相互作用增加突触修剪,也会加剧神经元损失,导致行为异常。
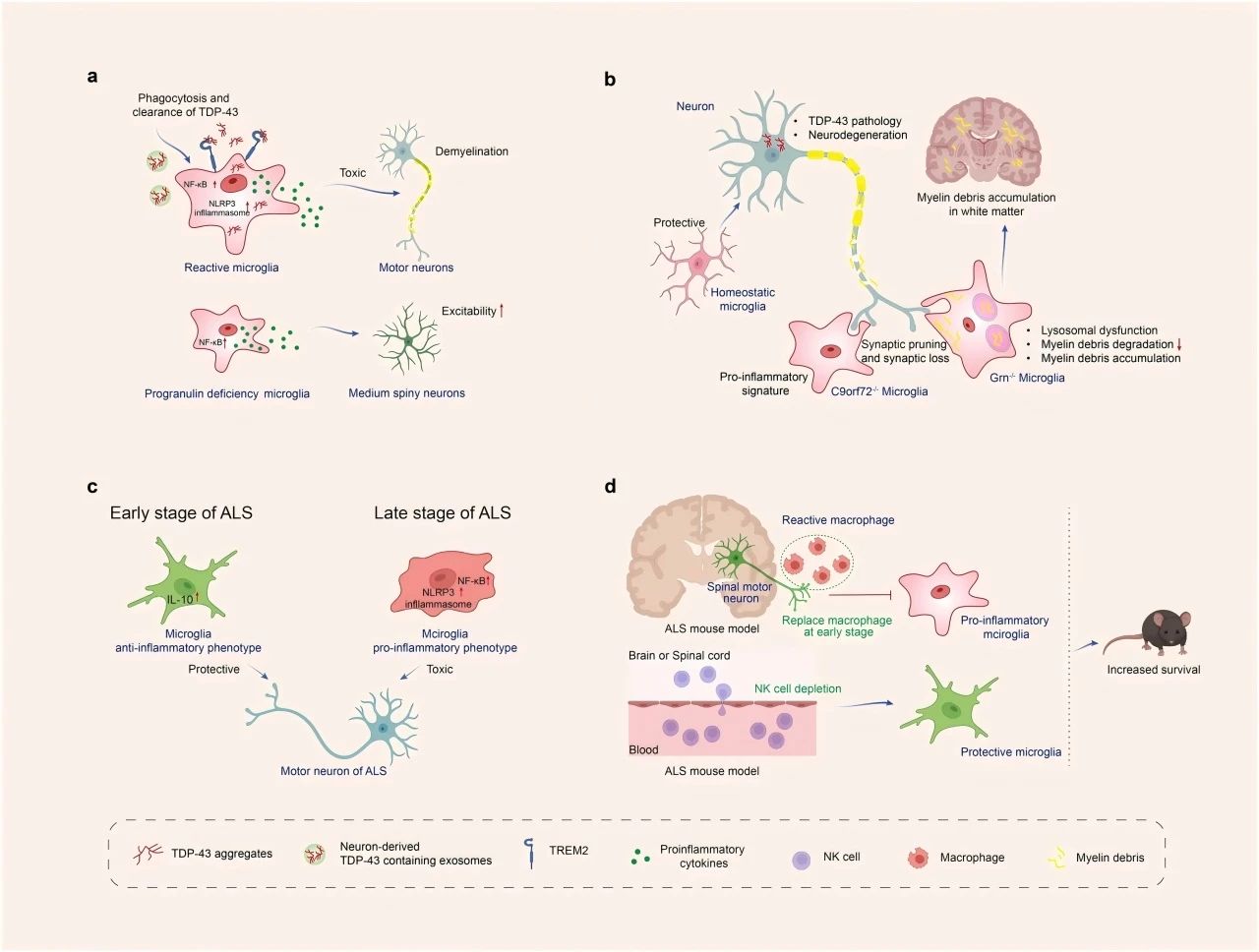
图4 小胶质细胞在肌萎缩性脊髓侧索硬化症 (ALS)和额颞叶痴呆(FTD)的发病机制中的作用。
5 . 其他
基于上述对神经退行性疾病与小胶质细胞之间复杂关系的深入理解,研究者们正积极探索一系列创新的治疗策略,旨在通过调节小胶质细胞的功能来促进疾病的治疗。在细胞实验、动物模型及临床试验中,这些策略的原理和效果得到了初步验证。
1 . 调节神经炎症
2 . 抑制小胶质细胞外泌体的合成和分泌
3 . 改变小胶质细胞的代谢途径
4 . 改变小胶质细胞表型
5 . TREM2基因干预激活
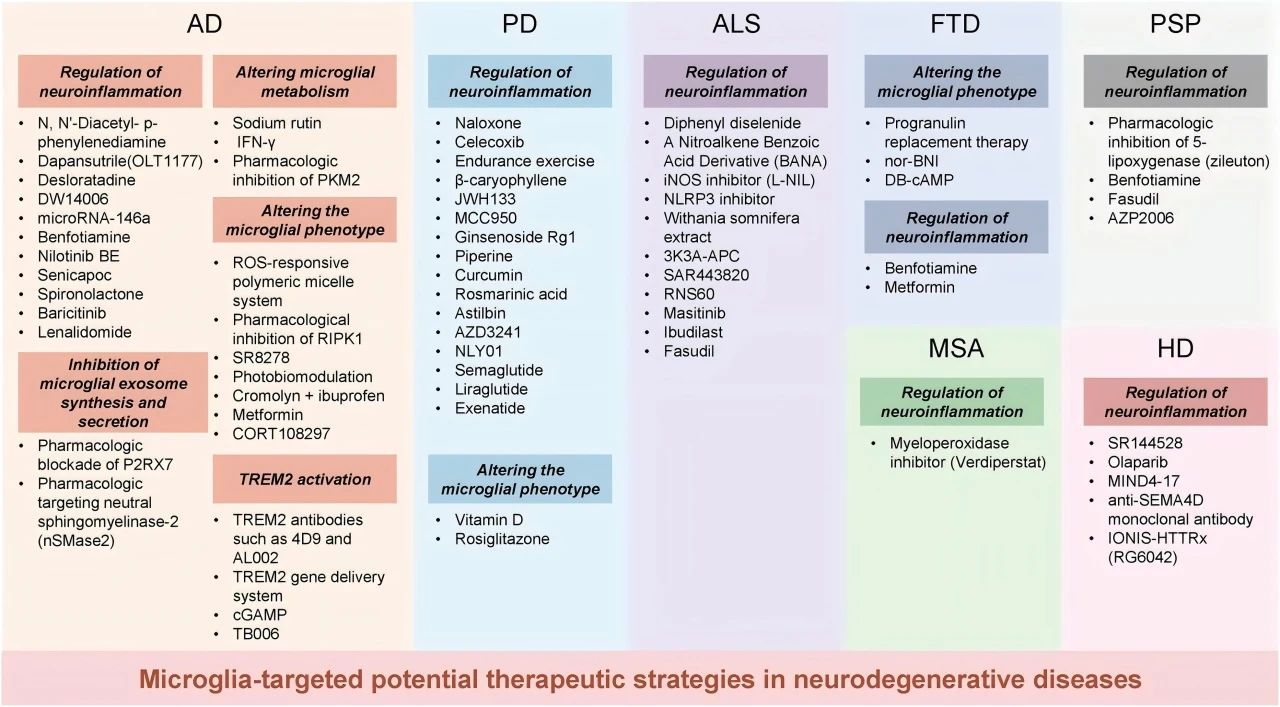
图5 针对神经退行性疾病可能的小胶质细胞靶向干预和治疗。
综上所述,小胶质细胞在神经退行性疾病中的作用是多方面且复杂的。通过深入研究和探索其治疗策略,为神经退行性疾病的治疗提供了新的思路,也为未来开发更加精准和有效的治疗方法奠定了坚实的基础。
Brain Case推出了一款创新的AAV11血清型载体,型号BC-ZA0182:rAAV-mIBA1-EGFP-WPRE-4×miR-9.T,专为高效且特异性地转导小胶质细胞而设计。此外,该载体设计灵活,可以通过改造来过表达或干扰特定基因,或者整合光遗传学、化学遗传学、钙成像等技术,从而为深入探究小胶质细胞的功能、机制以及其在神经系统疾病中的角色提供了一套强大的基因操作工具。
参考文献
Gao C, Jiang J, Tan Y, Chen S. Microglia in neurodegenerative diseases: mechanism and potential therapeutic targets. Signal Transduct Target Ther. 2023 Sep 22;8(1):359. doi: 10.1038/s41392-023-01588-0. PMID: 37735487; PMCID: PMC10514343.
本文未经授权禁止转载
如有需要,可联系小编获取原文