阿片肽在人体中扮演着调控疼痛感知、愉悦感以及厌恶反应等关键角色,并且与多种临床病症紧密相关。这些肽类包括但不限于强啡肽、脑啡肽和β-内啡肽,它们通过与κ、δ、μ型阿片受体结合来发挥效应。由于过去缺乏能够精确追踪这些阿片肽动态变化的实验手段,相关的科学研究进展缓慢。常规的检测技术例如微透析技术和免疫组织化学分析,都存在一定的局限性,如分辨率不足和无法提供实时数据等。因此,研究者迫切需要一种能够提供更高时空分辨率的检测手段,以便更深入地理解阿片肽在健康和疾病状态下的作用。
2024年7月15日,加州大学戴维斯分校Lin Tian实验室与华盛顿大学Michael R. Bruchas实验室和加州大学圣地亚哥分校Matthew R. Banghart实验室在Nature Neuroscience杂志在线发表了题为"Unlocking opioid neuropeptide dynamics with genetically encoded biosensors"的研究论文,该研究介绍了一种创新的荧光探针技术,这种技术基于基因编码,能够实时追踪和监测体内阿片肽的活性变化。

研究人员在人类κ阿片受体(kappa opioid receptor,κOR)的细胞内环(ICL)3的R257和跨膜域(TM)6的R6.24之间,人类δ阿片受体(delta opioid receptor,δOR)的ICL3的S247和TM6的K6.24之间,以及人类μ阿片受体(mu opioid receptor,μOR)的TM6的S6.23和TM6的K6.24之间,替换了氨基酸,并与环形排列的绿色荧光蛋白(cpGFP)融合,分别生成了κLight、δLight和µLight探针。为了增强膜定位效果,在κLight、δLight和µLight的C末端融合了一种大脑皮层蛋白(TlcnC)标签或内质网(ER)出口信号(FCYENEV),随后是一串GS连接体和PRC标签,分别将这些新变体命名为κLight1.3、δLight1和µLight1。
此外,研究人员对κOR的D3.22和δOR的D3.32结合区域进行了突变,以减弱配体的结合,产生了两个对照探针κLight0和δLight0。这三种探针在495 nm处的激发峰波长一致,在515 nm处的发射峰波长一致;原位滴定法显示,三种探针都能被三种不同的内源性阿片类肽激活(强啡肽、脑啡肽、β-内啡肽),但其效力和功效不同;κLight1.3和δLight对内源性阿片类多肽均具有选择性和敏感性,µLight特异性较低。κLight对强啡肽DynA13的半数有效浓度(EC50)达到了89.8 pM,而δLight对甲硫氨酸脑啡肽ME的EC50为6.5 nM。κLight1.3对β-内啡肽的荧光变化最高(ΔF/F=126.9%±8.6%),其次是DynA13和ME (ΔF/F=93.6% ± 3.9%;ΔF/F=80.3%±1.8%);δLight对ME的荧光相应度最高(ΔF/F= = 246.1% ± 4.6%),其次是DynA13和β-endorphin。
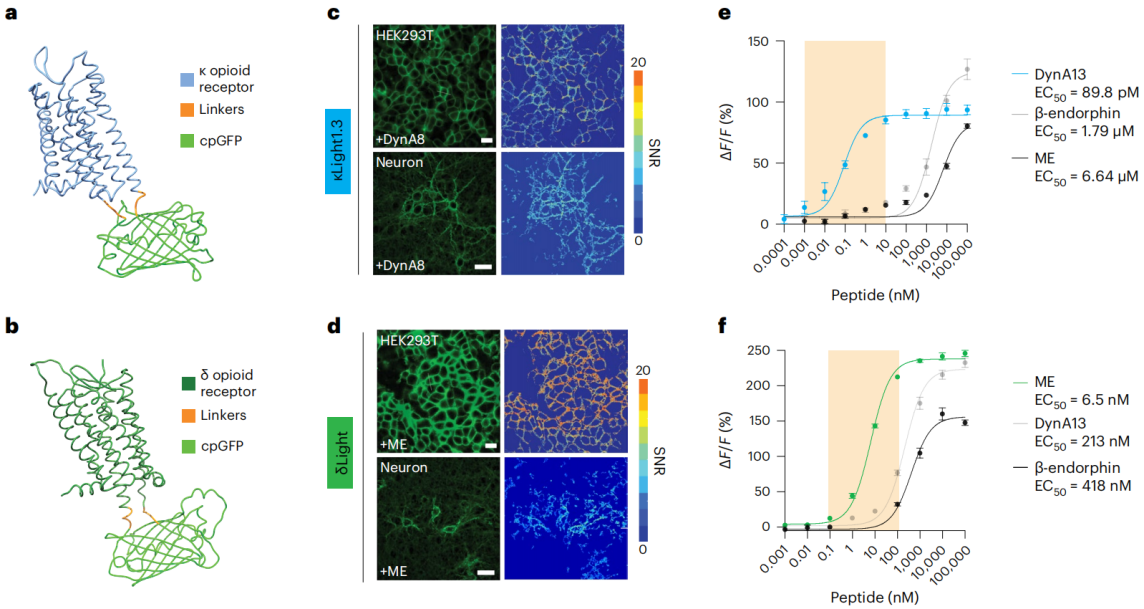
图1 293T细胞和海马神经元细胞瞬时转染κLight1.3、δLight
为了提高κLight1.3探针的基础荧光亮度,研究人员通过引入新的连接子(CYKIWRNFKGK和SVISKAKIRTV)来改进探针,生成了新的变体κLight1.3a。这个新变体在保持相似的动态范围的同时,基础亮度提高了2倍以上。研究人员在小鼠的CA3区域表达了κLight1.3a探针,通过AAV病毒载体将探针与Cre重组酶共表达,以实现特定神经元群体的标记。利用双光子成像技术,研究人员在活体脑片中能观察了κLight1.3a在神经元轴突和突触的分布,并在电刺激后监测到荧光变化。通过改变电刺激的参数(如刺激次数、激光强度和刺激时间),研究人员确定了能够最有效地触发内源性阿片肽释放的刺激条件。他们发现,以频率50次/秒,间隔是0.5秒的电刺激作用于CA3脑区,κLight1.3a探针荧光会持续增加,并在刺激停止后迅速衰减;随着刺激数量的增加,荧光亮度也随之增强,这一反应可以被κ受体拮抗剂nor-BNI所抑制。
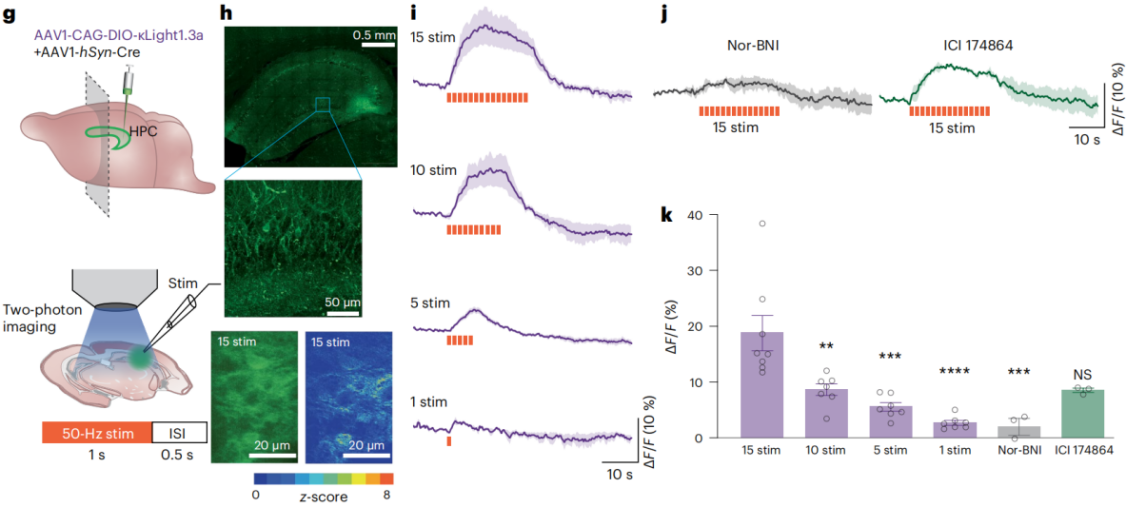
图2 急性脑切片中的κLight1.3特征
虽然光遗传学已被广泛用于触发神经肽的释放和神经活动,但在体内直接监测由光遗传刺激触发的肽释放尚未被光学测量,特别是以神经环路形式的高时间分辨率的方式。NAc含有丰富的强啡肽,先前的研究表明,靶向伏隔核壳(NAcSh)的Dyn-κOR系统可以调节奖赏和厌恶行为。研究还表明,基底外侧杏仁核(BLA)向NAcSh发送密集的、功能性的兴奋性投射,并且这些终末对Dyn-κOR的调节很敏感。为了验证光遗传刺激特定神经回路是否可以有效地触发内源性阿片肽的释放,并且通过基因编码的生物传感器进行实时监测,研究人员利用光遗传学工具,通过向小鼠的BLA注射含有红色光敏感蛋白ChRimson的AAV病毒,同时在NAcSh注射含有κLight1.3a的AAV病毒,以实现对特定神经回路的光遗传控制和监测。给一个1s、20HZ、5ms脉宽的光刺激后,κLight1.3a荧光显著增加。药物特异性的验证结果表明,阿片受体拮抗剂能够显著降低光刺激引起的传感器激活,而激动剂预处理则减少了光刺激引起的传感器激活,这表明光刺激引起的传感器激活是由于内源性强啡肽的释放。
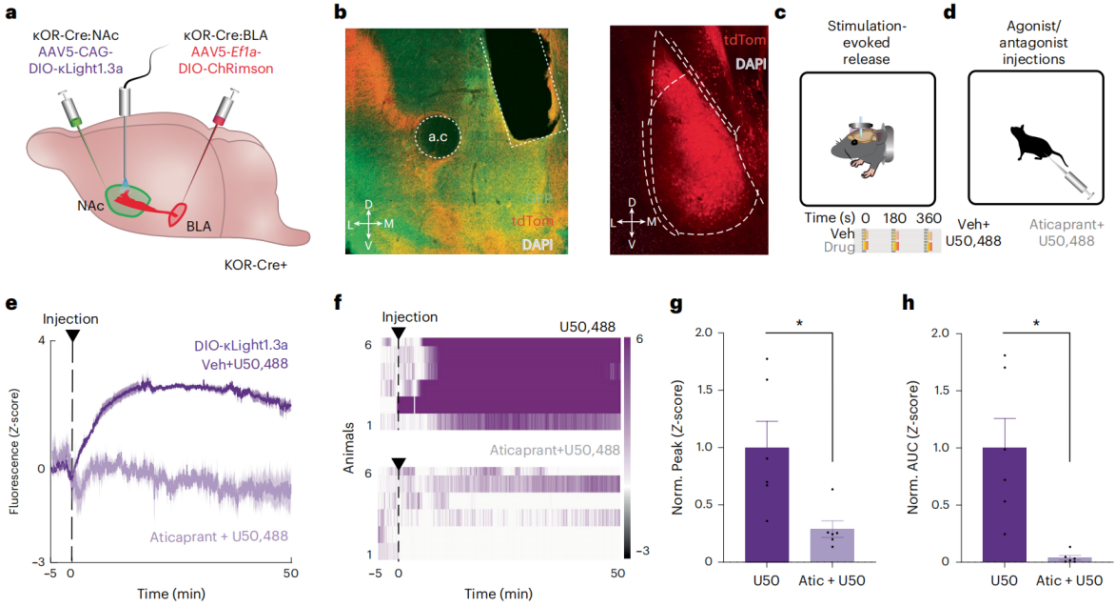
图3 用κLight1.3a成像光遗传刺激的强啡肽释放
在成功检测到光遗传诱发的强啡肽释放后,接下来试图使用κLight和δLight监测恐惧和奖赏条件下行为动物的阿片类肽信号动力学。已经使用光学透析方法测量了vNAc和dNAc中亚区域特异性的强啡肽和脑啡肽的释放,因此,研究人员决定研究κLight1.3和δLight在探索恐惧学习过程中NAc亚区中阿片类肽的特异性释放方面的效用。在dNAc和vNAc中分别注射AAV9-hSyn-κLight1.3或AAV9-hSyn-δLight,然后植入光纤。在给小鼠电刺激诱导恐惧时,无论是dNAc和vNAc都观察到κLight1.3探针荧光强度的快速上升,40s后,荧光信号逐渐下降至基线水平;足部电击能引发dNAc中δLight探针大规模的荧光增加,然后在电击超过10秒后急剧衰减。总之,数据表明κLight和δLight可以真实地报告在恐惧学习过程中触发的内源性阿片肽释放的亚区域差异。此外,研究人员还发现κLight和δLight也能监测奖赏行为NAc亚区阿片肽的释放。总之,这些结果表明,κLight和δLight可以准确地指示恐惧和奖赏行为的全过程中内源性阿片肽释放的动态变化。
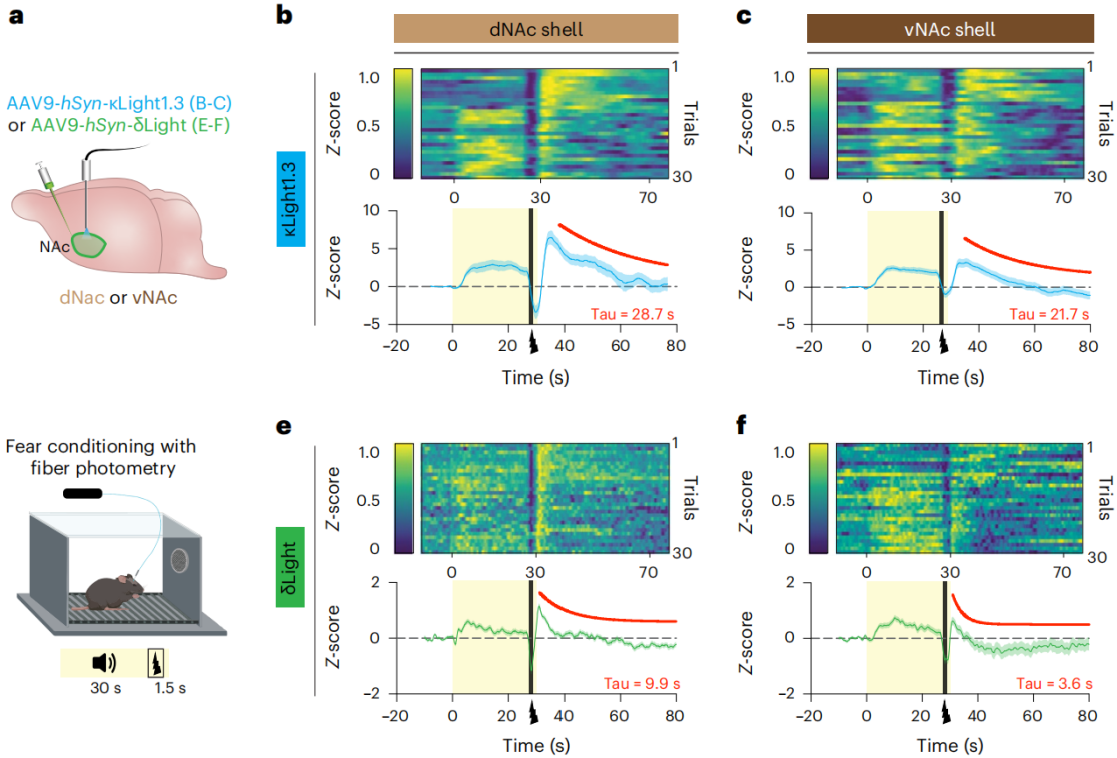
图4 在厌恶和奖励行为中强啡肽和脑啡肽动力学
阿片肽探针的开发克服了以往研究中缺乏精确工具的局限,允许研究者在特定神经回路中研究阿片肽的复杂和多样化动态。通过在哺乳动物细胞和小鼠体内的实验,研究者们展示了这些探针在检测光遗传学驱动的阿片肽释放以及响应恐惧和奖赏条件时的效果。这项研究不仅提高了我们对阿片肽系统在调节复杂行为和生理过程中作用的理解,还为开发治疗疼痛、成瘾和其他相关疾病的新策略提供了潜在的科学基础。
※如果您对κLight和δLight探针感兴趣,可以联系小布了解详情或下单订购。