在神经科学领域,精确标记突触对于揭示神经计算原理、神经回路的连接性及其可塑性至关重要。然而,传统免疫组织化学技术虽然可以标记突触,却需要固定组织,这限制了对活组织的可视化,且难以准确识别特定细胞来源的突触。为了解决这些问题,Han Lab于2020年7月24日发表了研究成果《A Viral Toolbox of Genetically Encoded Fluorescent Synaptic Tags》。该研究利用mRNA展示技术生成的纤维连接蛋白内抗体,开发出一种病毒载体介导的遗传编码荧光突触标记工具——FingRs(Fibronectin intrabodies generated with mRNA display)。这些工具能够实现对大脑多个区域中兴奋性或抑制性突触的多色、神经元类型特异性标记,且不影响内源性突触蛋白的表达及突触传递功能。FingRs的应用不仅推动了对大脑功能及神经系统疾病的深入理解,也在监测新生神经元突触的发育及分析疾病模型中突触重组方面展现出广阔的应用前景。
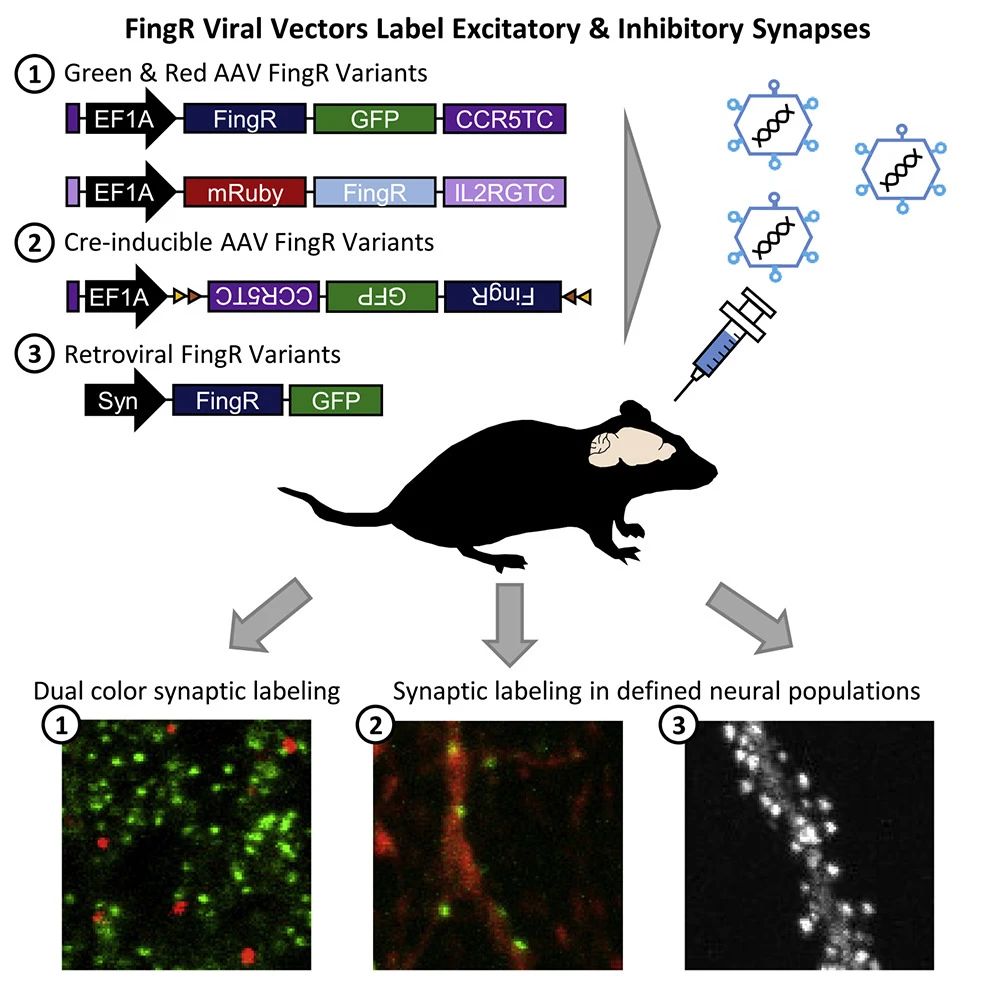
众所周知,PSD95和Gephyrin分别是兴奋性和抑制性突触后膜的关键支架蛋白。在最近的研究中,科学家们分别为这两种蛋白设计了可遗传编码的FingR多肽序列——PSD95.FingR和GPHN.FingR。这些多肽在活体和固定的神经元中充当细胞内抗体,能够特异性地与PSD95和Gephyrin结合。为了避免FingR表达过量,研究团队引入了CCR5转录反馈调节结构域(CCR5TC),以此调控FingR的表达水平,确保其与内源性蛋白靶标的水平相协调。这一策略有助于维持细胞内环境的稳定性。
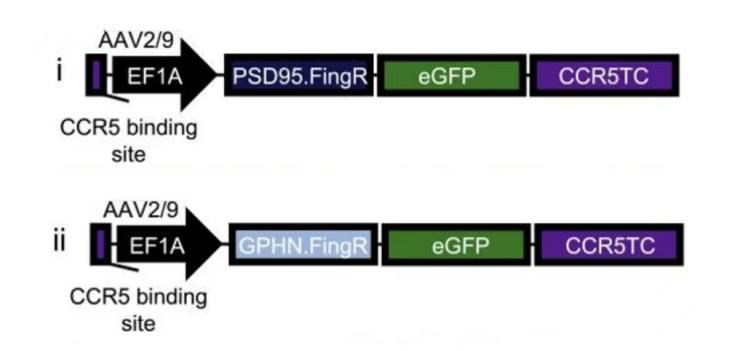
图1 兴奋性或抑制性突触标记工具PSD95.FingR和GPHN.FingR结构示意图
通过使用AAV作为病毒载体工具,研究者在小鼠大脑的皮层、纹状体和海马区精确注射了携带PSD95.FingR-EGFP和GPHN.FingR-EGFP的AAV9-EF1α病毒(见图1)。结果显示,这些区域均表现出强烈的斑点状表达模式,并且通过与兴奋性突触标记物Homer和抑制性突触标记物Gephyrin的抗体共染色,证实了FingRs与这些标记物的共定位(见图2)。这一结果证实了FingRs能够在大脑皮层及皮层下区域的神经元中有效标记兴奋性或抑制性突触,且具有亚微米级的空间分辨率。
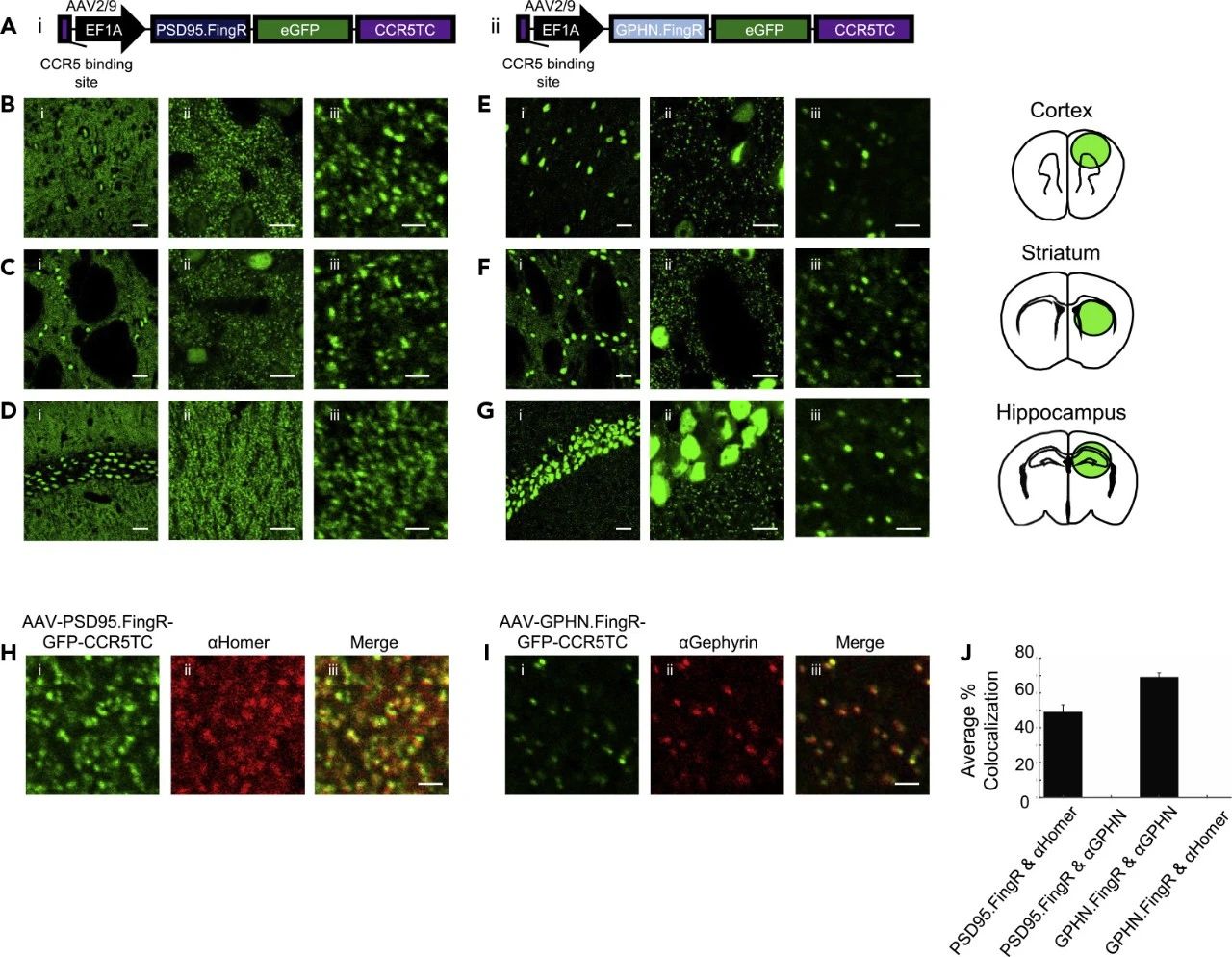
图2 AAV载体携带的PSD95.FingR和Gephyrin.FingR可以在小鼠大脑区域中以亚微米级别的精准度标记兴奋性和抑制性突触
此外,研究人员对抑制性突触标记物GPHN.FingR-EGFP进行了一系列改造,筛选出了一种新型的明亮红色FingR变体——mRuby2-GPHN.FingR。通过将mRuby2-GPHN.FingR与PSD95.FingR-EGFP一同注射到海马区,研究人员成功实现了海马区神经元中兴奋性和抑制性突触的同时标记(见图3)。这一技术突破使得在同一细胞中同时识别兴奋性和抑制性突触成为现实,对于研究大脑内兴奋与抑制信号的平衡及其在神经功能中的作用具有重大意义。
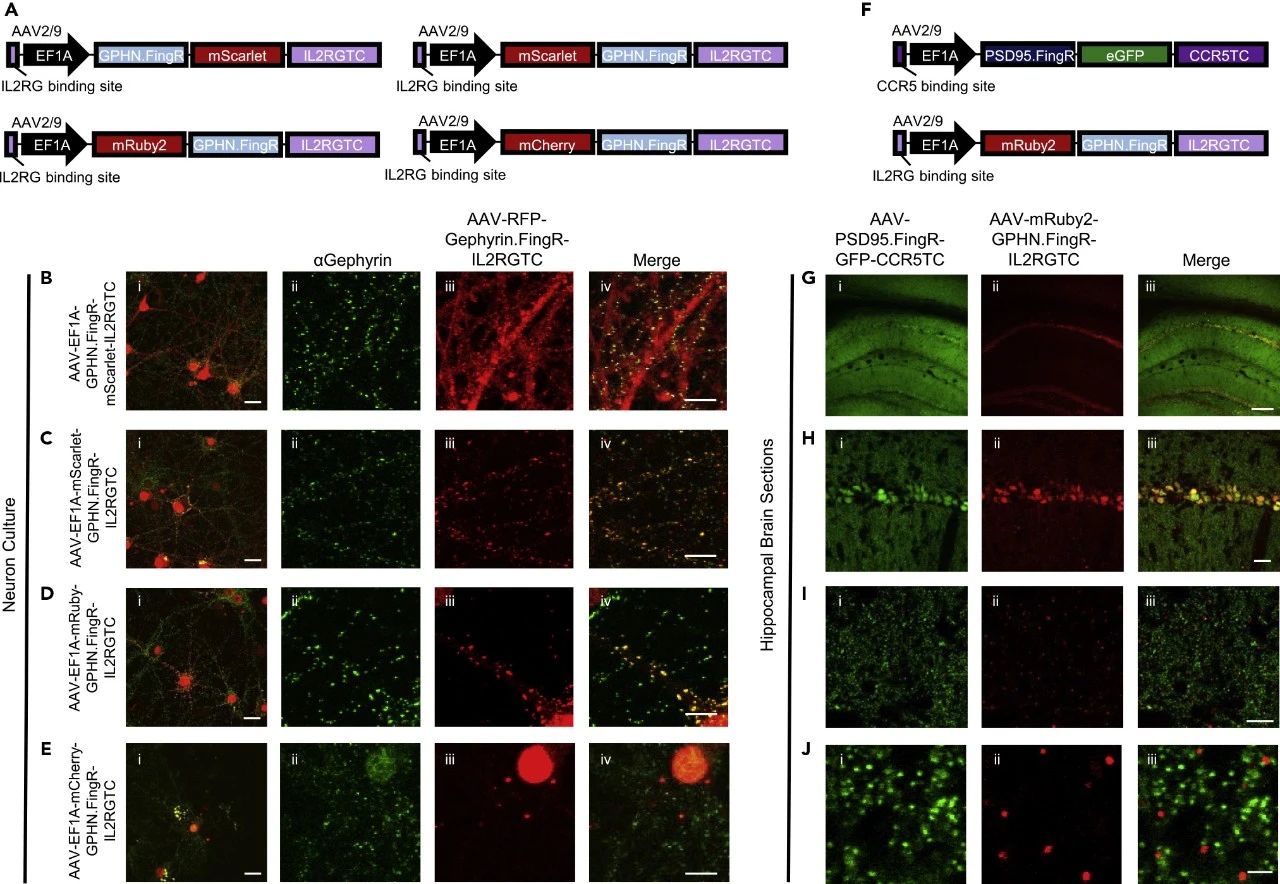
图3 优化红色AAV-Gephyrin.FingR载体实现兴奋性和抑制性突触的双重标记
研究团队运用Cre重组酶系统,构建了一种Cre诱导型的AAV FingR载体,这一技术成功实现了对纹状体中棘胆碱能中间神经元突触的精确标记(见图4)。这一方法不仅为特定神经元群体的突触标记提供了可能,而且在疾病模型中对突触重组进行分析也显示出巨大的应用潜力。特别是在探讨多巴胺耗竭如何影响纹状体胆碱能神经元突触密度的研究中,这一技术将发挥重要作用。
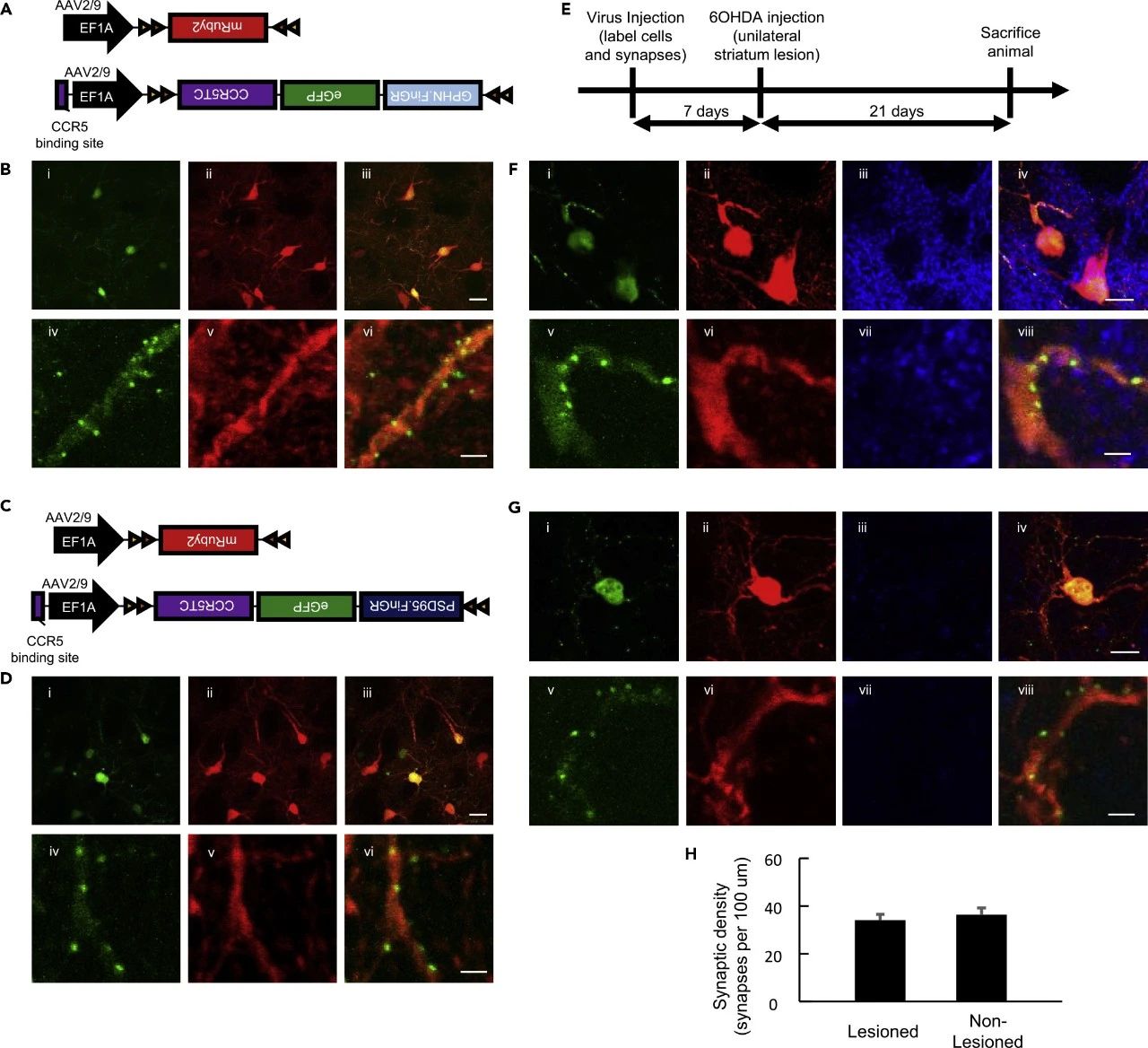
图4 Cre诱导型AAV FingR载体标记纹状体中棘胆碱能中间神经元的突触
本研究开发的FingRs病毒载体工具为神经科学领域提供了一项强大的工具,它不仅能够用于活体大脑中突触的精确标记和研究,还能用于追踪发育过程中或疾病状态下突触组群的变化。这一工具极大地促进了我们对大脑功能及疾病条件下突触变化机制的深入理解。
Brain Case兴奋性突触定位PSD95.FingR
及抑制性突触定位GPHN.FingR
系列产品现已经上架!

除所列种类外,还可根据实验需求定制
详细请联系小布18971216876(微信同号)
参考文献
Bensussen S, Shankar S, Ching KH, Zemel D, Ta TL, Mount RA, Shroff SN, Gritton HJ, Fabris P, Vanbenschoten H, Beck C, Man HY, Han X. A Viral Toolbox of Genetically Encoded Fluorescent Synaptic Tags. iScience. 2020 Jul 24;23(7):101330.