腺相关病毒(AAV)载体介导的基因治疗被认为是安全、高效且极具前景的肝脏基因转移方法。在血友病A和B患者中,肝靶向AAV基因治疗已取得显著疗效,越来越多的临床试验证实了其有效性。通过肝内或静脉注射,利用AAV的高感染性将目的基因导入肝细胞,实现基因表达。选择合适的AAV血清型和肝脏特异性启动子,能够实现对肝细胞的稳定转染,并确保外源基因在血液和靶组织中的有效表达。

AAV8能跨越存在于内皮细胞和血管之间的屏障而转染该组织和细胞,与其他血清型AAV载体相比,AAV8载体转导肝脏的效率提高了10-100倍。AAV7、AAV9和AAV-DJ也可用于肝脏研究。
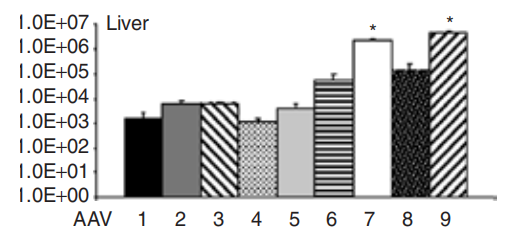
图1 不同血清型在肝脏中表达情况[1]
在肝靶向AAV基因转移中,载体的给药途径确实会影响肝细胞的转导效率,但这也受到衣壳血清型和基因组配置等其他因素的影响。以下将介绍小型动物、大型动物及人类模型中最常用的给药途径见图2,并为选择最佳给药途径以达到预期的实验结果提供了指导。
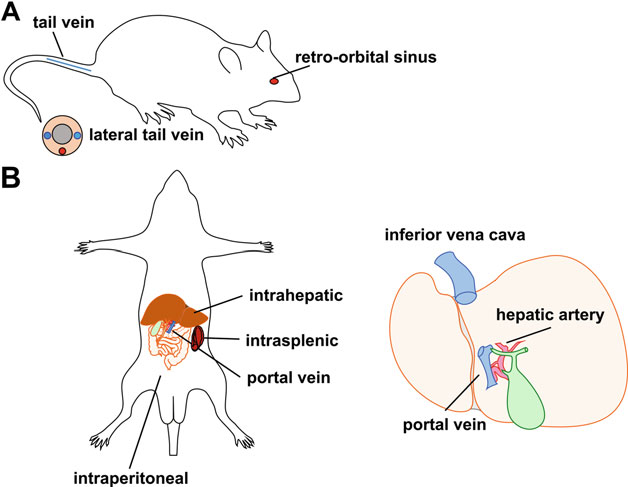
图2 常用肝脏注射方式示意图[2]

实例1:下调肝sEH可诱导抗抑郁样作用[3]
载体:AAV2/8-CMV-eGFP-H1-Ephx2-shRNA1
启动子:CMV,H1
实验动物:CMS小鼠(慢性应激模型)
注射方式:尾静脉注射,1x1011 vg/只
实验结果:为了确定肝脏sEH的下调是否会诱导抗抑郁样作用,通过尾静脉注射AAV8病毒,将干扰目的基因的shRNA片段递送入小鼠体内,特异性靶向肝脏实现肝细胞中sEH的下调,结果显示肝sEH可能在抑郁症的病理生理过程中起着重要作用。
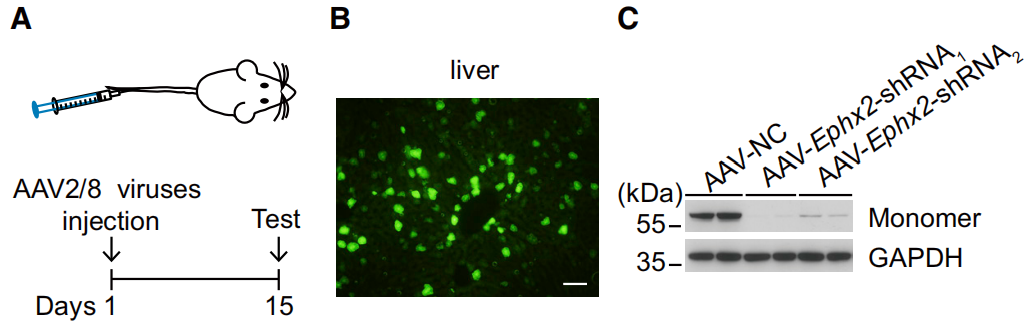
图3 下调肝sEH可诱导抗抑郁样作用[3]
实例2:AAV8介导SaCas9及其sgRNA在体内表达[4]
载体:AAV2/8-TBG-SaCas9-bGH polyA-U6-sgRNA(Pcsk9)
启动子:TBG
实验动物:C57小鼠
注射方式:尾静脉注射,1x1011vg/只,表达4周
实验结果:靶向Pcsk9的sgRNA和SaCas9构建在同一个AAV载体上进行病毒包装,将AAV病毒通过尾静脉注射的方式注射到小鼠体内,给药一周后,观察到整个肝组织中每个位点都有超过40%的indel形成("Indel"是"insertion and deletion"的缩写,意为“插入和缺失”,指的是基因组中相对于参考序列发生的插入或缺失。通过检测这些indel,研究人员可以评估基因编辑的效率和准确性),注射后2周和4周水平相似,为了确定Pcsk9靶向AAV-SaCas9剂量对血清Pcsk9和总胆固醇水平的影响,设置了不同的AAV剂量,注射一周后,血清Pcsk9下降了95%,总胆固醇下降40%,这些情况持续了4周。
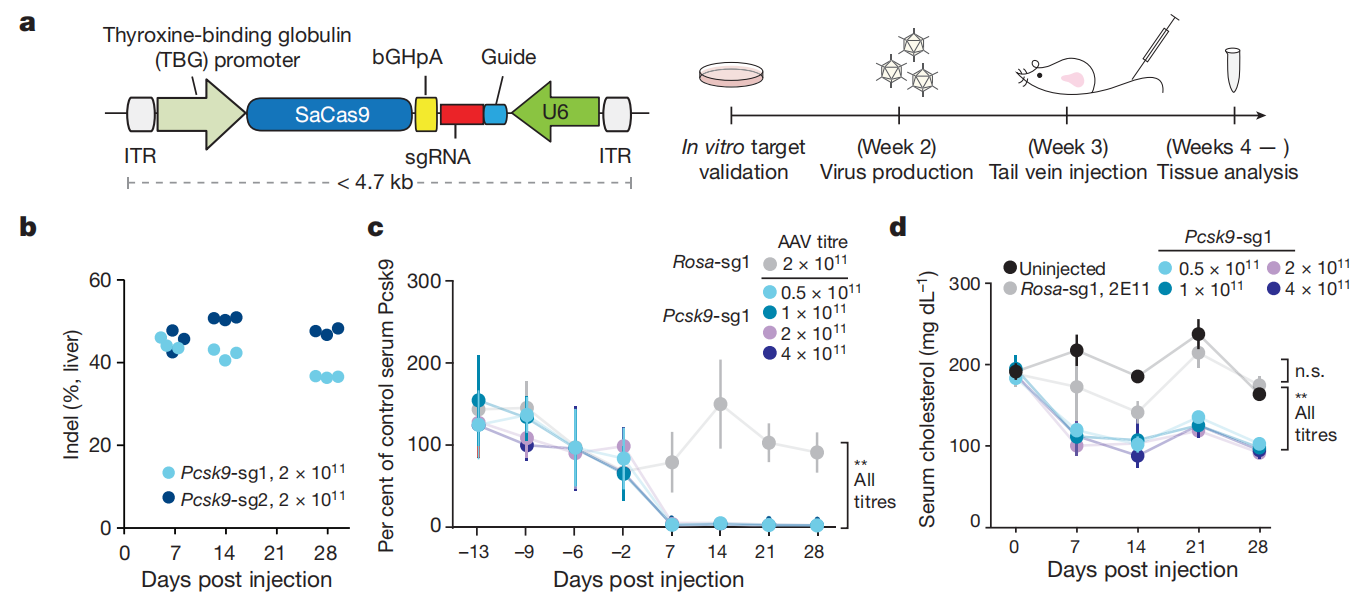
图4 AAV介导SaCas9用于肝脏基因组编辑[4]
实例3:AAV8介导St1Cas9-Hpd表达可以矫正遗传性I型酪氨酸血症模型鼠表型[5]
载体:AAV2/8-LP1B-St1Cas9 Hpd G5
启动子:LP1B
实验动物:Fah-/-新生鼠(肝损伤模型)
注射方式:眶后静脉注射,5x1010vg-1x1011vg/只,表达4周
实验结果:为了将靶向Hpd基因第13外显子的St1Cas9递送到肝脏,选择肝脏特异性血清型AAV8和特异性启动子LP1B,构建载体并包装病毒,通过眶后静脉注射的方式注射到新生小鼠体内,注射28天后,留取肝脏组织进行定量检测。
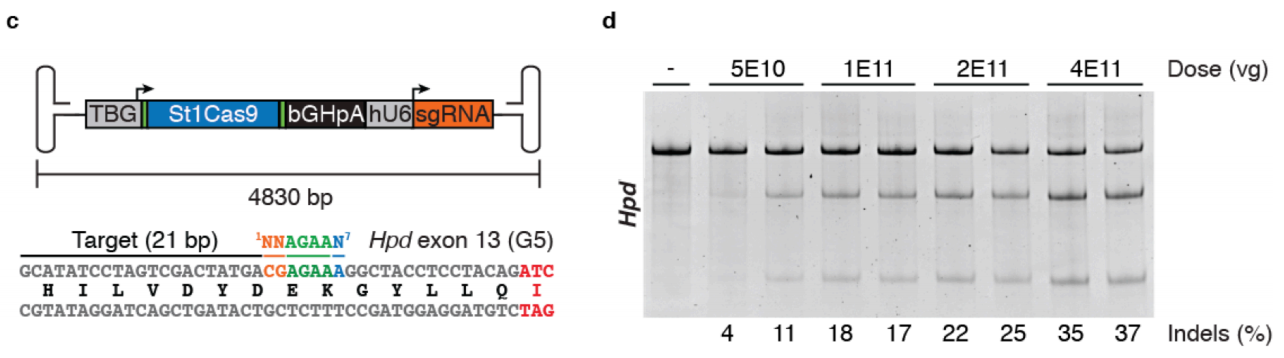
图5 AAV介导St1Cas9用于肝脏基因组编辑[5]
实例4:Let-7可减轻CCl4诱导的肝纤维化[6]
载体:AAV2/8-vec和AAV2/8-let-7a
实验动物:CCl4小鼠(肝脏纤维化模型)
注射方式:尾静脉注射,1周1次,2x1010vg/只,表达3周
实验结果:Let-7在肝纤维化患者和啮齿动物的肝脏中表达降低。鉴于新发现的let-7的机制,作者测试了let-7在两种最常用的肝纤维化小鼠模型中的潜在治疗效果,结果显示Let-7可能通过同时靶向肝细胞中的TET3/TGF-b和fas介导的通路来有效减轻CCI4诱导的肝纤维化。
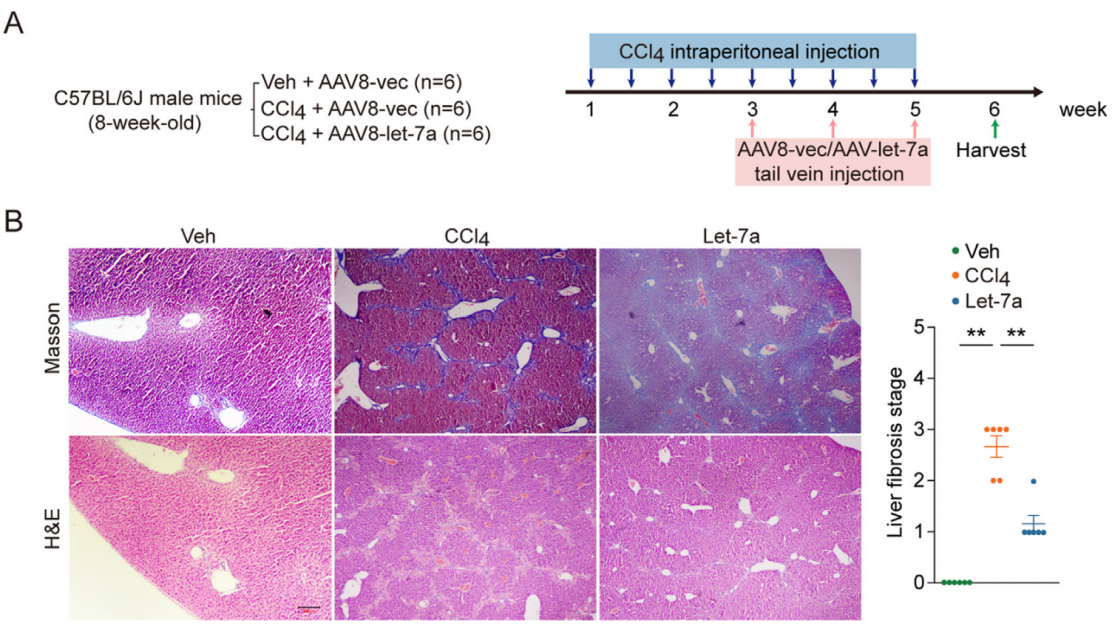
图6 Let-7对CCI4诱导的肝纤维化模型的影响[6]
布林凯斯可提供各类病毒包装定制化服务
请联系小布18971216876(微信同号)
或咨询当地销售经理获取更多信息
本文未经授权禁止转载
如有需要,可联系小编获取原文
参考文献
1、Zincarelli C, Soltys S, Rengo G, Rabinowitz JE. Analysis of AAV serotypes 1-9 mediated gene expression and tropism in mice after systemic injection. Mol Ther. 2008;16(6):1073-1080.
2、Palaschak B, Herzog RW, Markusic DM. AAV-Mediated Gene Delivery to the Liver: Overview of Current Technologies and Methods. Methods Mol Biol. 2019;1950:333-360.
3、Qin XH, Wu Z, Dong JH, et al. Liver Soluble Epoxide Hydrolase Regulates Behavioral and Cellular Effects of Chronic Stress. Cell Rep. 2019;29(10):3223-3234.
4、Ran FA, Cong L, Yan WX, et al. In vivo genome editing using Staphylococcus aureus Cas9. Nature. 2015;520(7546):186-191.
5、Agudelo D, Carter S, Velimirovic M, et al. Versatile and robust genome editing with Streptococcus thermophilus CRISPR1-Cas9. Genome Res. 2020;30(1):107-117.
6、Song J, Lv H, Liu B, et al. Let-7 suppresses liver fibrosis by inhibiting hepatocyte apoptosis and TGF-β production. Mol Metab. 2023;78:101828.