心脏篇 | AAV在基因治疗中的应用:血清型、启动子选择与注射策略
发布时间:2024-11-07 18:15:48
当前生物医学研究的关键目标之一是揭示心血管疾病的分子机制,并开发新的治疗和预防方法。为加速动物模型中的基础研究并推动其向临床应用转化,发展高效的体内基因转移技术至关重要。然而,人类基因治疗的进展仍受到现有基因传递系统的限制。理想的心脏基因治疗载体应具备以下特性:高效且特异性地将基因传递至心肌细胞,提供长期稳定的基因表达,无明显免疫反应,宿主风险低,并能够通过简便的给药方式使用,而不需依赖复杂手术。
过去,为了将病毒介导的基因传递集中于心脏,通常采用直接心肌注射或需要开胸手术的复杂冠状动脉灌注技术。然而,传统AAV血清型(如AAV2)在大多数研究中表现出较低的转导效率,并且完全基因表达可能延迟长达6周。近期研究表明,除了AAV2之外,AAV1、AAV6、AAV8和AAV9等血清型也能够有效穿越内皮屏障,转导多个器官。尤其是AAV9衣壳在体内对心脏组织展现出稳定的偏好,无论是新生小鼠还是成年小鼠中均表现出较高的转导效率。
AAV血清型AAV-1、AAV-6、AAV-8和AAV-9可以有效地穿过内皮屏障。在体心脏研究中,AAV9和AAV8血清型对心脏的感染效率要优于其他血清型,且以AAV9型居多。
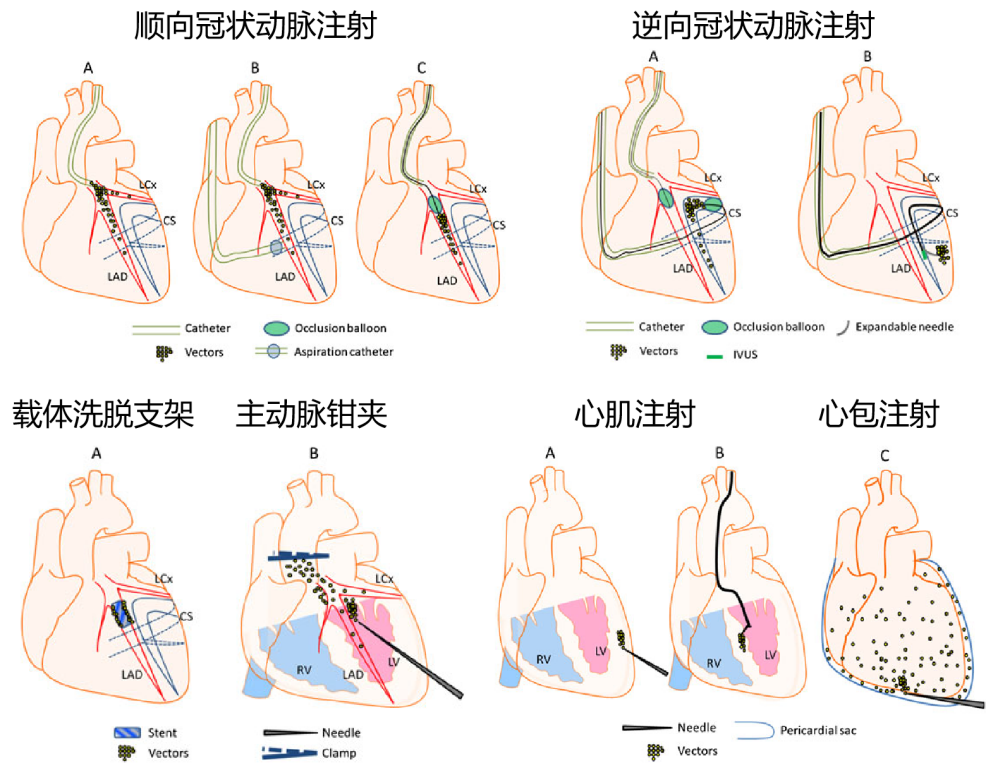
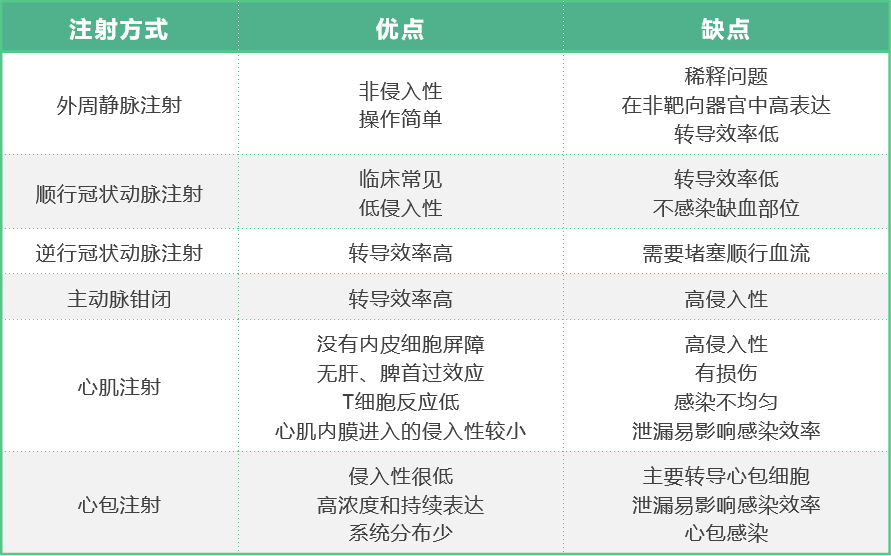
靶向心脏的基因递送有多种途径,如图2,具体选择取决于目标区域是整个心脏还是特定部位(如心肌梗死区)。若需转导整个心脏,可选择静脉注射、动脉注射或多次心肌内注射。而针对心脏的特定区域,则可以通过外部注射或直接在心内膜表面注射,以实现精准递送。
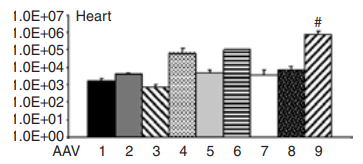
实例1:比较五种AAV血清型特异性感染心肌细胞及基因传递效率[3]
血清型:AAV1、AAV2、AAV6、AAV8、AAV9
启动子:cTNT
实验动物:C57小鼠,1周龄
注射方案:颈静脉注射,表达4周
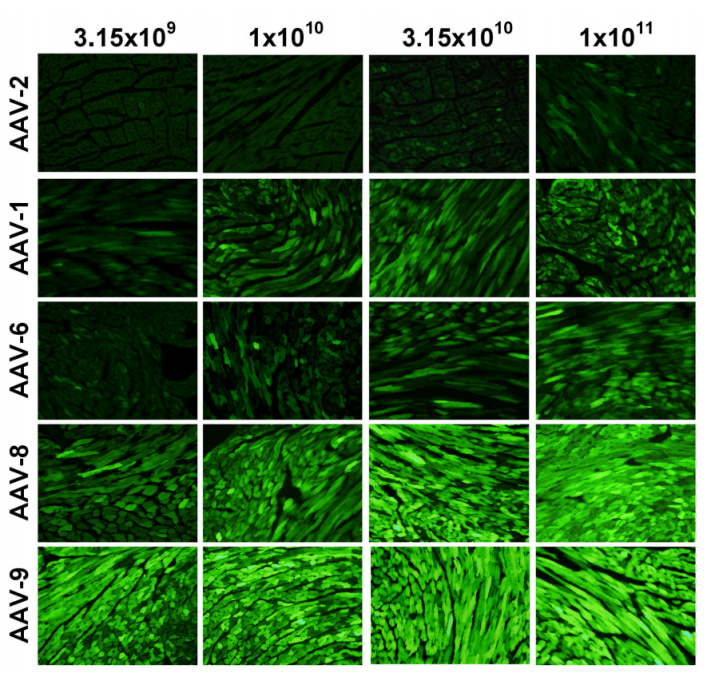
实验结果:使用荧光显微镜观察经不同血清型对应不同剂量AAV载体处理的小鼠心脏冷冻切片。AAV载体AAV-cTnT-eGFP分别包装于AAV血清型2、1、6、8和9的衣壳中,1周龄小鼠通过颈静脉注射相应剂量的病毒基因组,4周后,制备6 μm厚的心脏冷冻切片并进行荧光显微分析。结果显示,AAV9血清型相比其他血清型,能够更高效地转导心肌细胞,表现出更强的荧光信号。
图3 不同血清型对应不同剂量AAV载体感染心脏效果图[3]
血清型:AAV9
启动子:mTNT
实验动物:C57小鼠,3~4周龄
注射方案:眶后静脉注射,2×10^11 vg/只,表达3周
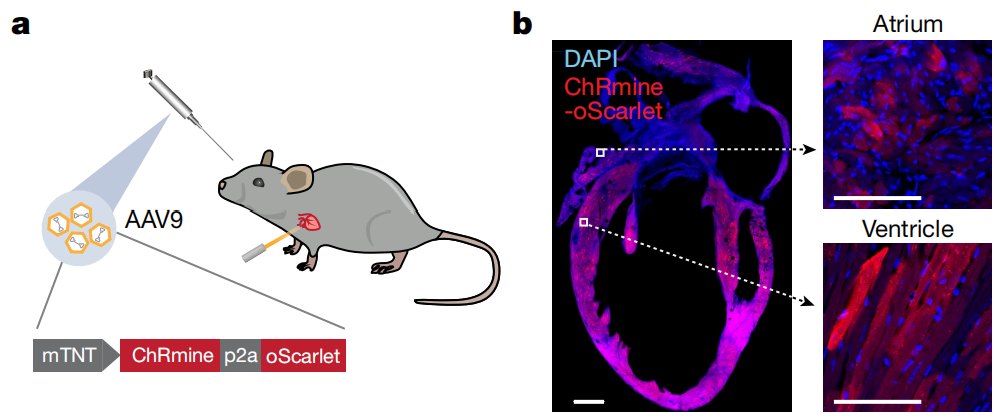
实验结果:为了实现光遗传调控心脏的节律,通过眶后静脉注射AAV9-mTNT-ChRmine-P2A-oScarlet使ChRmine在心肌细胞中特异性表达,当脉冲589nm光通过覆盖在麻醉小鼠胸腔上的完整皮肤传递时,可诱导高达900次(bpm)心律,在光照停止后立即恢复窦性节律。
图4 a眶后静脉注射AAV9-mTNT-ChRmine-P2A-oScarlet示意图;b AAV病毒在心房、心室的感染效果图[4]
实例3:缺血性心肌病大鼠Caveolin-1的心脏特异性过表达[5]
血清型:AAV9
启动子:cTNT
实验动物:大鼠
注射方案:心肌注射,表达4周
实验结果:为了实现心脏特异性Cav1过表达,大鼠心肌内注射AAV9介导表达的AAV9-cTNT-Cav1-EGFP,该病毒在心脏肌钙蛋白T(cTnT)启动子下介导表达Cav1,另外Sham对照组大鼠心肌内注射对照AAV9-cTNT-EGFP病毒,结果显示缺血性心肌病大鼠模型心脏特异性过表达Caveolin-1可改善心律失常和心脏重构。
图5 AAV-Cav1-EGFP注射后3天、1周和4周心脏切片的荧光显微图片[5]
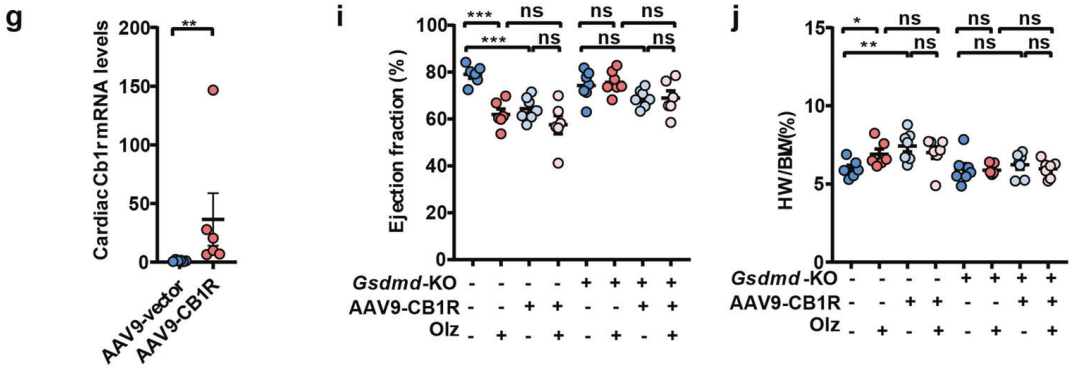
实例4:CB1R稳定的NLRP3炎性小体介导抗精神病药物的心脏毒性研究[6]
血清型:AAV9
实验动物:WT小鼠
注射方案:心脏左心室3-5个位点,2×10^11 vg/只,表达3周
实验结果:构建了AAV9介导Cb1r过表达病毒AAV9-CB1R,原位注射到小鼠心脏中。结果显示,在WT小鼠中过表达Cb1r能诱导心脏焦亡因子和促纤维化因子的表达,并显著抑制左心室功能,同时促进心脏重量的增加;然而,在Gsdmd−/−小鼠中,AAV9-CB1R单独或联合Olz(奥氮平)治疗均不再诱导上述作用。
参考文献
1、Zincarelli C, Soltys S, Rengo G, Rabinowitz JE. Analysis of AAV serotypes 1-9 mediated gene expression and tropism in mice after systemic injection. Mol Ther. 2008;16(6):1073-1080.
2、Ishikawa K, Tilemann L, Fish K, Hajjar RJ. Gene delivery methods in cardiac gene therapy. J Gene Med. 2011;13(10):566-572.
3、Prasad KM, Xu Y, Yang Z, Acton ST, French BA. Robust cardiomyocyte-specific gene expression following systemic injection of AAV: in vivo gene delivery follows a Poisson distribution. Gene Ther. 2011;18(1):43-52.
4、Hsueh B, Chen R, Jo Y, et al. Cardiogenic control of affective behavioural state. Nature. 2023;615(7951):292-299.
5、Wu SJ, He RL, Zhao L, et al. Cardiac-Specific Overexpression of Caveolin-1 in Rats With Ischemic Cardiomyopathy Improves Arrhythmogenicity and Cardiac Remodelling. Can J Cardiol. 2023;39(1):73-86.
6、Li L, Gao P, Tang X, et al. CB1R-stabilized NLRP3 inflammasome drives antipsychotics cardiotoxicity. Signal Transduct Target Ther. 2022;7(1):190.
上述产品、服务布林凯斯均可提供
如需其他元件,也可进行定制!
请联系小布18971216876(微信同号)
或咨询当地销售经理获取更多信息
本文未经授权禁止转载
如有需要,可联系小编获取原文