基因治疗作为一种突破性的医学策略,旨在通过基因替换、沉默或编辑来治疗遗传性和获得性疾病。近年来,重组腺相关病毒(rAAV)因其独特的生物学特性,已成为基因治疗领域的重要工具。rAAV具有广泛的组织趋向性、较低的致病性和免疫原性,并且能够实现长期的转基因表达,这些特性使其在临床应用中展现出巨大潜力。然而,随着rAAV基因治疗的广泛应用,高剂量病毒疗法的安全性问题逐渐受到关注,包括免疫反应、遗传毒性、肝毒性、血栓性微血管病(TMA)和神经毒性等副作用。这些挑战不仅影响了治疗的安全性和有效性,也对基因治疗的未来发展提出了新的要求。
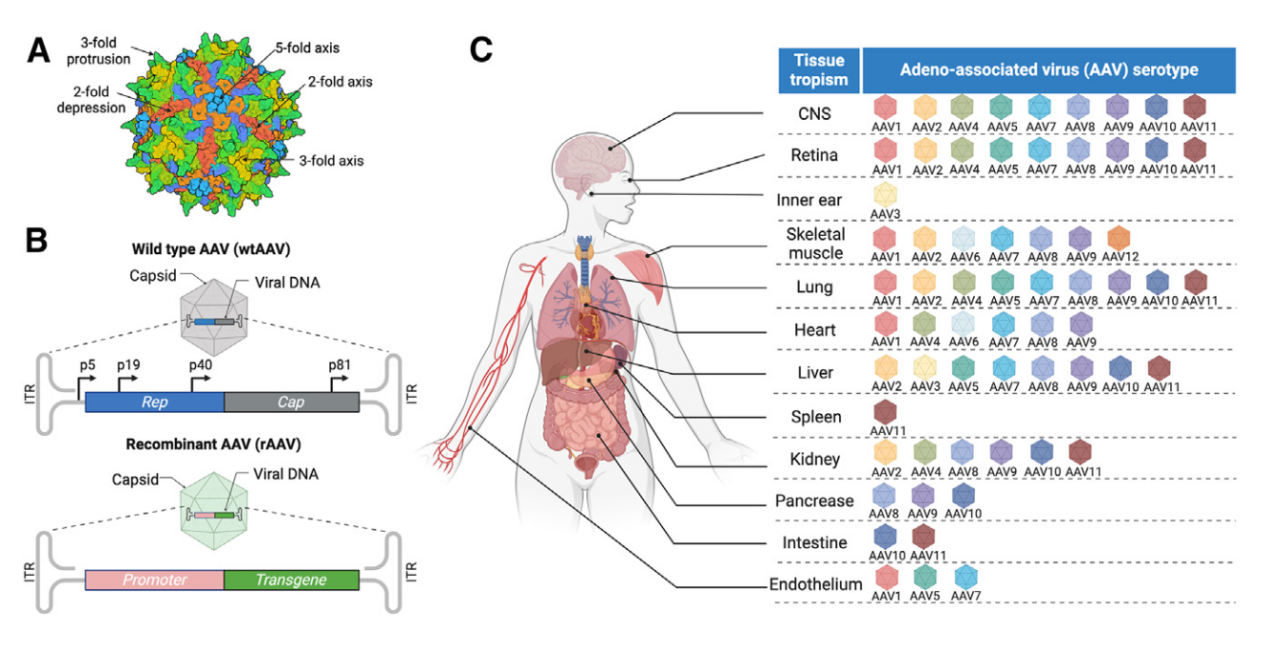
图1:AAV衣壳结构、基因组和组织趋向性的表征
基因治疗的递送方式主要分为离体(ex vivo)和体内(in vivo)两种。离体基因治疗涉及从患者体内提取细胞,进行基因修饰后再重新输入患者体内,而体内基因治疗则直接将遗传物质递送到靶组织。目前,已有14种离体和29种体内基因疗法获得FDA批准,其中基于病毒载体的基因治疗占据主导地位。在这些病毒载体中,AAV因其非致病性、低基因组整合风险和长期转基因表达能力,已成为临床试验和FDA批准应用中的首选载体。
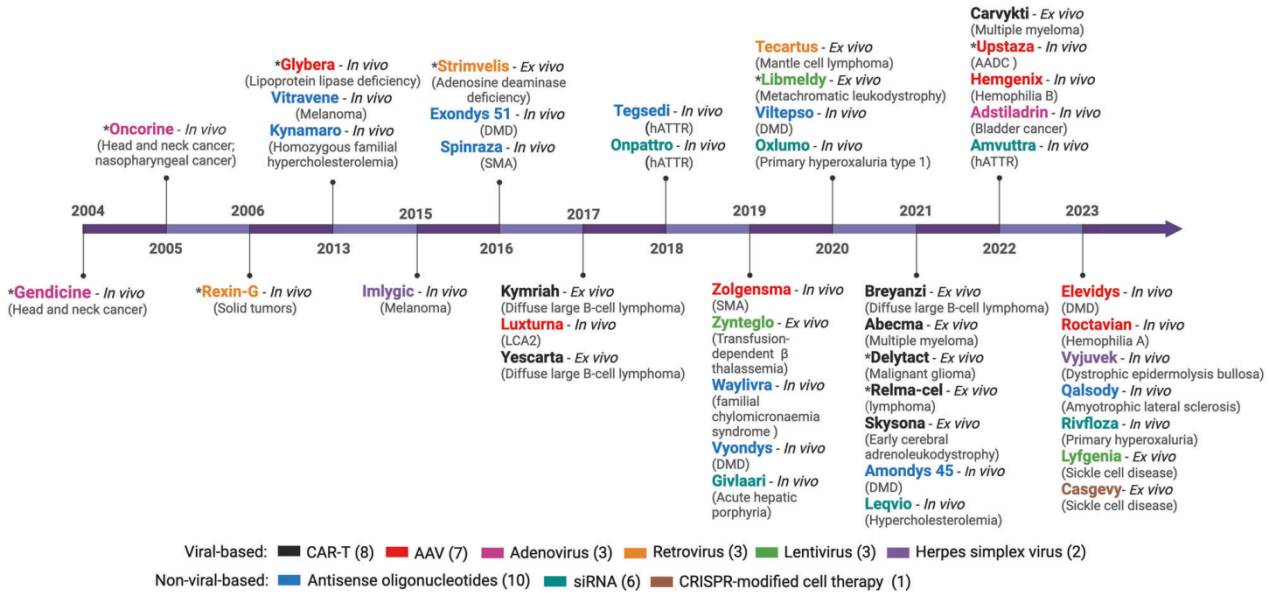
图2:获批的基因治疗产品和递送平台
在过去的几十年里,rAAV的临床应用取得了显著进展,特别是在治疗眼科、神经系统、代谢、血液、神经肌肉、心血管和肿瘤性疾病方面。这些研究不仅展示了rAAV在多种疾病中的治疗潜力,也为基因治疗的未来发展提供了重要的参考。
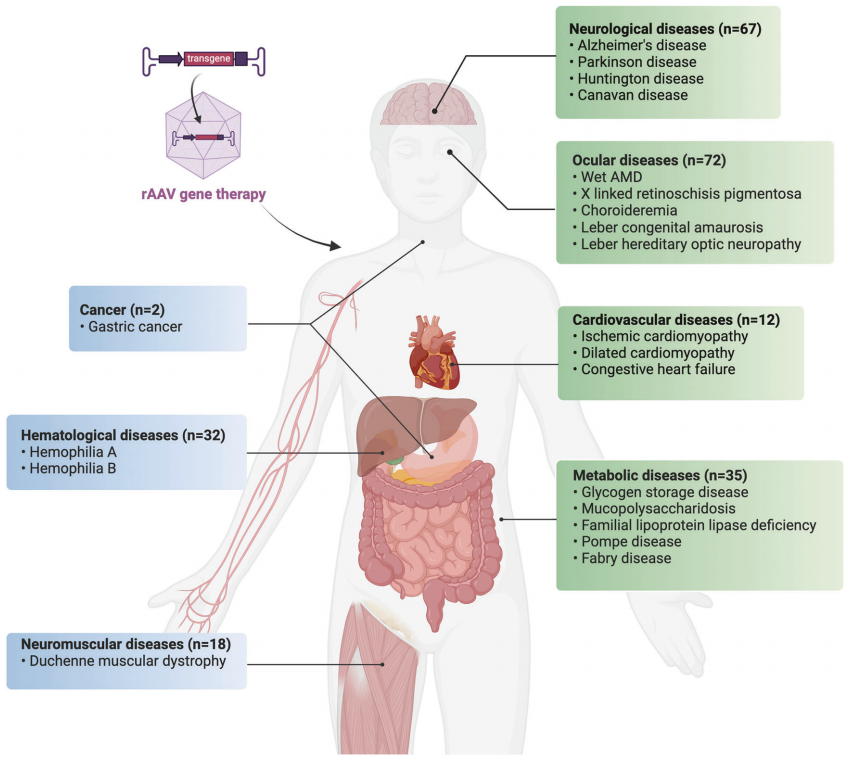
图3:rAAV在人类重大疾病中的临床应用现状
由于几个原因,眼部疾病处于rAAV基因治疗的前沿。眼睛的免疫特权状态降低了对rAAV的免疫反应。它的小体积需要低rAAV剂量。许多眼部疾病是单基因的,使它们适合于基因治疗。此外,眼睛的相对易接近性允许各种rAAV给药途径。在此,我们重点介绍几种基于rAAV的眼部基因疗法,主要针对单基因和获得性眼部疾病的治疗。
Leber先天性黑蒙2型(LCA2)
Luxturna(Voretigene neparvovec-rzyl)是首个获批的基因治疗药物,用于治疗由RPE65基因突变引起的LCA2。在一项具有里程碑意义的III期临床试验中,29名确诊为双等位基因RPE65突变的患者被随机分配接受Luxturna治疗或作为对照组不接受治疗。试验中使用多亮度移动性测试(MLMT)评估视觉功能,要求患者在不同光照强度下准确并以合适的速度导航路线。结果显示,接受Luxturna治疗的患者组在一年内的平均功能性视力显著优于对照组(平均1.8光照水平 vs 0.2光照水平)。此外,全视野敏感度阈值测试(FST)显示治疗组在第30天的改善超过100倍,并且这种改善在后续的3-4年随访研究中得以持续。基于III期试验中的积极结果,Luxturna在2017年获得了FDA的批准,成为首个获批用于治疗遗传性眼科疾病的基因疗法。
色素性视网膜炎(RP)
rAAV2-VMD2-hMERTK是一种针对视网膜色素变性(RP)的基因治疗策略,用于治疗由MERTK基因突变引起的RP。在一项I期临床试验中,6名患者接受了视网膜下注射rAAV2-VMD2-hMERTK治疗。结果显示,3名患者视力有所改善,但只有1名患者在两年内持续显示出视力增益,这提示我们需要对这种治疗方法进行更长期的观察和研究。
此外,RP的另一种基因治疗策略是EDIT-103,即在rAAV5载体上利用CRISPR/Cas9技术敲除内源性RHO基因,并插入一个经过密码子优化的RHO表达盒。在非人灵长类动物(NHPs)中进行的临床前研究中,这种基因疗法显示出改善视觉功能和视网膜结构的潜力。然而,其在人类患者中的疗效还需要进一步评估。
年龄相关性黄斑变性(AMD)
GT005(Gyroscope)是一种基于rAAV2的基因疗法,用于治疗由AMD引起的地理性萎缩。EXPLORE和HORIZON是两项II期、多中心、随机对照试验,用于评估GT005在两类地理性萎缩患者中的安全性和有效性。中期数据显示,接受视网膜下注射治疗的患者CFI水平持续增加,CFI下游蛋白减少,且治疗效果局限于眼部,未观察到CFI水平的系统性增加。
sFlt-1是一种由Flt-1(VEGF受体-1)的结构域2与人免疫球蛋白G1重链Fc片段耦合而成的嵌合VEGF抑制蛋白。在一项I期临床试验中,通过玻璃体内注射和视网膜下注射编码sFlt-1的rAAV2载体,结果发现其在患者体内安全且耐受性好,尽管个体之间的sFlt-1表达水平和治疗效果存在差异。
RGX-314(Regenxbio) 是一种利用AAV8载体递送抗VEGF单克隆抗体片段的基因疗法。I期临床试验(ASCENT)的初步结果显示,视网膜下注射治疗在患者中安全且耐受性好,治疗疗效呈剂量依赖性,一些患者在长达18个月内不需要额外的抗VEGF注射。
ADVM-022(Adverum Biotechnologies)是一种源自rAAV2衍生的工程化7m8载体递送,用于治疗新生血管性AMD。在I期临床试验(OPTIC)中,通过单次玻璃体内注射ADVM-022,在长达92周的随访期间,超过80%的患者减少了对额外抗VEGF注射的需求。
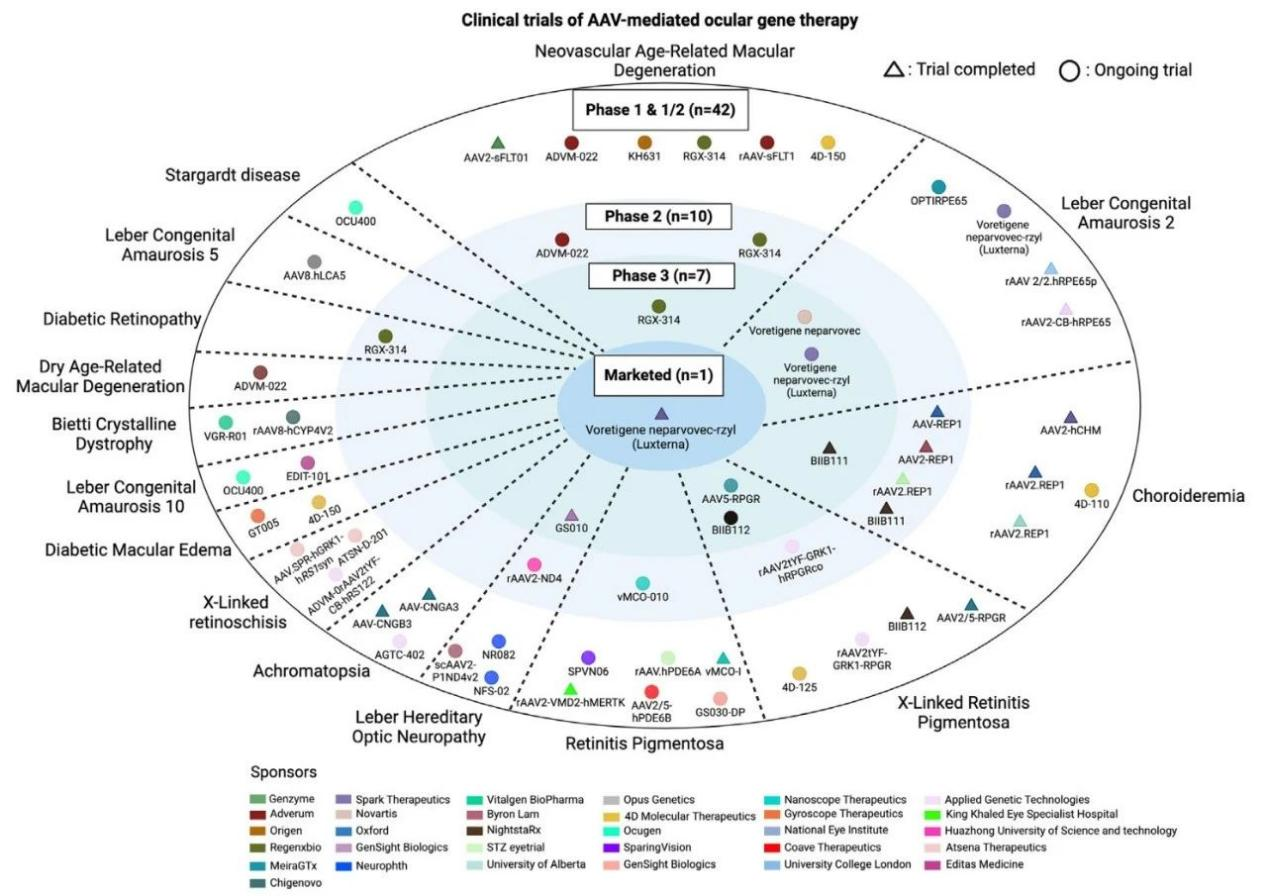
图4:基于rAAV的眼部疾病基因治疗临床试验分析
目前FDA批准的用于神经系统疾病的AAV基因疗法包括两种不同的给药方式:局部给药(如立体定向注射)和系统性给药(如静脉注射)。
芳香族L-氨基酸脱羧酶缺乏症(AADCD)
rAAV2.AADC是一种用于治疗AADCD的基因治疗策略。AADCD是一种常染色体隐性遗传病,由多巴脱羧酶基因突变引起,导致5-羟色胺和多巴胺缺乏。2012年,在台湾的4名AADCD儿童接受了双侧豆状核内注射rAAV2.AADC(1.6 × 10^11 vg)治疗,结果发现所有患者的运动评分均有所改善,主观上情绪稳定性也有所提高。一项针对10名患者的后续I/II期试验中,使用了略高的剂量(1.81 × 10^11 vg),所有患者均得到了临床运动功能改善和脑脊液(CSF)生化改善。但是,患者在输注后出现了短暂的运动障碍。
最近,台湾试验的长期随访结果报告了26名患者的显著改善,其中3名患者能够行走,而且发现治疗年龄与运动评分呈负相关,但剂量与评分无显著关联。最常见的治疗中出现的副作用(TEAE)是发热和运动障碍。除1名患者外,所有患者的运动障碍均得到缓解,其中运动障碍的严重程度和持续时间与治疗年龄呈正相关。该疗法(Eladocagene Exuparvovec)最终获得许可,并已获得欧洲药品管理局批准,适用于18个月以上的患者(Upstaza)。
脊髓性肌萎缩症(SMA)
Onasemnogene abeparvovec(Zolgensma) 是一种用于治疗SMA的基因疗法。SMA是一种常染色体隐性遗传病,由SMN1基因的功能丧失突变引起。I型SMA是最严重的类型,通常在婴儿出生后6个月内出现症状,患者往往在2岁前死亡。2017年,首批临床试验结果公布,15名患者接受了静脉注射的rAAV9表达SMN1(rAAV9.SMN1)基因疗法,结果显示,患者对呼吸机支持的需求减少,运动评分有所提升。11名患者能够不借助外力坐立数秒,并获得了语言能力。尽管该疗法具有良好的耐受性,但常见的不良反应是肝转氨酶升高,使用皮质类固醇后此反应有所缓解。2021年公布的START试验长期随访结果显示,经过最长6.2年的跟踪,患者维持了在初始试验期间获得的运动技能。更令人鼓舞的是,有两名患者达到了新的运动发展里程碑,并能在辅助下站立。在安全性方面,结果依然非常乐观,没有报告与治疗相关的不良效应(TEAEs)。
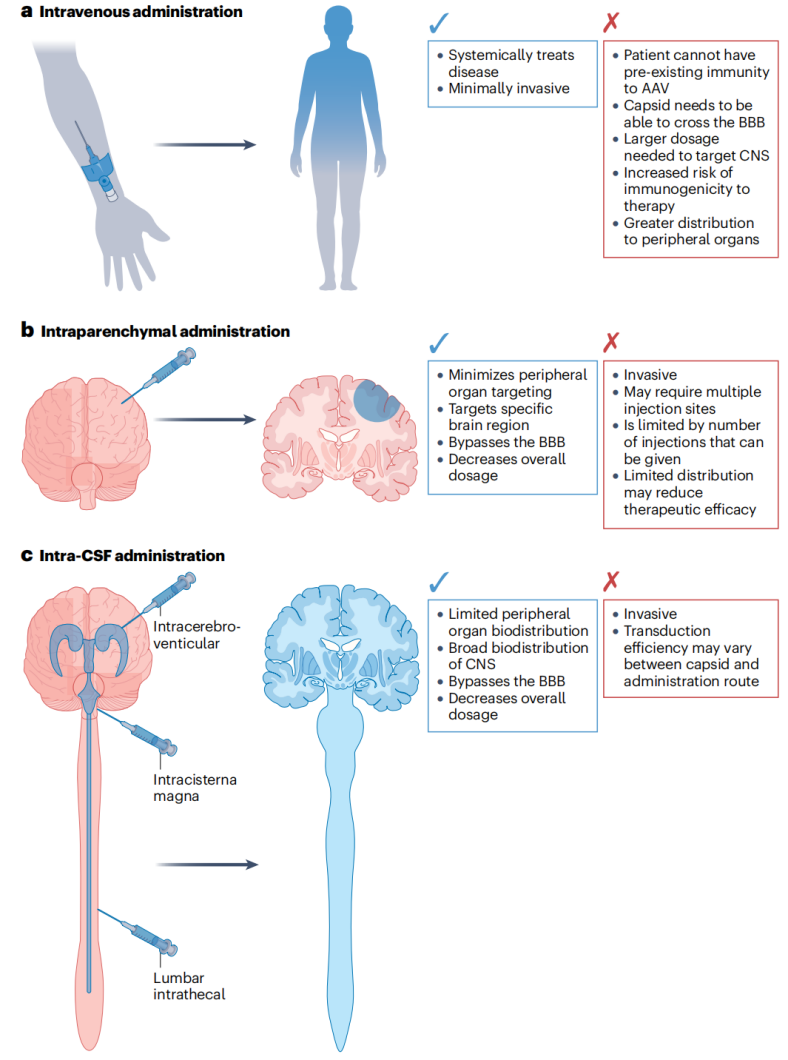
图5:CNS基因治疗的给药途径
导致代谢性疾病的遗传缺陷可能有全身性或器官特异性的表现,对载体设计和给药途径有影响(例如,以中枢神经系统为主要表现的溶酶体贮积症)。
泰-萨克斯病(TSD)和桑德霍夫病 (SD)
rAAV.rh8是一种用于治疗TSD和SD的基因治疗策略。TSD和SD由HEXA基因突变引起导致神经节苷脂积累,其中HEX由α和β(HEXA)、β和β(HEXB)或α和α(HEXS)亚基组成的二聚体,TSD和SD分别是由编码α亚基和β亚基的基因突变引起。2022年,一项针对2名TSD患者的扩展使用试验表明,通过鞘内注射两种表达α和β亚基的rAAV.rh8载体是安全的,程序和载体耐受性良好,两名患者均表现出疾病稳定的迹象。目前,加拿大和美国正在进行的两项临床试验(项目号分别是NCT04798235和NCT04669535)正在评估rAAV9的疗效。加拿大的I/II期试验利用rAAV9通过单次鞘内给药,将HEXA和HEXB转基因递送给婴儿型TSD或SD患者。相比之下,美国的试验设计为剂量递增研究,通过双侧丘脑途径和鞘内/脑池联合给药方式,探索四种不同的载体剂量。该研究使用两个rAAV.rh8载体分别递送HEXA或HEXB转基因,这些试验的结果尚未公布。
卡纳万病 (CD)
CD由ASPA基因突变引起,导致N-乙酰天门冬氨酸(NAA)在中枢神经系统和尿液中积累。目前,有两项针对CD的临床试验正在进行中,试验编号分别为NCT04833907和NCT04998396。这两项试验采用了不同的载体设计和给药方式(颅内给药与静脉输注),给药途径的不同必然导致剂量的差异。两项试验的初步数据显示出积极的治疗效果。由于这两项试验仍在进行中,目前还无法进行直接的效果比较。
非肿瘤性血液病可分为细胞性或非细胞性疾病,这意味着基因突变分别影响细胞功能(如镰状细胞病)或血液成分(如血友病)。这种区别对于基因治疗至关重要,因为它决定了靶标细胞/器官。
血友病B
rAAV5 Padua(Hemgenix)是一种用于治疗血友病B的基因治疗药物。血友病B是由凝血因子Ⅸ(FⅨ)缺乏引起,FⅨ在肝细胞中产生。2009年,研究人员发现了FIX的Padua变体,这种变体具有超生理活性。在一项I期临床试验中,患者接受了联合静脉给药促肝药rAAV8和优化密码子的hFIX转基因,FIX活性达到2-12%,且未使用免疫抑制。随后的研究中,研究人员设计了一种具有增强肝向性的新工程衣壳,并结合了密码子优化的Padua FIX变体,相应的减少剂量,FIX活性仍达到平均33.7%(范围14-81%)。此外,只有2名患者因短暂的肝酶升高接受了泼尼松龙治疗,显示出良好的安全性。基于这些结果,Hemgenix于2023年获得FDA批准,成为首个获批用于治疗血友病B的基因疗法。
血友病A
rAAV5hFVIIISQ(Roctavian)是一种用于治疗血友病A的基因治疗药物。血友病A是凝血因子VIII(FVIII)缺乏引起,FⅧ在内皮细胞中合成。在一项III期临床试验中,患者接受了单次静脉注射的rAAV5hFVIIISQ。结果显示,这种一次性治疗显著提高了FVIII活性,减少了外源性FVIII的使用,并且与常规预防性使用外源性FVIII相比,出血事件有所改善。然而,随着时间的推移,转基因表达有所下降。尽管如此,Roctavian于2023年获得FDA批准,成为首个获批用于治疗血友病A的基因疗法。
神经肌肉疾病包括影响神经元和肌肉细胞的疾病,其中肌肉萎缩症主要影响肌肉细胞。杜氏肌营养不良症(DMD)是最常见的肌营养不良症,由肌营养不良蛋白基因突变引起,会导致肌营养不良蛋白缺失或功能障碍。
rAAV.rh74.micro-dystrophin(Elevidys) 是一种用于治疗杜氏肌营养不良症(DMD)的基因治疗药物。2020年,一项I/II期试验评估了静脉注射2.0 × 10^14 vg/kg的rAAV.rh74.micro-dystrophin的安全性和疗效。结果显示,所有患者的临床和组织病理学表现均有所改善,且与治疗时的年龄和疾病严重程度相关。2023年,Elevidys获得FDA批准,成为首个获批用于治疗DMD的基因疗法。
除了基因替代疗法,另一种治疗策略是利用疾病修饰基因。2022年,一项首次人体试验治疗了两名患者(6.9岁和8.9岁)。试验采用双侧股静脉隔离肢体灌注,每条腿分别注入5.0 × 10^13和2.5 × 10^13 vg/kg剂量的rAAV.rh47,用于表达GALGT2基因。尽管检测到针对rAAV衣壳的抗体和轻度的rAAV和GALGT2蛋白特异性T细胞活性,但未报告相关的肝毒性。值得注意的是,接受较高剂量的年轻患者表现出更大的改善。其他正在进行的试验仍在进行中,但没有招募新患者,包括Solid Bioscience公司的随机I/II期试验(NCT03368742)和辉瑞公司的非随机Ib期试验(NCT03362502),这两项试验都利用rAAV9在肌肉特异性启动子的控制下表达截断的肌营养不良蛋白。
心力衰竭(HF)是一种由心室充盈或排空功能障碍引起的综合征,临床前研究表明,一种有效策略是过度表达肌浆/内质网钙转运ATP酶2(SERCA2a),该酶在心脏舒张期将钙泵入肌浆网(SR),从而改善心脏功能。
在一项Ⅰ/Ⅱ期的CUPID试验中,评估了使用rAAV1(rAAV1.SERCA2a)过表达SERCA2a的效果。Ⅰ期研究结果显示,部分患者症状改善,对治疗耐受性良好。进一步Ⅱ期研究中,共纳入25名接受治疗和14名接受安慰剂的患者,结果发现接受治疗的患者与接受安慰剂的患者相比有改善的趋势;然而,除左室舒张末期容积这项指标外,大多数结果未达到统计学差异,该研究证实了Ⅰ期观察到的良好安全性。随后CUPID Ⅱ期三年随访结果也未能显示出生存率得以改善,但非终末事件的累积分析达到了统计学差异。
rAAV抗肿瘤策略与常规抗肿瘤方案类似,基因治疗具有特定的优势,例如基因表达的调节或敲低。rAAV可以转导至分裂和非分裂的细胞,使得在异质性肿瘤组织中进行广泛的细胞靶向成为可能。这一特性可以用于向肿瘤细胞递送细胞因子转基因,以招募免疫细胞触发抗肿瘤免疫反应。
rAAV在人类中的应用比较有限,目前只有一项胃癌体外基因治疗的试验(NCT02496273)正在进行。一项概念验证研究中,通过在异种移植小鼠模型中利用rAAV介导干扰素β(IFNβ)表达可抑制结直肠癌细胞的生长。利用rAAV的可适应性衣壳,还可以提高转导效率和特异性,减轻不良影响。例如,具有Her2配体的rAAV增加了转导特异性。HSV胸苷激酶的表达可将更昔洛韦转化为有毒产物,随后该产物被整合到肿瘤DNA中诱导细胞死亡。与接受抗癌药物赫赛汀的动物组相比,这种递送方式减少了肿瘤负荷并延长了生存期。然而这种方法耗时且劳动强度大。另一种方法是筛选现有的rAAV衣壳库,通过不同给药途径中组织亲嗜性判断最佳组合。例如,已发现rAAV7和rAAV9能够高效转导至小鼠的前列腺组织。
AAV基因治疗面临的最大挑战之一是免疫反应。预先存在的中和抗体(NAbs)会显著降低rAAV的转导效率,限制了重复给药的可能性。
例如,在Luxturna和Zolgensma的临床试验中,部分患者因预先存在的NAbs而未能达到预期疗效。此外,补体激活、先天免疫和适应性免疫反应也会引发不良反应。例如,在Zolgensma的临床试验中,部分患者出现了血栓性微血管病(TMA)。为了解决这些问题,研究人员正在探索多种策略,包括免疫抑制药物的使用和工程化衣壳的设计。例如,使用类固醇、利妥昔单抗和雷帕霉素等药物可以有效抑制免疫反应。此外,通过计算机辅助设计和机器学习优化AAV衣壳,可以提高转导效率和组织特异性,从而减少免疫反应。
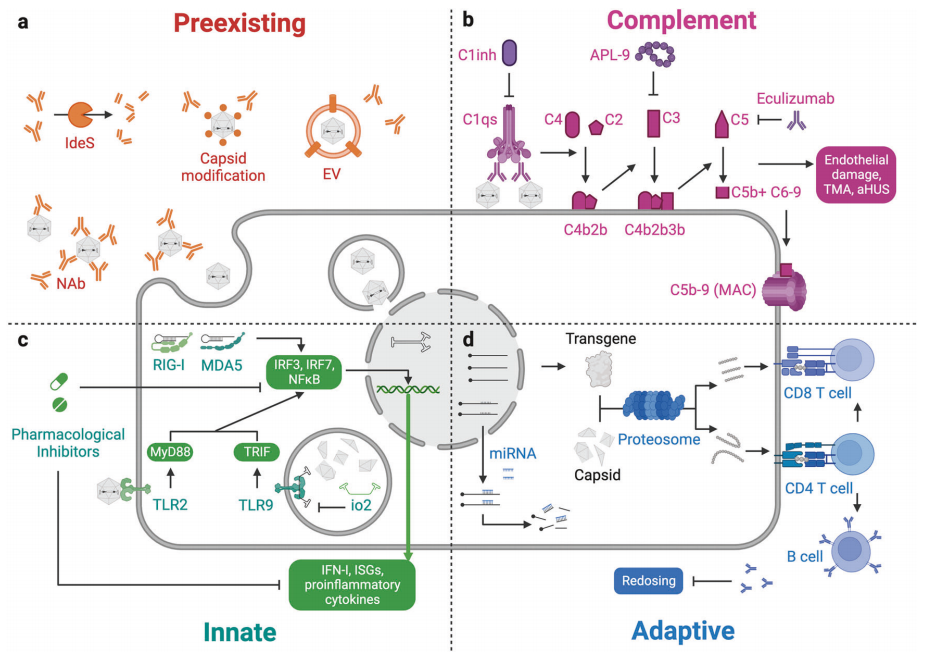
图6:基于rAAV基因治疗中的免疫反应
AAV基因治疗的长期疗效和安全性仍然是一个关键问题。例如,转基因表达的持续性、基因组整合的潜在风险以及肝毒性和神经毒性等不良反应都需要进一步研究。此外,高剂量AAV治疗可能引发血栓性微血管病(TMA)等严重不良反应。例如,在Zolgensma的临床试验中,部分患者出现了TMA。为了解决这些问题,研究人员正在优化载体设计,减少基因组整合风险,并通过长期随访研究评估安全性。
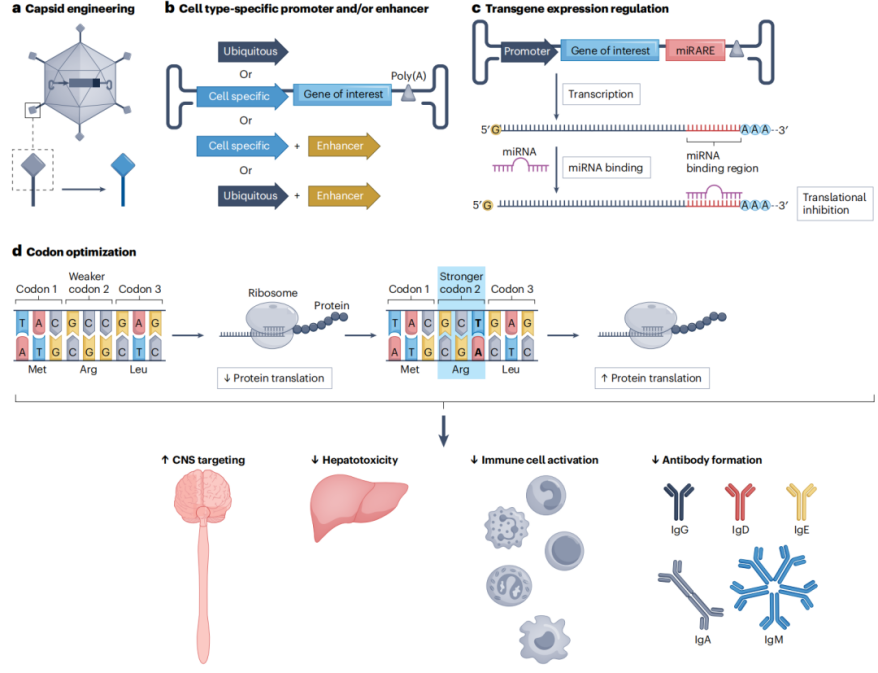
图7:减轻AAV非靶向作用和毒性
AAV基因治疗的大规模制造仍然是一个挑战,需要考虑载体的产量、纯度和成本效益。目前的研究正在探索新的制造平台,如稳定细胞系和无血清悬浮培养系统,以提高生产效率。例如,TESSA(四环素诱导的自沉默腺病毒)系统是一种新的感染基础系统,用于大规模、高产量的rAAV生产。这种系统通过四环素诱导的自我沉默机制,避免了腺病毒的复制,从而提高了rAAV的产量,同时减少了腺病毒的污染。
AAV基因治疗在多种疾病中显示出巨大的潜力,但仍面临免疫反应、长期疗效和安全性以及制造复杂性等挑战。通过优化载体设计、开发更高效的制造平台以及探索精准医疗策略,AAV基因治疗有望在未来成为治疗多种遗传性和复杂疾病的重要手段。
参考文献
[1] Wang JH, Gessler DJ, Zhan W, Gallagher TL, Gao G. Adeno-associated virus as a delivery vector for gene therapy of human diseases. Signal Transduct Target Ther. 2024 Apr 3;9(1):78. doi: 10.1038/s41392-024-01780-w. PMID: 38565561; PMCID: PMC10987683.
[2] Wang JH, Zhan W, Gallagher TL, Gao G. Recombinant adeno-associated virus as a delivery platform for ocular gene therapy: A comprehensive review. Mol Ther. 2024 Dec 4;32(12):4185-4207. doi: 10.1016/j.ymthe.2024.10.017. Epub 2024 Oct 28. PMID: 39489915; PMCID: PMC11638839.
[3] Ling Q, Herstine JA, Bradbury A, Gray SJ. AAV-based in vivo gene therapy for neurological disorders. Nat Rev Drug Discov. 2023 Oct;22(10):789-806. doi: 10.1038/s41573-023-00766-7. Epub 2023 Sep 1. PMID: 37658167.