在生物的基因组中存在一类特殊的DNA序列,它们能够作为独立的单位从基因组的一个位置移动到另一个位置,这种能够改变自身位置的DNA序列被称为转座子(transposons)。随着分子生物学的飞速发展,科学家们对转座子进行了深入研究,而且为了将遗传物质引入宿主细胞基因组还对其进行改造利用,进行基因组的功能探究、转基因生物的获得等。转座子及其相关技术成为人们解开基因组功能之谜的强有力武器。
转座子是一类在基因组上能够独立复制且移动的DNA序列[1],也被称为“跳跃基因”。根据其转座机制,目前转座子主要分为三大类:
I型转座子(Class I elements,反转座子):也叫反转录转座子(retrotransposons),通过“复制-粘贴”机制进行,先转录为mRNA,随后通过反转录酶将RNA转录成cDNA,最后在整合酶的作用下将这段cDNA整合到基因组的新位置。
II型转座子(Class II elements,DNA转座子):也叫DNA转座子(DNA transposons),通过“剪切-粘贴”机制进行,转座酶识别转座子两端的末端重复序列(ITRs),将转座子从原来的位置解离下来,再重新整合基因组上。转座子移出后产生的DNA双链断裂(DSB)可通过宿主细胞的非同源末端连接(NHEJ)或同源重组(HR)等修复机制进行修复,此过程可能导致插入/缺失突变等基因组结构变异。目前在脊椎动物中应用最多的三大主要转座子:PiggyBac(PB)、Sleeping Beauty(SB)和Tol2各具特点,这些系统在基因过表达和基因治疗载体开发等领域具有重要应用价值。
Helitron转座子:通过滚环(rolling circle)复制的方式进行转座,通常插入AT-rich区域的AT靶位点。
Tol2转座子是一种II型转座子,最初从硬骨鱼青鳉鱼(Oryzias latipes)中分离得到。它通过“剪切-粘贴”机制将目的基因插入宿主基因组中,并在每个插入位点产生一个8 bp的重复序列,因在鱼类模型中的活性很高,历史上一直是创建斑马鱼品系的首选系统。
辅助质粒或转座酶mRNA:编码Tol2转座酶。

图1 Tol2转座酶质粒结构示意图
转座子质粒:包含两个反向末端重复序列(ITRs)和转座区域,目的基因克隆在该区域。
当辅助质粒和转座子质粒共转染靶细胞时,转座酶识别ITRs,将转座区域插入宿主基因组。

图2 转座子质粒结构示意图
构建转座子载体:将目标基因插入到Tol2转座子载体中,构建成重组转座子。
转座酶表达:将Tol2转座酶与重组转座子共同导入宿主细胞。
转座发生:Tol2转座酶识别重组转座子两端的反向重复序列,将其从载体上切割下来,并插入到宿主基因组中。
基因表达:插入到基因组中的目标基因在宿主细胞中稳定表达,实现基因过表达。
承载容量大:Tol2转座子可以承载高达11 kb的外源基因片段,满足多种基因过表达的需求。
高效整合:技术简单,利用质粒转染或者电转即可将外源基因高效地整合到宿主基因组中。实现外源基因在宿主细胞中的长期稳定表达,适合用于研究基因的长效调控机制。
插入位点无偏好性:Tol2转座子在宿主基因组中随机插入,无明显碱基偏好性。
宿主范围广:Tol2转座子可以在多种脊椎动物细胞中发挥作用,包括哺乳动物、鱼类、鸟类等。
操作相对简便:利用质粒转染(非病毒转导)即可将目的基因永久整合到宿主基因组中,相比一些病毒载体系统,不需要复杂的病毒包装过程。
筛选时间短:通过引入抗性基因(如新霉素抗性基因),可以快速筛选出稳定转染的细胞。
潜在的插入突变风险:由于其整合位点的随机性,可能会插入到宿主基因组的关键区域,导致基因突变或调控异常。
载体容量有限:尽管Tol2转座子能够携带较大的外源DNA片段,但其载体容量仍有一定限制,对于一些复杂的基因表达系统可能不够用。
依赖转染效率:转座酶和目的基因是单独的骨架载体,需要共转染靶细胞,其效率依赖于细胞的质粒转染效率,对于原代细胞、难转染的细胞等,转染效率低会影响稳转细胞系的构建。
潜在的细胞毒性:转座过程可能会对细胞产生一定的影响,如引起细胞应激反应、基因突变等,在某些情况下可能导致细胞生长异常、凋亡或其他不良表型,影响细胞的正常生理功能和后续实验结果。
需要筛选鉴定:由于插入的随机性和不确定性,可能会产生多种不同的整合模式和表达水平的细胞克隆,需要进行大量的筛选和鉴定工作,才能获得理想的稳转细胞系。
Tol2转座子系统在基因功能研究、基因过表达细胞系构建、基因治疗以及转基因动物模型构建等领域具有广泛的应用潜力。
示例:
2018年,北大-清华生命科学联合中心李毓龙研究组于Cell在线发表的“A genetically-encoded fluorescent sensor enables rapid and specific detection of dopamine in flies, fish, and mice”的一文中[2],成功开发了新型、可基因编码的多巴胺荧光探针DA1h和DA1m,并将其应用在果蝇、斑马鱼和小鼠中检测内源多巴胺动态变化。在实验中,研究人员利用Tol2转座子系统将荧光探针DA1m高效整合到斑马鱼基因组中,构建了DA1m转基因斑马鱼模型,实验证明长时间表达该探针对模式生物的生长状态无明显影响,且可以检测到化学遗传激活和视觉刺激引起的多巴胺释放。同时通过转染、病毒注射(AAV)等手段,将探针表达在细胞、小鼠脑片或者活体果蝇、小鼠中均证实了这一结论。
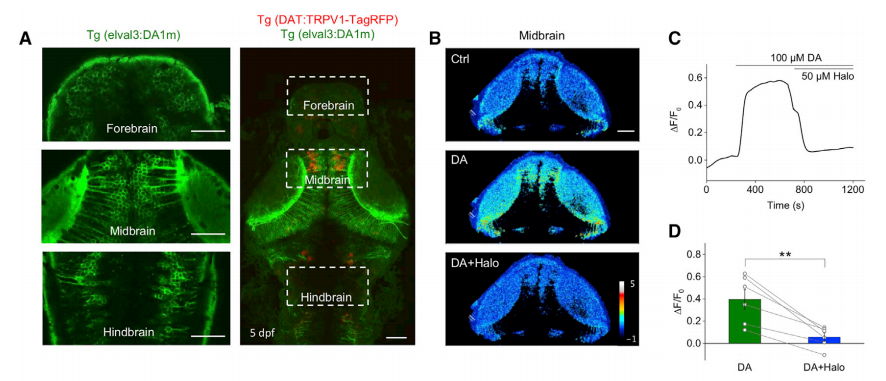
图3 基于Tol2转座子系统构建DA1m转基因斑马鱼品系
示例:
2010年日本国立遗传学研究所学者发表的A simple and highly efficient transgenesis method in mice with the Tol2 transposon system and cytoplasmic microinjection一篇文章中[3],介绍了一种基于Tol2转座子系统的新型转基因小鼠制备方法——Tol2介导的细胞质注射法(Tol2:CI),并详细探讨了其在提高转基因效率和构建小鼠模型中的作用。Tol2转座子系统通过转座酶识别末端重复序列(ITRs),将外源基因高效插入基因组中。文章通过设计三种实验条件:原核注射(PNI)、Tol2原核+细胞质注射(Tol2:PNI+CI)和Tol2细胞质注射(Tol2:CI),表明Tol2:CI方法的总转基因效率可达20%以上,远高于将质粒DNA注入受精卵的原核这一传统转基因方法(效率约2%~5%)。且细胞质注射对胚胎损伤小,存活率高,且高浓度的DNA和mRNA在细胞质注射中表现出更高的整合频率。Tol2系统不仅适用于斑马鱼等模式生物,也适用于小鼠等哺乳动物。通过Tol2:CI方法获得的转基因小鼠能够正确表达外源基因,并且这些基因能够通过生殖系传递给下一代。Tol2系统在构建转基因小鼠模型中展现了高效、稳定和易于操作的特点,为遗传学研究和功能基因组学提供了新的技术手段。
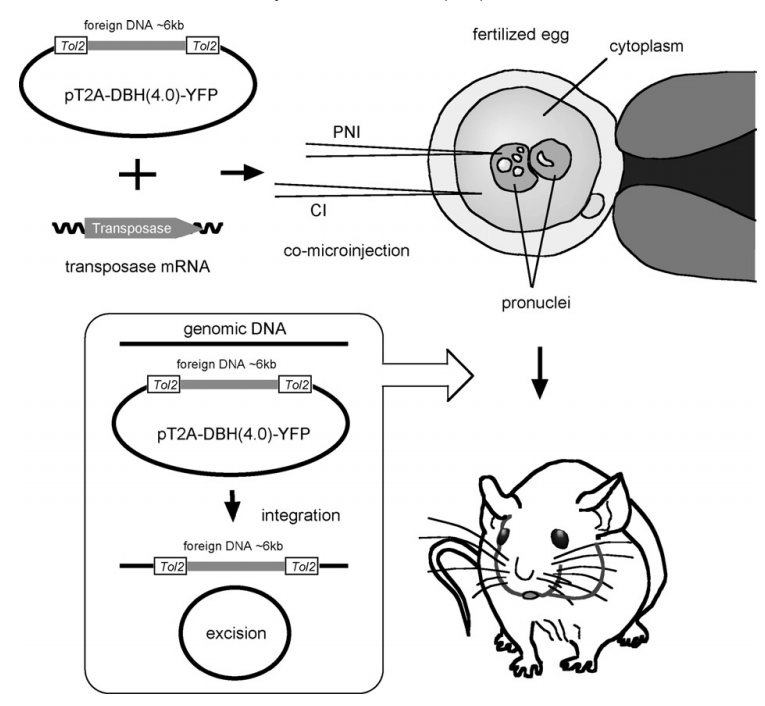
图4 基于Tol2转座子系统构建转基因小鼠模型示意图(PNI:原核注射;CI:胞质注射)
示例:
蛋白尿是肾脏功能障碍的重要标志,通常通过尿液中的蛋白质含量来评估,是肾脏疾病的一个关键临床指标。2022年曼彻斯特大学Rachel Lennon团队在线发表的A novel nanoluciferase transgenic reporter to measure proteinuria in zebrafish一文中,研究人员利用Tol2系统构建了稳定表达NL-D3的转基因斑马鱼品系,可以通过荧光光度计检测胚胎培养液中的发光强度来量化蛋白尿水平[4]。在文章实验中,研究人员通过敲低与肾脏疾病相关的基因和使用化学物质处理斑马鱼胚胎,成功诱导了蛋白尿,并通过NL-D3报告系统检测到了蛋白尿的增加。此外,研究人员还结合CRISPR-Cas9技术敲低Col4a3和Col4a4基因,模拟了Alport综合征的病理特征,验证了NL-D3系统在药物筛选中的潜力。总之,Tol2转座子系统在该文章研究中发挥了关键作用,使得NL-D3报告基因能够稳定整合到斑马鱼基因组中,并在肝脏中特异性表达,为肾脏功能障碍的重要标志物蛋白尿的检测提供了可靠的工具。
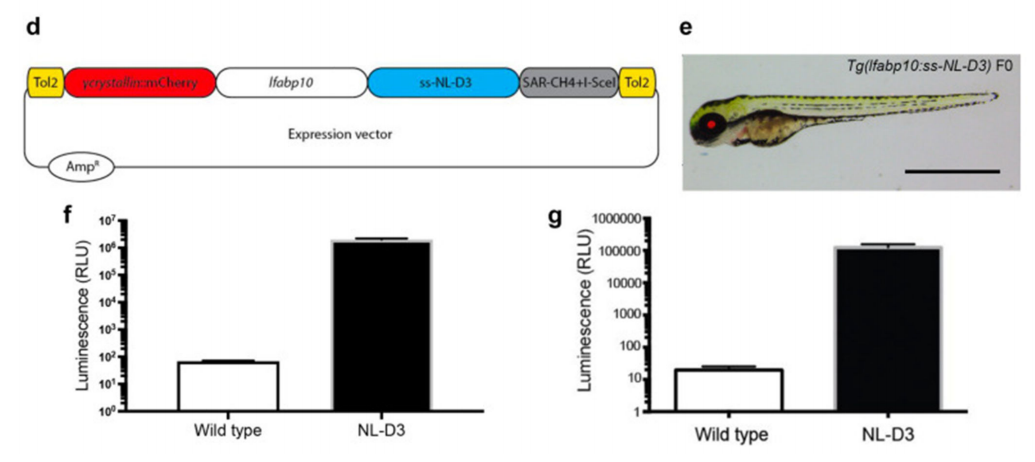
图5 基于Tol2转座子系统构建NL-D3转基因斑马鱼品系
在深入了解 Tol2 转座子后,你是否对基因组中的其他 “跳跃者” 也充满好奇呢?转座子家族成员众多,各有独特的转座机制和应用优势。除了 Tol2 转座子,像 PiggyBac、Sleeping Beauty 等转座子在基因工程领域同样发挥着重要作用。后续我们将陆续推出这些转座子的详细介绍,深挖其原理、应用与优势。欢迎持续关注本系列内容,一起探寻转座子的更多奥秘!
Tol2转座子系统因其高效性和灵活性,成为基因编辑和基因治疗领域的重要工具。布林凯斯现可提供Tol2转座子系统相关基因过表达服务,为您提供从载体构建、细胞转染到稳定细胞系筛选的一站式服务。欢迎各位科研工作者咨询洽谈!
参考文献:
[1]Wells, J. N. & Feschotte, C. A Field Guide to Eukaryotic Transposable Elements.Annu. Rev. Genet.54, 539–561 (2020).
[2]Sun F, Zeng J, Jing M, Zhou J, Feng J, Owen SF, Luo Y, Li F, Wang H, Yamaguchi T, Yong Z, Gao Y, Peng W, Wang L, Zhang S, Du J, Lin D, Xu M, Kreitzer AC, Cui G, Li Y. A Genetically Encoded Fluorescent Sensor Enables Rapid and Specific Detection of Dopamine in Flies, Fish, and Mice. Cell. 2018 Jul 12;174(2):481-496.e19.
[3]Sumiyama K, Kawakami K, Yagita K. A simple and highly efficient transgenesis method in mice with the Tol2 transposon system and cytoplasmic microinjection. Genomics. 2010 May;95(5):306-11.
[4]Naylor RW, Lemarie E, Jackson-Crawford A, Davenport JB, Mironov A, Lowe M, Lennon R. A novel nanoluciferase transgenic reporter measures proteinuria in zebrafish. Kidney Int. 2022 Oct;102(4):815-827.
往期 REVIEWS 精彩