胶质母细胞瘤(Glioblastoma,GBM)是一种致命的脑癌,具有高度侵袭性和异质性。近年来的研究表明,GBM细胞能够被神经元突触支配,从而推动肿瘤进展。然而,GBM细胞整合到大脑神经环路中的程度尚不清楚。狂犬病毒(RV)介导的逆向跨单突触追踪系统是一种经典的神经科学工具,可用于系统地映射特定目标细胞(如GBM细胞)的突触输入。该系统的主要优势在于其高特异性和高效性,使研究人员能够精确地追踪到与目标细胞形成突触连接的上游神经元。

为了系统地绘制胶质母细胞瘤类器官(GBM organoids ,GBOs)移植到成年小鼠大脑后全脑神经元投射的图谱,作者采用了RV逆向跨单突触示踪技术。通过逆转录病毒转导培养的GBOs,表达DsRed报告基因(R)、EnvA受体TVA(T)和狂犬病毒糖蛋白(G)(命名为RTG)。被G蛋白缺失的EnvA假型狂犬病毒(ΔG狂犬病毒)感染的起始GBO细胞(表达GFP报告基因)可以通过DsRed和GFP的共表达进行标记,将RV逆向传播到它们的前突触神经元,这些神经元可以通过单独的GFP表达来识别。由于这些一级前突触神经元不表达G蛋白,ΔG狂犬病毒无法进一步传播,从而保证了这种追踪的单突触特性。被RTG逆转录病毒感染的GBOs能够高效地被ΔG狂犬病毒感染,而没有RTG表达的对照GBOs则不能被ΔG狂犬病毒感染。
作者将来自三名患者的GBOs预先感染ΔG狂犬病毒,然后移植到成年免疫缺陷小鼠大脑的后内侧皮质(RSP)中(图1b)。观察到从移植后第3天开始,局部(同侧皮质、海马)和远距离(同侧丘脑、对侧皮质、基底前脑)投射的神经元中出现了GFP表达,并且到移植后第10天时,在来自三名患者的GBOs中,大约有10³ - 10⁴个神经元被广泛标记(图1c-d)。由于狂犬病毒至少需要2天时间进行复制、逆向跨突触传播并充分标记细胞,因此早在移植后第3天就检测到GFP⁺神经元,这表明胶质母细胞瘤(GBM)细胞在体内与神经环路整合的速度极为迅速。
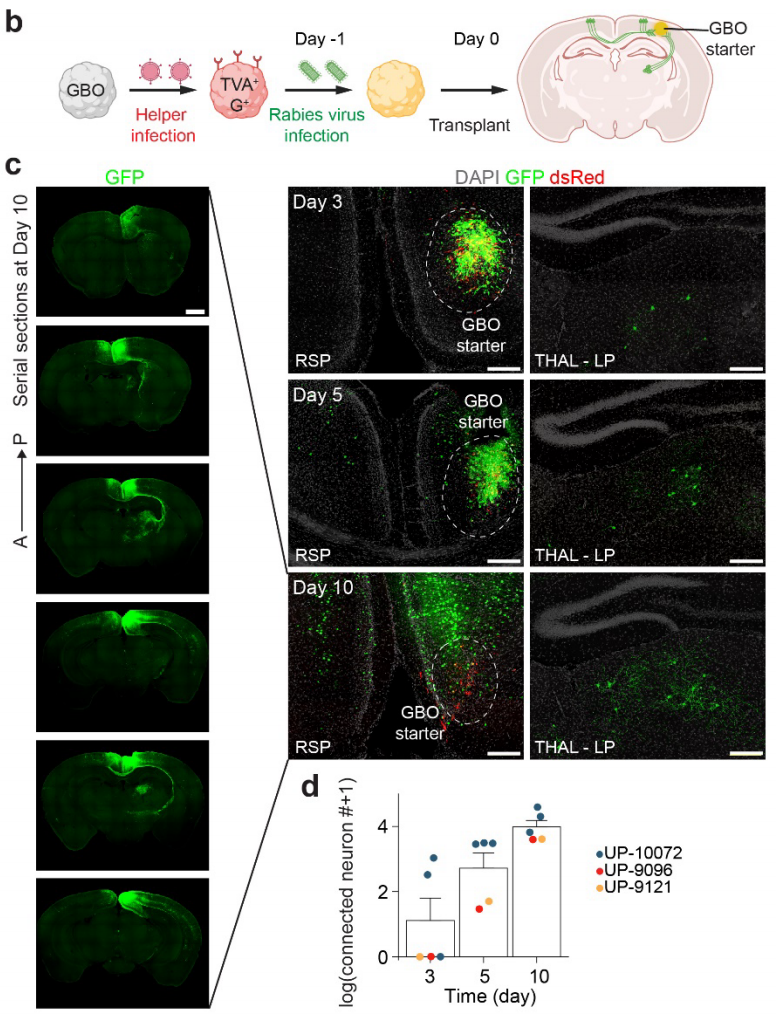
图1 成年小鼠移植人GBM细胞在大脑中的快速神经元回路整合
作者还进行了对照实验,以确保方法的可靠性。首先,构建了一个对照辅助逆转录病毒载体,通过删除狂犬病毒G蛋白编码序列(RT),使得被RT逆转录病毒感染的GBO起始细胞可以通过TVA被ΔG狂犬病毒感染,但无法将其传播到上游神经元(图2e)。正如预期的那样,在移植后,检测到了DsRed+GFP+的起始GBM细胞,但没有检测到GFP+的小鼠神经元(图2f)。其次,为了排除由于预感染GBM细胞泄漏狂犬病毒而导致的非特异性标记的可能性,作者在移植前诱导起始GBO细胞裂解,以提取具有感染能力的狂犬病毒。在相同的时间窗口内只发现了极少数GFP+神经元(图2g)。第三,对胶质细胞标志物GFAP进行免疫染色,并未在RSP注射点附近或远处发现与GFP共标记的情况,这与狂犬病毒的跨突触传播特性一致(图2h)。综上所述,这种依赖G蛋白的单突触狂犬病毒示踪系统揭示了移植到成年小鼠大脑中的人类GBM细胞与神经元之间的快速且稳健的神经连接。
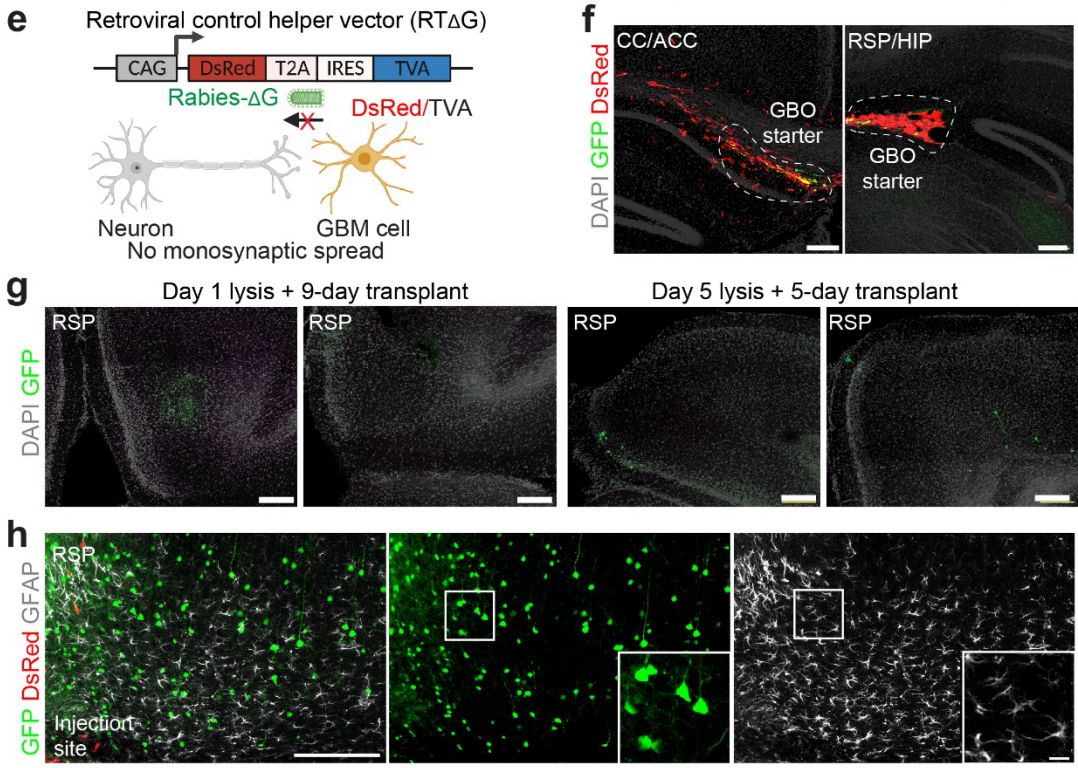
图2 RV在GBOs中传播的选择性和特异性
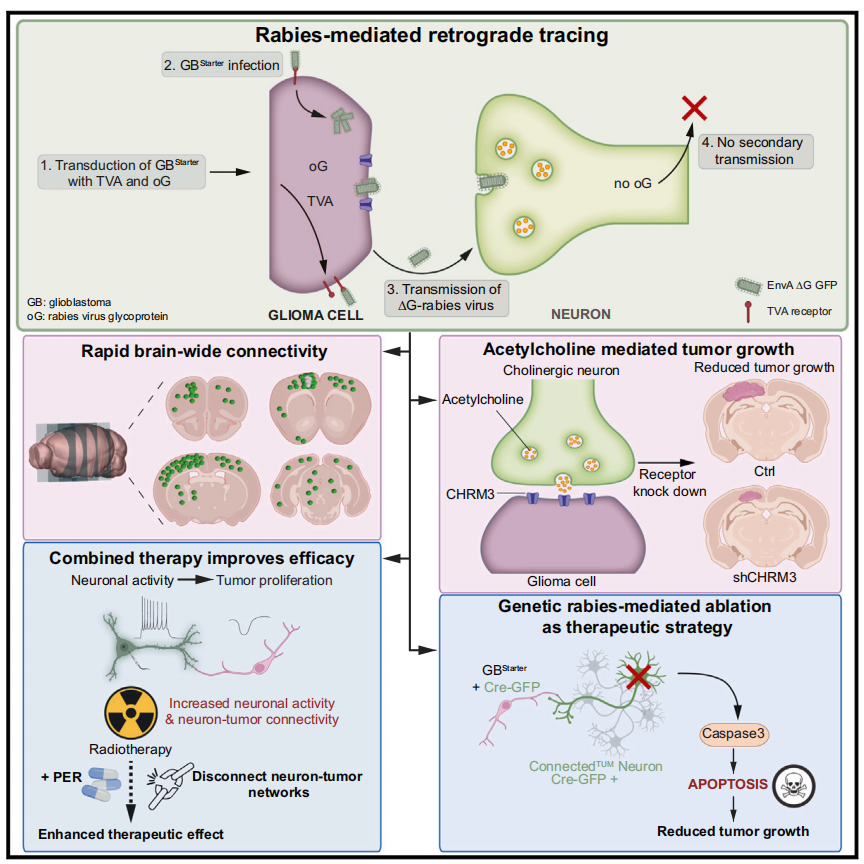
2024年12月6日,德国海德堡大学医院的Varun Venkataramani 团队在Cell上发表题为“Characterizing and targeting glioblastoma neuron-tumor networks with retrograde tracing”的文章。该文章利用狂犬病毒RV(Rabies)逆向示踪技术,研究了神经元-胶质母细胞瘤网络,揭示了神经元活动促进肿瘤侵袭的机制,并提出了通过干扰该网络来抑制胶质母细胞瘤进展的治疗策略。
基于RV的逆向跨单示踪系统,对神经元-肿瘤网络进行了表征,使用了患者来源的胶质母细胞瘤球体培养物(图3A)。首先,用慢病毒rLV-TVA-2A-mCherry-2A-oG稳定转导14种患者来源的胶质母细胞瘤球体(图3B),使其表达EnvA受体(TVA,A亚群禽白血病病毒的细胞受体),介导RV的进入;表达RV糖蛋白(oG),驱动病毒的复制与传播;并表达胞质荧光蛋白mCherry,用于细胞标记。其次,通过荧光激活细胞分选(FACS)技术筛选出表达TVA和oG的胶质母细胞瘤细胞。随后,这些细胞被转导了两种EnvA假型的G蛋白缺失(ΔG)RV株即SAD-B19ΔG-eGFP(EnVA) 或CVS-N2cΔG-eGFP(EnVA),这些病毒株表达胞质荧光蛋白GFP,只能感染含有TVA受体的胶质母细胞瘤细胞。RV进入胶质母细胞瘤起始细胞(GBStarter)并与G蛋白进行反式互补时,会通过跨单突触、逆向传播来标记与肿瘤相连的神经元(肿瘤连接)。肿瘤连接神经元可以通过表达GFP来识别,而患者来源的GBStarter细胞则表达mCherry和GFP。此外,由于肿瘤连接神经元不表达oG,因此无法进一步传播,确保了这种标记直接连接的神经元-肿瘤网络的方法具有高度特异性(图3A)。
对GBStarter球体进行荧光激活细胞分选(FACS)能够在移植这些肿瘤细胞之前实现对所有肿瘤细胞的直接、密集标记。相比之下,在RV转导之前植入胶质母细胞瘤细胞,并使用梯度稀释的RV进行转导,可以实现稀疏标记,以追踪单个胶质母细胞瘤细胞的神经元连接组。此外,通过遗传修饰使RV表达功能性蛋白(如Cre重组酶),可以精确操纵肿瘤连接神经元,以研究其对胶质母细胞瘤生物学的影响(图3A)。
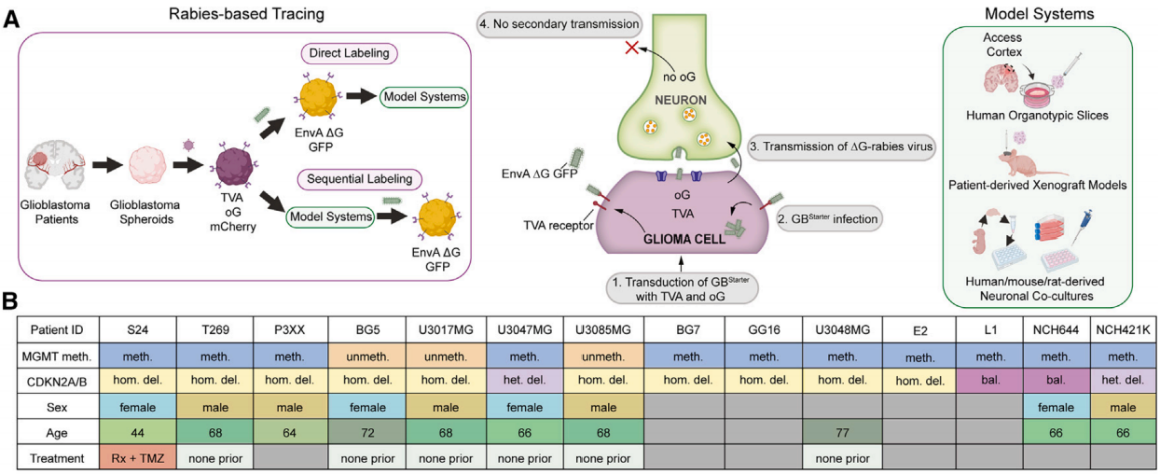
图3 患者源性胶质母细胞瘤(GB)模型的逆行追踪工作流程
为了建立一个全人组织模型系统,作者使用了手术切除的人类大脑皮层组织进行类器官切片培养(图4C),并移植了GBStarter细胞以标记人类肿瘤连接神经元。这一模型系统还通过患者来源的异种移植(PDX)和神经元共培养模型进行了补充(图4C–4I)。具体而言,在GBStarter细胞存在的情况下,逆向追踪技术能够选择性地标记所有患者来源模型系统中的肿瘤连接神经元(图4C–4G)。这种方法允许对肿瘤连接神经元进行超微结构表征,包括不同类别的树突棘,并采用高分辨率和超分辨率光学显微镜技术(图4C,4E)。重要的是,肿瘤连接神经元保持了其特征性的电生理学特性(图4J,4K)。在共培养或PDX模型中使用裂解的GBStarter细胞进行标记时,几乎没有发生非特异性标记;当将神经元-GBStarter共培养的培养基添加到神经元培养中时,也没有发生标记。这表明标记过程主要依赖于完整的GBStarter细胞和狂犬病毒的特异性感染。最后,作者评估了两种狂犬病毒株CVS-N2cΔG-eGFP(EnvA)和SAD-B19ΔG-eGFP(EnvA)的毒性,在观察期内没有观察到狂犬病毒感染的肿瘤细胞或神经元细胞死亡增加。
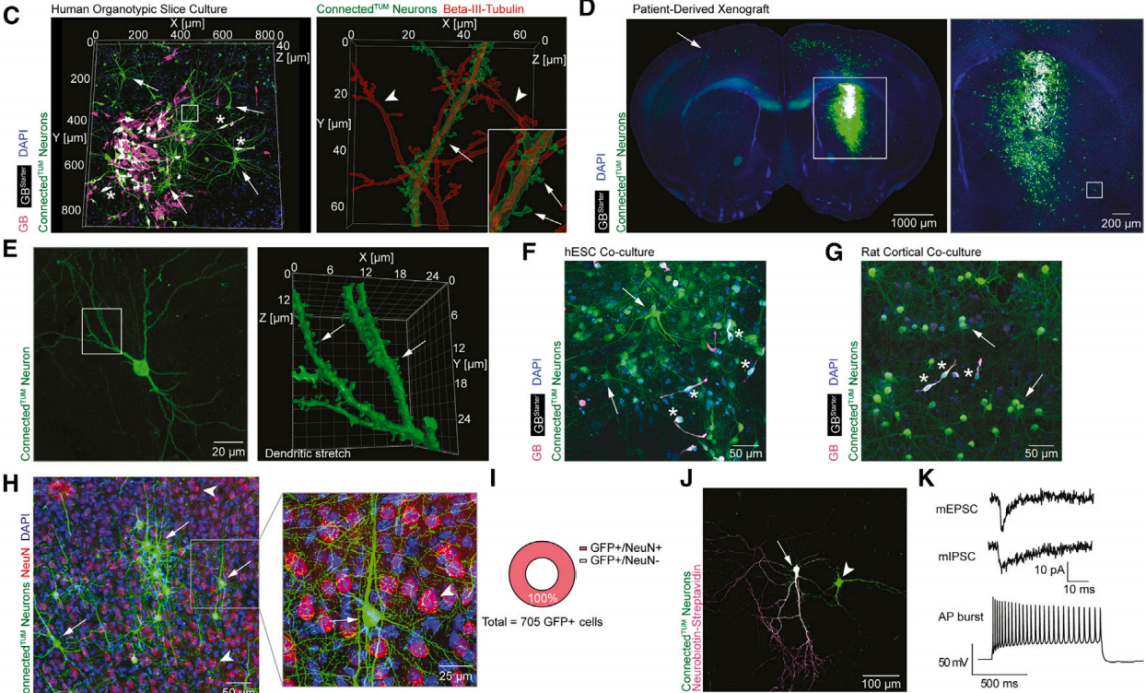
图4 在多种模型系统中评估了这种示踪方法
通过RV逆向跨单突触追踪系统,研究揭示了GBM细胞能够快速且广泛地整合到成年小鼠大脑的神经回路中,并通过多种神经递质系统的输入调控其行为。这些发现为理解神经元-肿瘤网络在GBM进展中的作用提供了新的视角,并为开发基于神经调控的GBM治疗策略奠定了基础。