胶质母细胞瘤(GB)是中枢神经系统(CNS)中最常见和最具有侵袭性的恶性原发性脑肿瘤。尽管局部治疗取得了进展,但复杂的异质性导致了治疗耐药性、高复发率和治疗15个月的中位生存期,预后不佳。microRNA-21(miR-21)在几乎所有癌症中的表达均增加了,包括GB。MicroRNA-21(miR-21(a))(人类hsa-miR-21或小鼠mmu-miR-21a)是一种已知的癌基因,在许多癌症类型中表达丰富。MiR-21(a)促进了胶质母细胞瘤(GB)的进展,而缺乏miR-21(a)则减少了肿瘤的致瘤潜力。在过去的几年中,miR-21(a)作为包括GB在内的许多癌症的潜在治疗靶点。
2024年11月19日,荷兰莱顿大学医学中心Erik R.Abels团队在MolecularTherapy杂志在线发表了题为“CRISPR targeting of mmu-miR-21a through a single adeno-associated virus vector prolongs survival of glioblastoma-bearing mice”的研究论文,利用单个腺相关病毒载体AAV8携带SaCas9(金黄色葡萄球菌的Cas9同源蛋白)的变体SaCas9-KKH和向导RNA(sgRNA),对GB模型小鼠肿瘤细胞中的miR-21a基因进行编辑,导致大脑中mmu-miR-21a水平降低,从而抑制了肿瘤生长并提高了总体生存率,在患有胶质瘤的小鼠中产生有益的抗肿瘤效果。
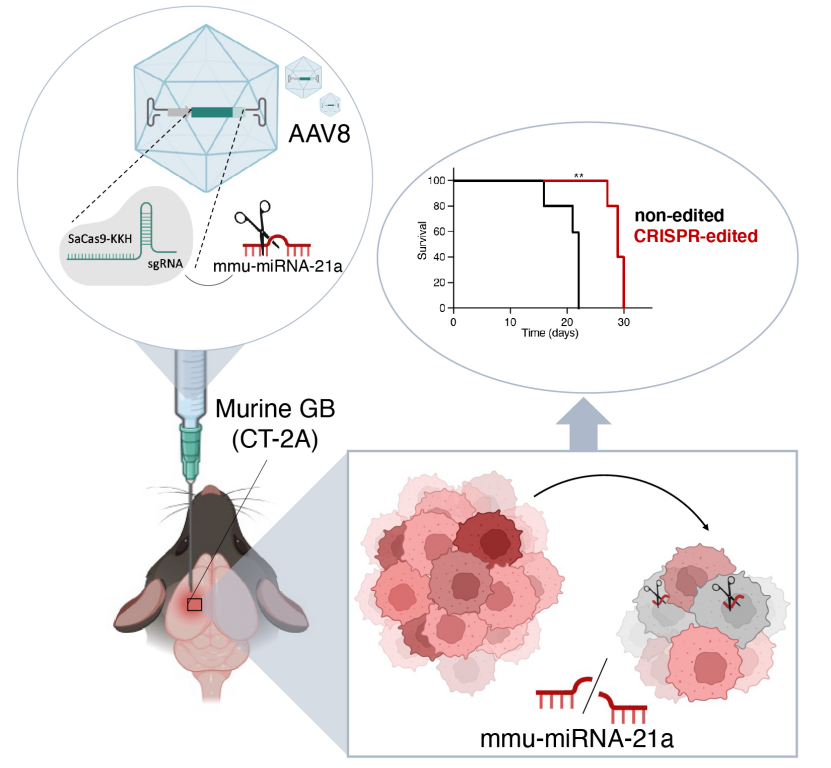
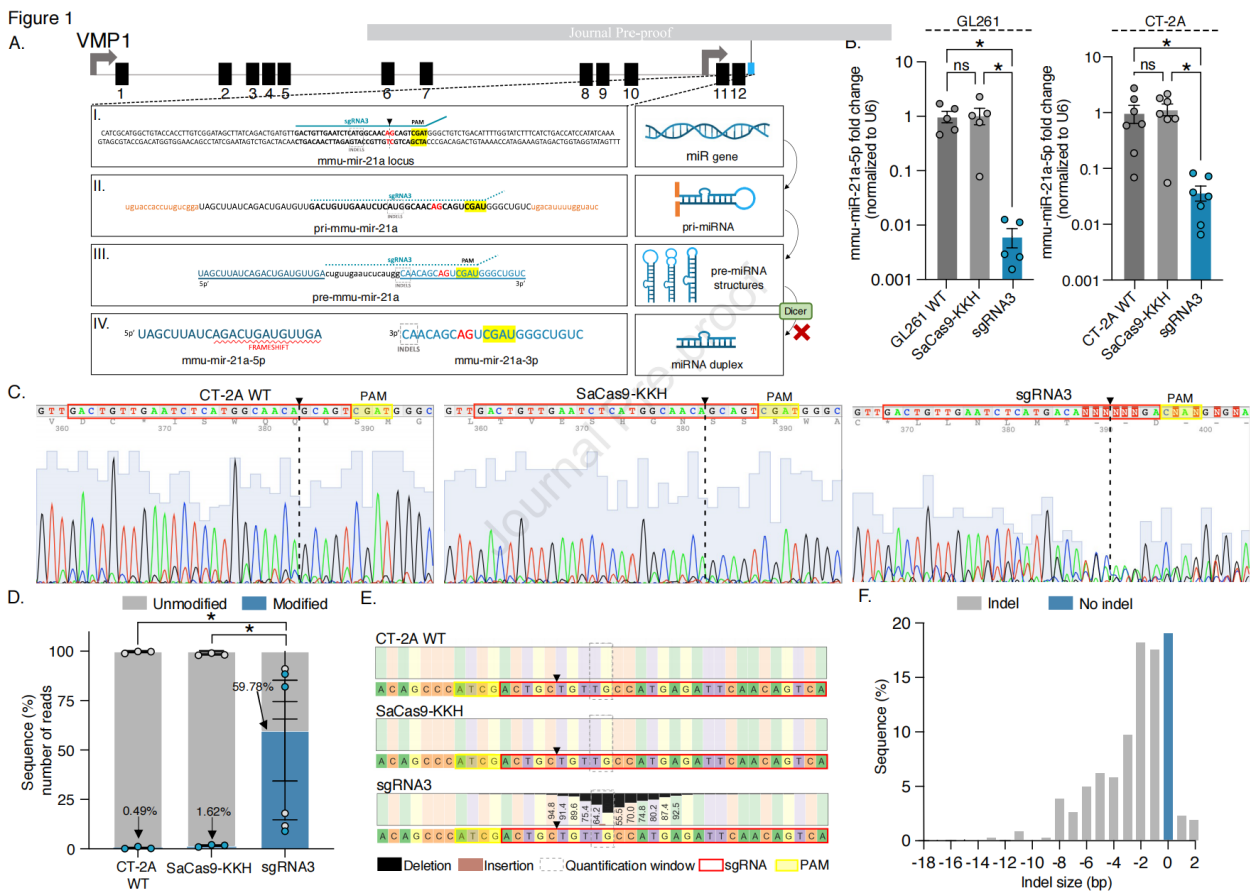
图1 体外高效编辑小鼠胶质母细胞瘤(GB)中的mmu-miR-21a
实验中构建了一个同时表达SaCas9-KKH和sgRNA质粒,该质粒通过CMV增强子与CAG启动子融合表达SaCas9-KKH,序列中还包含3x FLAG标签、2A肽(p2A)序列以及绿色荧光蛋白(GFP),同时携带由U6启动子驱动的sgRNA3。通过体外转染,评估CRISPR-Cas9系统对mmu-miR-21a的编辑效果,包括mRNA水平的变化和细胞增殖率的影响。对转染后的细胞进行GFP阳性和阴性分选,进一步分析3xFLAG标签的表达和mmu-miR-21a-5p的表达水平,结果显示与对照组相比,转染单质粒的CT-2A细胞中mmu-miR-21a水平显著降低,细胞增殖率降低。随着质粒剂量的增加,转染效率提高,mmu-miR-21a-5p的表达水平降低。但最高剂量(1600 ng)由于细胞死亡增加并未显示出更强的抑制mmu-miR-21a-5p的表达。GFP阳性分选细胞中mmu-miR-21a-5p表达水平显著降低,且观察到这些细胞基因组序列中断。通过Sanger测序和下一代测序(NGS)分析,验证基因组编辑的效果,包括indel的产生和脱靶效应的评估,结果显示SaCas9-KKH编辑在小鼠基因组中的脱靶效应最小,在预测的前5个脱靶位点中基于NGS分析显示出极少的修改读数。NGS分析显示,与CT-2A WT和转染SaCas9-KKH质粒的细胞相比,all-in-one的基因编辑读数修改比例显著提高。综上所述,实验策略成功地通过CRISPR-Cas9系统靶向并编辑了mmu-miR-21a,实现了基因表达的下调和细胞增殖率的降低,同时显示出较高的基因编辑效率和最小的脱靶效应。
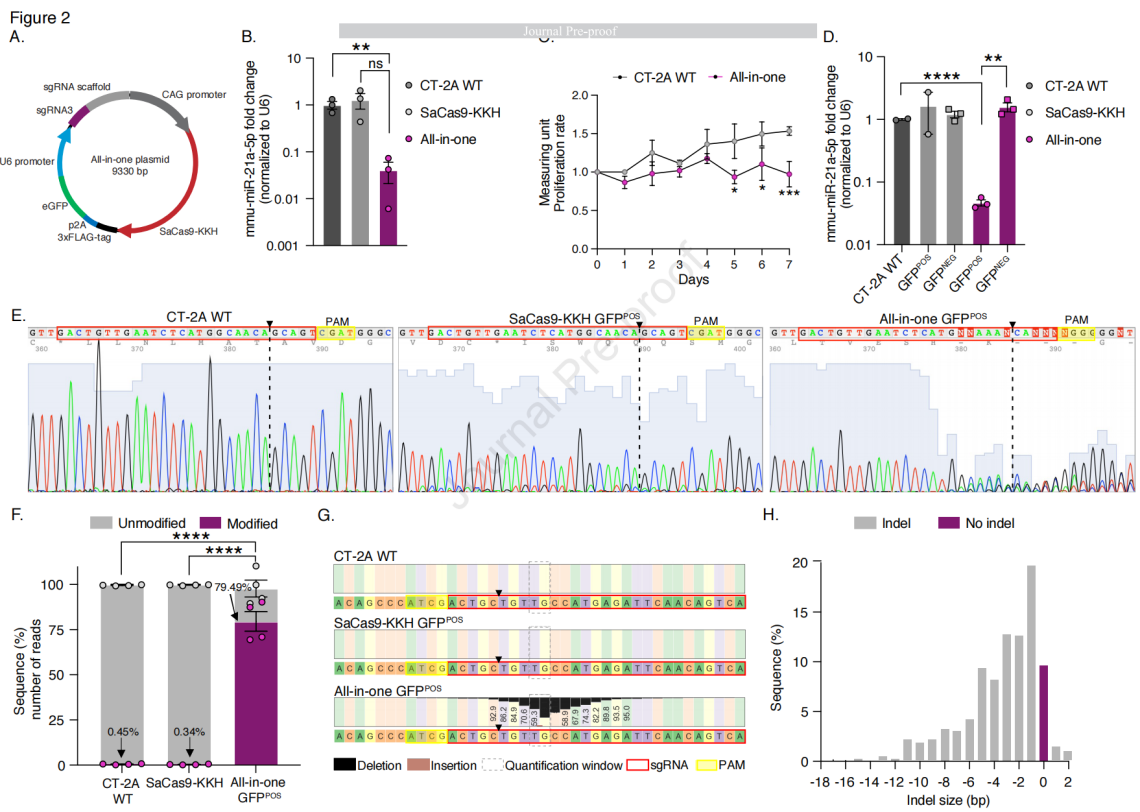
图2 使用单质粒sgRNA3-SaCas9-KKH可降低mmu-miR-21a的表达水平
使用AAV8血清型携带GFP基因,在CAG启动子的控制下转导GB细胞系(CT-2A和GL261),并在转导后7天进行评估,成像结果显示GFP转导细胞数量(GL261和CT-2A)约为55%,GFP和Ki-67的共定位作为总细胞的百分比分别为GL261约50%和CT-2A约35%。将GB细胞(CT-2A-mCherry)植入小鼠大脑,并使用体内成像系统(IVIS)监测肿瘤植入。在肿瘤植入后第7天,小鼠颅内注射AAV8-GFP或PBS作为对照,然后在第14天处死小鼠,通过GFP基因表达水平来评估转导效率。与注射PBS对照的小鼠相比,注射AAV8-GFP的小鼠在肿瘤携带的左半球中GFP基因表达水平显著更高,而在非肿瘤的右半球中两组之间没有观察到显著差异。通过免疫荧光(IF)分析大脑以确定转基因表达,结果显示AAV8-GFP在肿瘤边缘显示出最高的转导率,但在AAV8-GFP转导的细胞中,GFP没有与GFAP阳性星形胶质细胞或IBA1阳性小胶质细胞共定位。然而,AAV8血清型并不仅仅靶向mCherry阳性的肿瘤细胞,此外,在少突胶质细胞和神经元中也观察到GFP表达。在肝脏、肺和脾脏中GFP表达水平很低,表明AAV载体主要被肝脏隔离,但AAV8-GFP的肝脏摄取较低,减少了AAV介导的肝毒性风险。对来自大脑的离散肿瘤组织进行流式细胞分析,mCherry阳性肿瘤细胞为13.4%,GFP阳性AAV8转导细胞为3.6%,mCherry阳性/GFP阳性双阳性细胞为3.4%。综上所述,AAV8血清型能够有效转导GB细胞系,并在体内模型中显示出较高的转导效率,尤其是在肿瘤边缘。此外,AAV8-GFP的生物分布表明其肝脏摄取较低,减少了潜在的肝毒性风险。
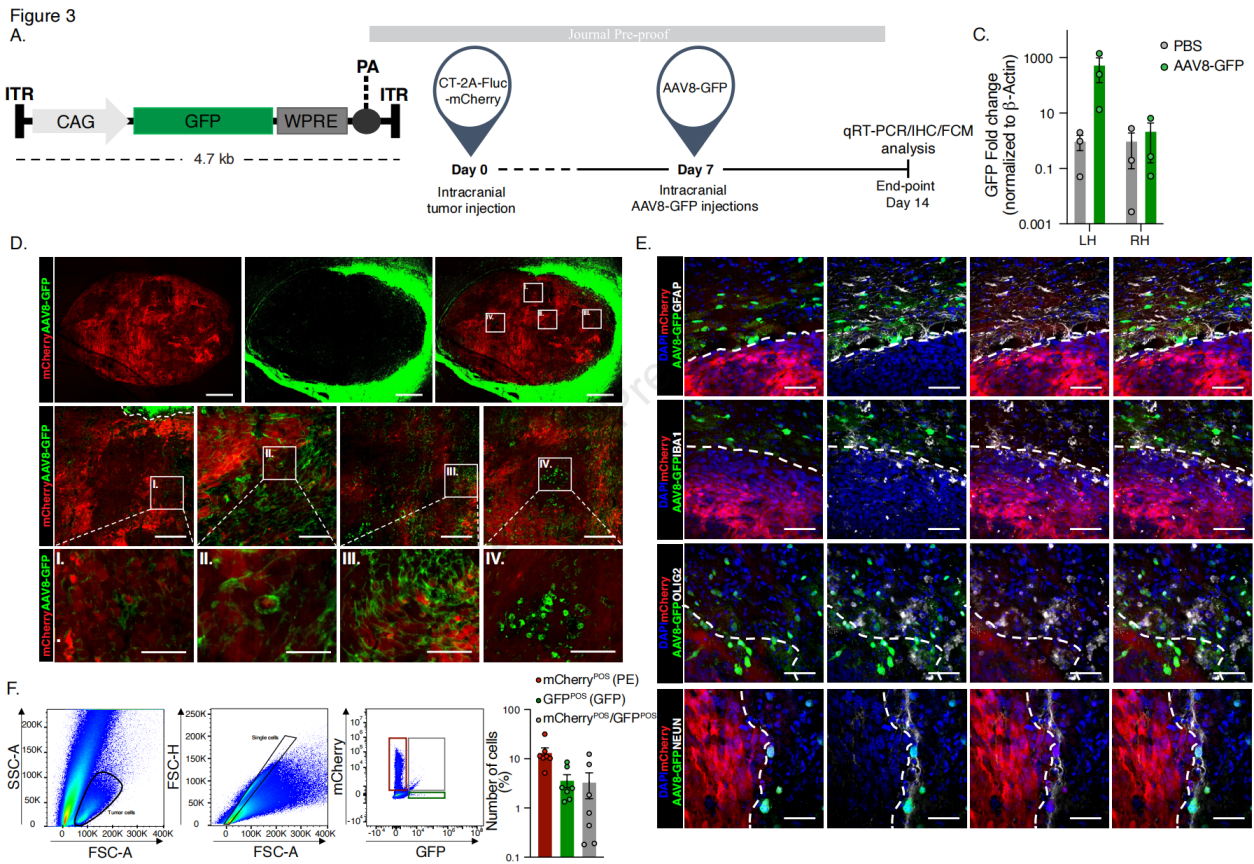
图3 小鼠GB细胞系中AAV8-GFP载体的转导谱
为了验证AAV8载体介导的SaCas9-KKH/sgRNA基因编辑mmu-miR-21a对胶质细胞瘤的治疗效果,研究人员生成了一个较小的232 cassette(约4.5 kb),编码SaCas9-KKH和sgRNA3,这些基因位于AAV载体的ITRs(倒置末端重复序列)之间。构建了两种质粒:包含SaCas9-KKH和sgRNA3的CMV-SaCas9-KKH-U6-sgRNA3(AAV8-CRISPR)和缺少sgRNA的CMV-SaCas9-KKH-U6(AAV8-control)。使用预包装的AAV8-CRISPR质粒体外转染CT-2A细胞,与AAV8-control相比,mmi-miR-21a-5p的表达水平显著降低。通过颅内注射将AAV载体与肿瘤细胞(CT-2A-FLuc-mCherry)同时注射到小鼠的肿瘤部位,以验证CRISPR基础编辑方法。与AAV8-control和未处理的CT-2A肿瘤携带大脑相比,接受AAV8-CRISPR治疗的肿瘤携带大脑中mmu-miR-21a-5p的表达水平降低了180倍。接受AAV8-CRISPR治疗的小鼠在第13天至第23天之间肿瘤生长受到抑制,并且在第20天和第23天肿瘤大小显著减小,中位总生存期显著增加,生存期增加了31%。另外,与AAV8-control相比,接受AAV8-CRISPR治疗的小鼠中肿瘤抑制基因Pten和Pdcd4显著上调。在肿瘤植入后第5天和第10天进行治疗的小鼠中未观察到治疗效果,表明这种治疗可能需要在特定的时间窗口内进行。通过Sanger测序和NGS确认了CRISPR诱导的mmu-miR-21a基因序列的插入和缺失。通过TUNEL染色和多种血液标记物分析评估AAV注射的局部和系统毒性,未观察到AAV8注射引起的局部或系统毒性。
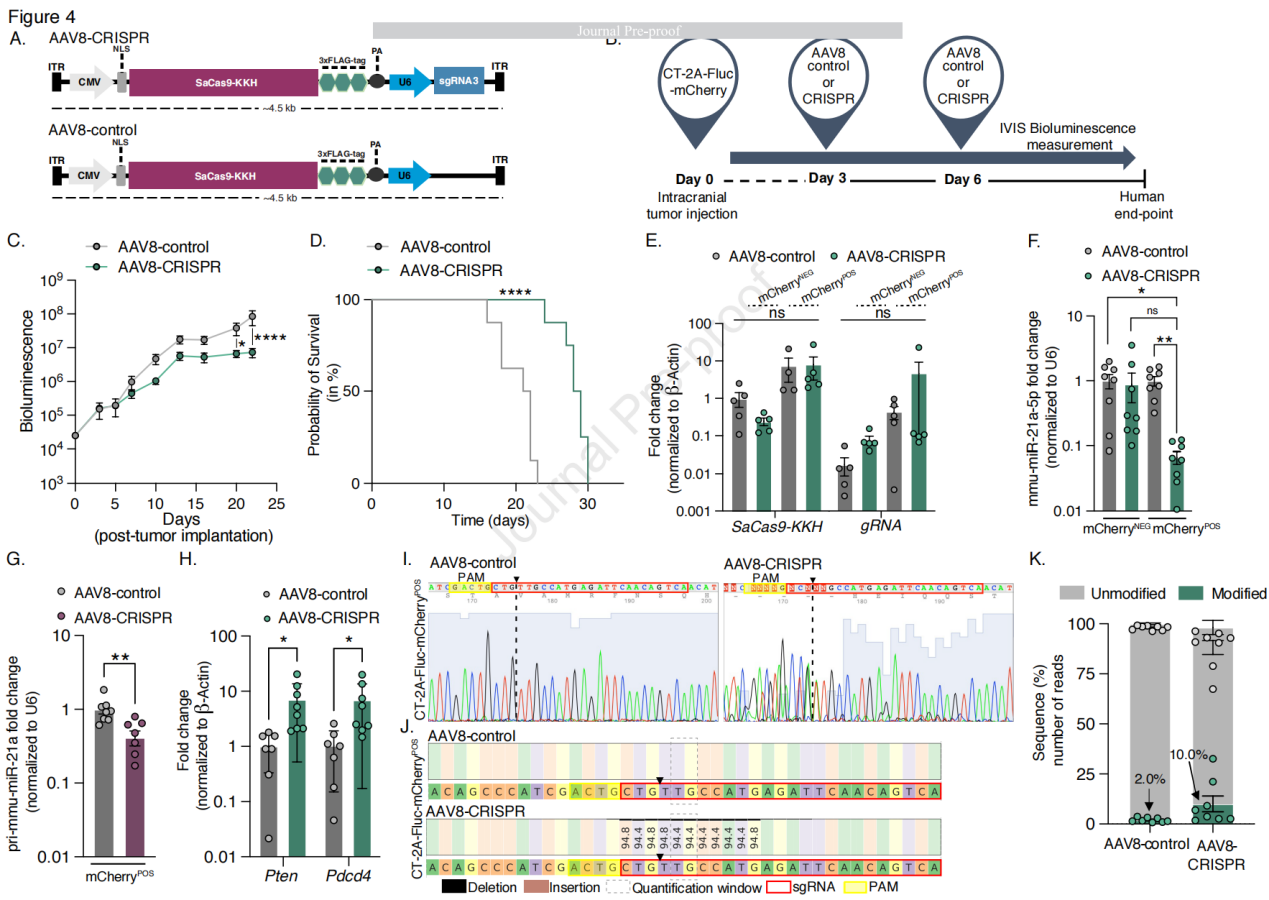
图4 AAV8-CRISPR在携带胶质母细胞瘤小鼠实现基因组编辑
本文描述的策略在胶质瘤(GB)小鼠模型中显示出了减缓肿瘤生长和显著提高存活率的效果。这项研究不仅为胶质瘤的治疗提供了一种潜在的新疗法,而且展示了利用CRISPR-Cas9技术进行精确基因编辑在癌症治疗中的潜力,这对于未来癌症治疗策略的发展具有重要意义。