疼痛,是我们身体的一种保护机制,但慢性疼痛却严重影响着许多人的生活质量。传统止痛药物往往作用于全身,包括大脑,这可能导致一系列副作用。因此,科学家们一直在寻找更精准的疼痛控制方法。2024年12月03日,北卡罗来纳大学Bryan L. Roth教授团队在Cell杂志发表了题为“Structure-guided design of a peripherally restricted chemogenetic system”的研究论文,该团队开发了HCAD系统,这是一种基于羟基羧酸受体2(HCA2)的DREADD化学遗传工具。通过特定的化学激活剂FCH-2296413,HCAD系统能够精确作用于身体周围的神经,特别是背根神经节(DRG)中的痛觉感受器,从而减轻疼痛。这种系统的设计目的是避免药物穿过血脑屏障,从而实现对周围组织的精确控制。

之所以选择HCA2受体作为DREADD系统的模板,是因为HCA2受体在大脑和其他神经组织中的表达量很低,而在先天免疫细胞中表达较多,这些免疫细胞主要位于屏障组织。由于HCA2在神经元中的表达量低,使用针对HCA2的药物可以减少对大脑神经元的潜在影响,从而降低副作用。MK-0354是一种HCA2 Gi偏向性激动剂,虽然其效果不佳未能进入第二阶段临床试验,但这样的低效或无效配体适合作为DREADD系统中潜在化学遗传激活剂。研究人员不仅对HCA2受体进行了突变,创建了HCAD,并筛选出了具有更高效能和选择性的化学激活剂FCH-2296413。
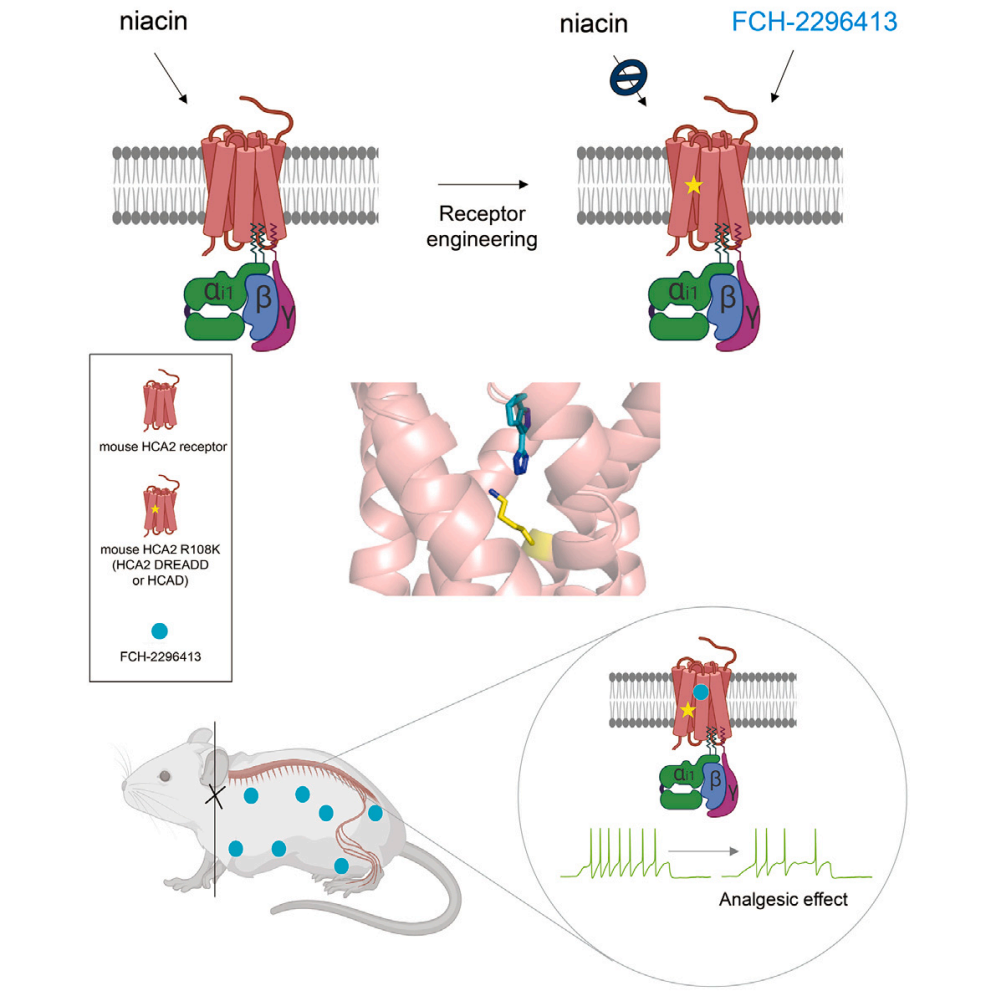
图1 HCAD系统原理示意图
大多数急性、围手术期和慢性疼痛是由DRG的外周初级传入神经元驱动的。因此,减少DRG神经元的活动,特别是痛觉感受器的活动,是开发先进疼痛治疗方法的主要策略。为了验证HCAD DREADD在体内的实用性,研究人员生产了一种腺相关病毒(AAV),用来感染DRG痛觉感受器并以Cre重组酶依赖的方式表达mHCAD-mCitrine(PHP.S-CAG-FLEx-mHCAD-mCitrine)。在Avil-Cre和TRPV1-Cre新生(P2)小鼠腹腔或成年小鼠鞘内注射AAV病毒,分别标记DRG神经元和DRG痛觉感受器。病毒注射后成功地在Cre+ DRG神经元中表达mHCAD-mCitrine(图2A)。
在细胞水平上使用全细胞膜片钳技术在分离的背根神经节(DRG)神经元中验证了mHCAD-mCitrine的功能。在DRG神经元中,Gi信号通常抑制电压门控钙通道(VGCCs),减少神经递质的释放以及从外周神经系统(PNS)到脊髓和大脑的体感信息(包括疼痛信息)的传递。在Avil-Cre小鼠的DRG神经元中,FCH-2296413以浓度依赖性的方式减少了HCAD-mCitrine阳性神经元中电压激活的钙电流幅度。在100 nm的浓度下,FCH-2296413没有产生任何抑制作用,1和10 μm的FCH-2296413显著抑制了VGCC(图2B和2C)。此外,在给FCH-2296413后钙电流动力学变慢(图2B和2D)。这些抑制作用与作用于DRG神经元内源性Gi-GPCRs的阿片类镇痛药产生的效果非常相似。在mHCAD-mCitrine阴性(对照)神经元中FCH-2296413对VGCCs没有抑制作用。
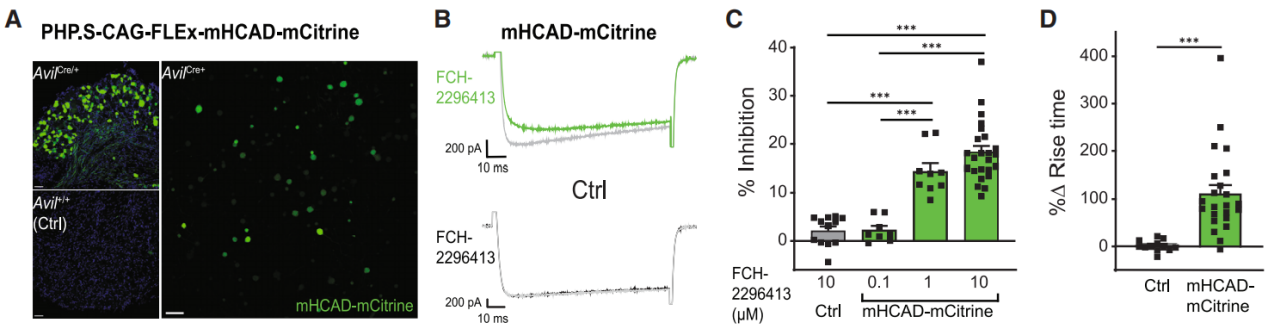
图2 全细胞膜片钳技术记录电压激活的钙电流
Gi信号的另一个典型效应是膜电位的超极化,这导致兴奋性降低和体感信息的编码。研究发现FCH-2296413显著降低了mHCAD-mCitrine+DRG神经元的静息膜电位(RMP)(图3E和3F),并减少了动作电位(APs)(图3E和3G)。这些影响是可逆的,因为在清洗FCH-2296413后,RMP和AP都恢复到基线水平(图3F和3G),并且在mHCAD-mcitrine阴性的对照神经元中没有出现这种现象(图3F和3G)。
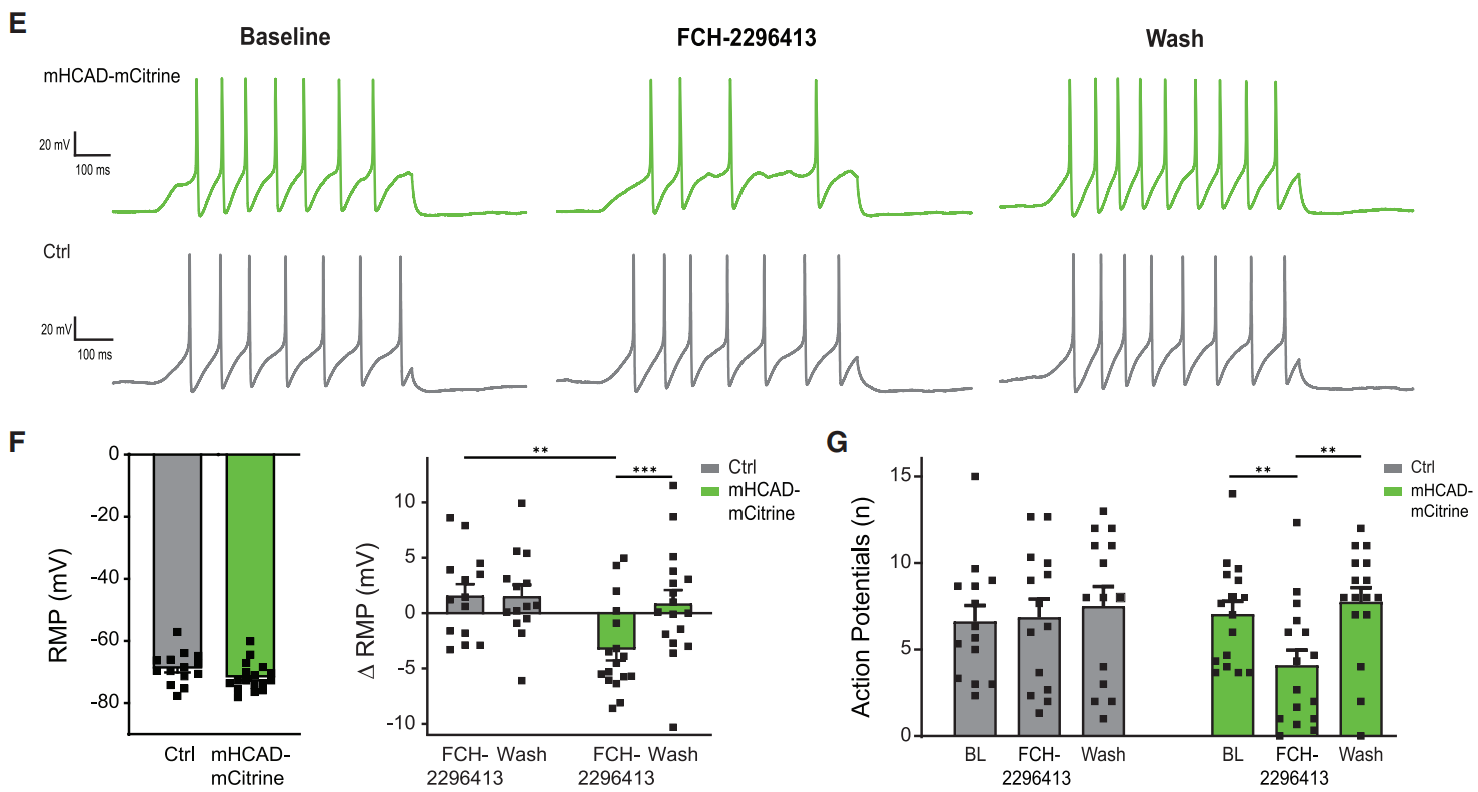
图3 mHCAD系统对静息电位和动作电位影响
此前有报道称,在没有激动剂的情况下hM4Di的表达会改变DRG神经元离子通道的功能。因此,为了进一步表征mHCAD的功能及其在研究外周神经元方面的潜在优势,研究人员验证了在没有FCH-2296413的情况下,mHCAD表达对参与AP形成的电流的影响,结果发现AP波形(图4H-4M)的阈值、过冲(Overshoot,动作电位达到峰值时,膜电位超过正常静息电位的值)和持续时间方面没有显著差异(图4I-4K)。这表明,负责APs起始、上升和下降阶段的电压门控钠通道和电压门控钾通道不受mHCAD表达的影响。然而,mHCAD的表达一定程度上增加了超极化后AP的振幅,但没有增加其衰减时间(AHP)(图4L和4M)。最重要的是,mHCAD-mCitrine+细胞和不表达受体的细胞之间的兴奋性没有差异(图4N)。另外,与hM4Di相比,mHCAD的表达没有引起任何可检测到的基因表达变化(图4O)。综上所述,在FCH-2296413缺失的情况下,mHCAD表达对DRG神经元功能的影响有限,而FCH-2296413激活mHCAD影响了DRG神经元中与兴奋性降低和递质释放相关的经典Gi信号通路。
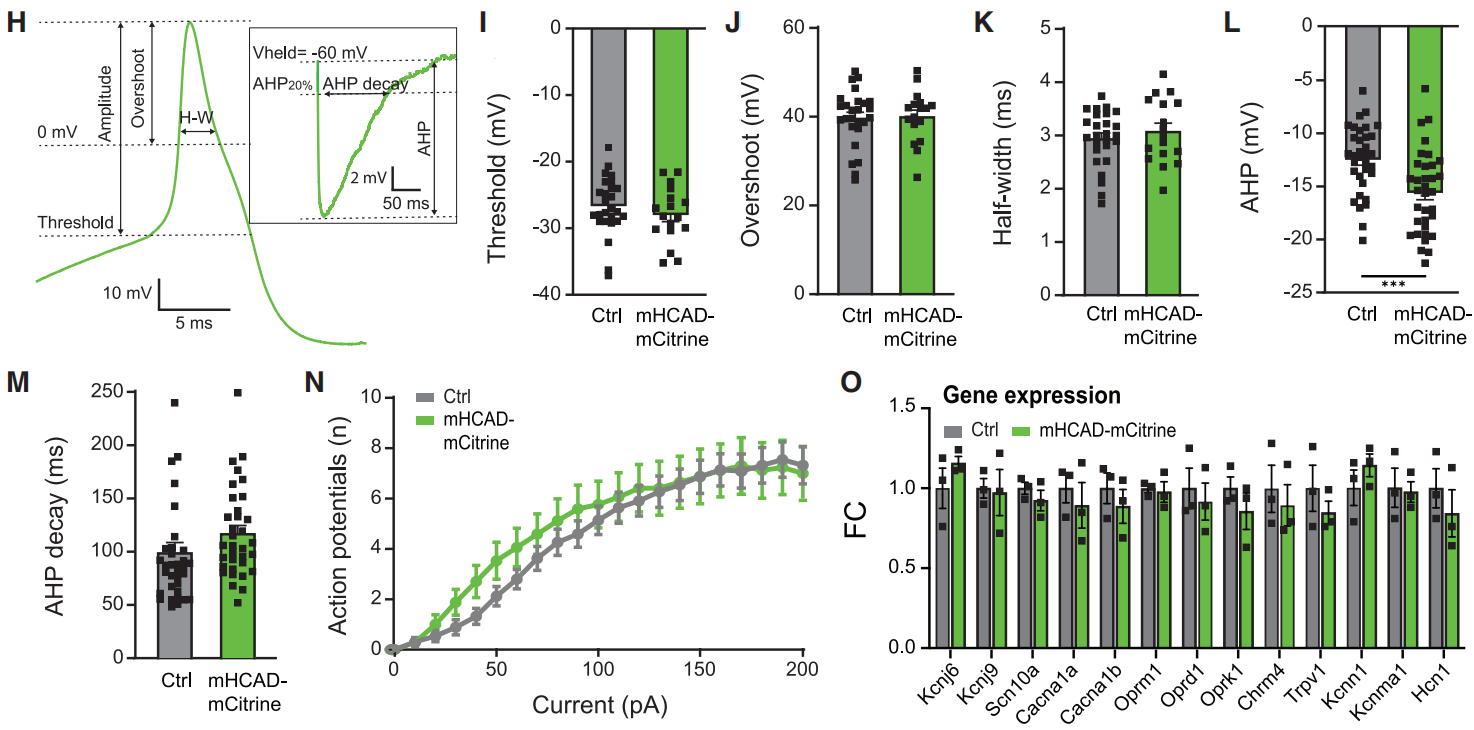
图4 mHCAD对参与AP形成电流影响
研究人员评估了FCH-2296413(10mg/kg,皮下注射)对鞘内注射PHP.S-CAG-FLEx-mHCAD-mCitrine或对照病毒PHP.S-CAG-FLEx-tdTomato(Ctrl)的Trpv1-Cre小鼠痛觉的影响(图5A和5B),结果显示在急性热痛的热板测试中(图5C),FCH-2296413显著减少了DRG痛觉感受器表达mHCAD小鼠的前爪舔、后爪舔和跳跃的持续时间和次数,以及这些伤害性行为的总次数,同时增加了首次伤害性行为的潜伏期(图5C),提示mHCAD介导镇痛作用。此外,在组织损伤和慢性炎症性疼痛的Freund’s adjuvant(CFA)模型中(图5D),FCH-2296413减轻了表达mHCAD小鼠的机械性和热性痛觉过敏,但在对照小鼠中没有减轻,从而确立了FCH-2296413和mHCAD的治疗性抗痛觉过敏特性。总体上证实了在DRG痛觉感受器表达mHCAD的小鼠中FCH-2296413对生理性和病理性疼痛都具有镇痛活性。
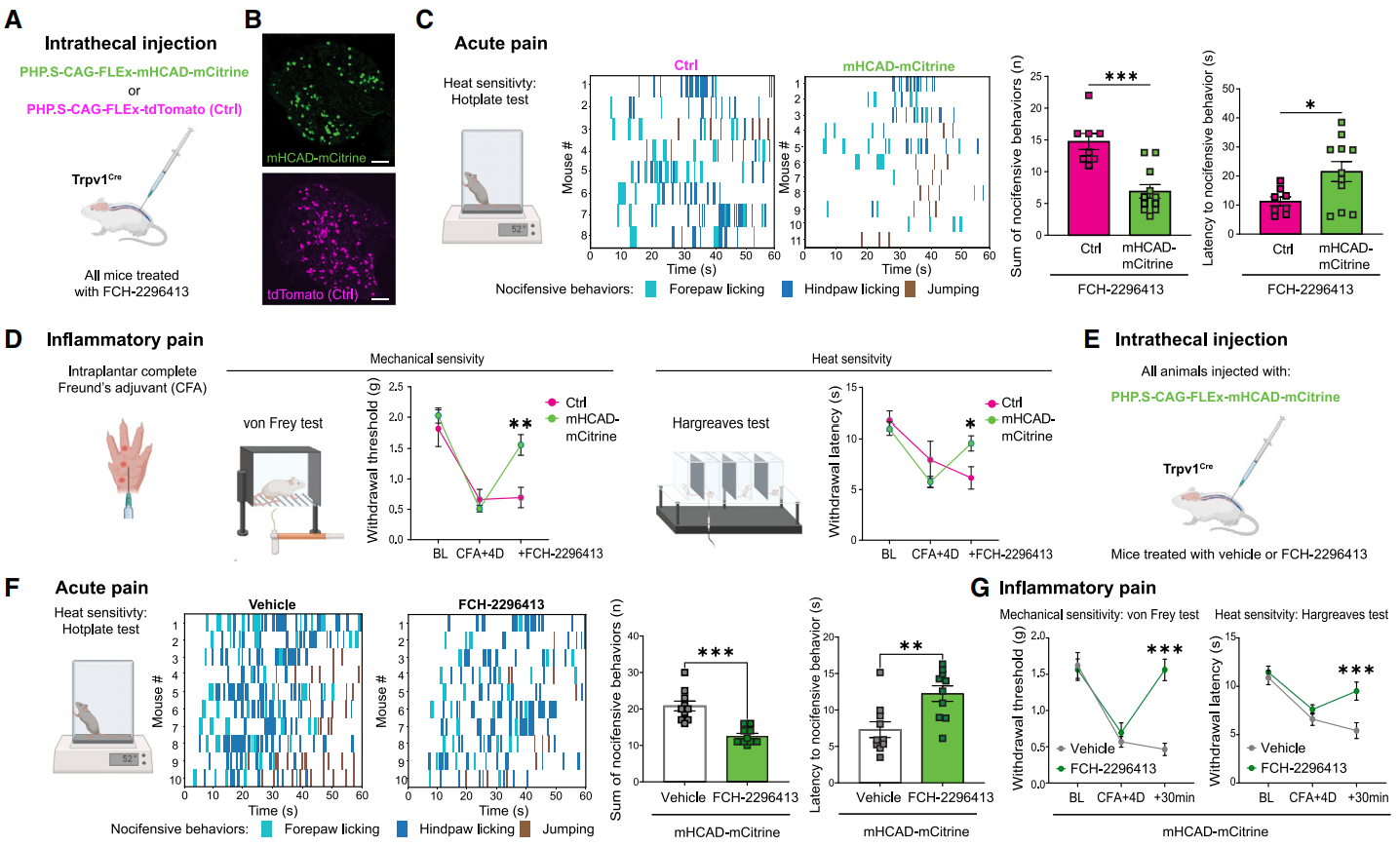
图5 mHCAD外周化学遗传的镇痛作用
已有报道提出其他化学遗传学药物(如CNO)可以改变小鼠的运动行为,这可能会混淆对许多行为的解释,包括伤害性反应。接下来研究人员探究了在未表达mHCAD的WT小鼠中,FCH-2296413对各种行为的影响(图6H-6P)。结果发现FCH-2296413对WT小鼠机械阈值没有影响,在尾巴浸没测试(图6I)、热板(图6J和6K)和哈格里夫斯试验中没有引起伤害性行为的变化。不仅如此,研究人员还检验了FCH-2296413对旷场测试中的运动和焦虑行为,以及转棒测试中的运动协调性的影响。在这些实验中,FCH-2296413对WT小鼠的行为没有影响。综上所述,这些结果表明,本文提出的外周DREADD系统可以特异性地调节DRG痛觉感受器的功能并减轻疼痛,可用于外周神经元功能的机制研究和影响PNS的疾病的治疗。
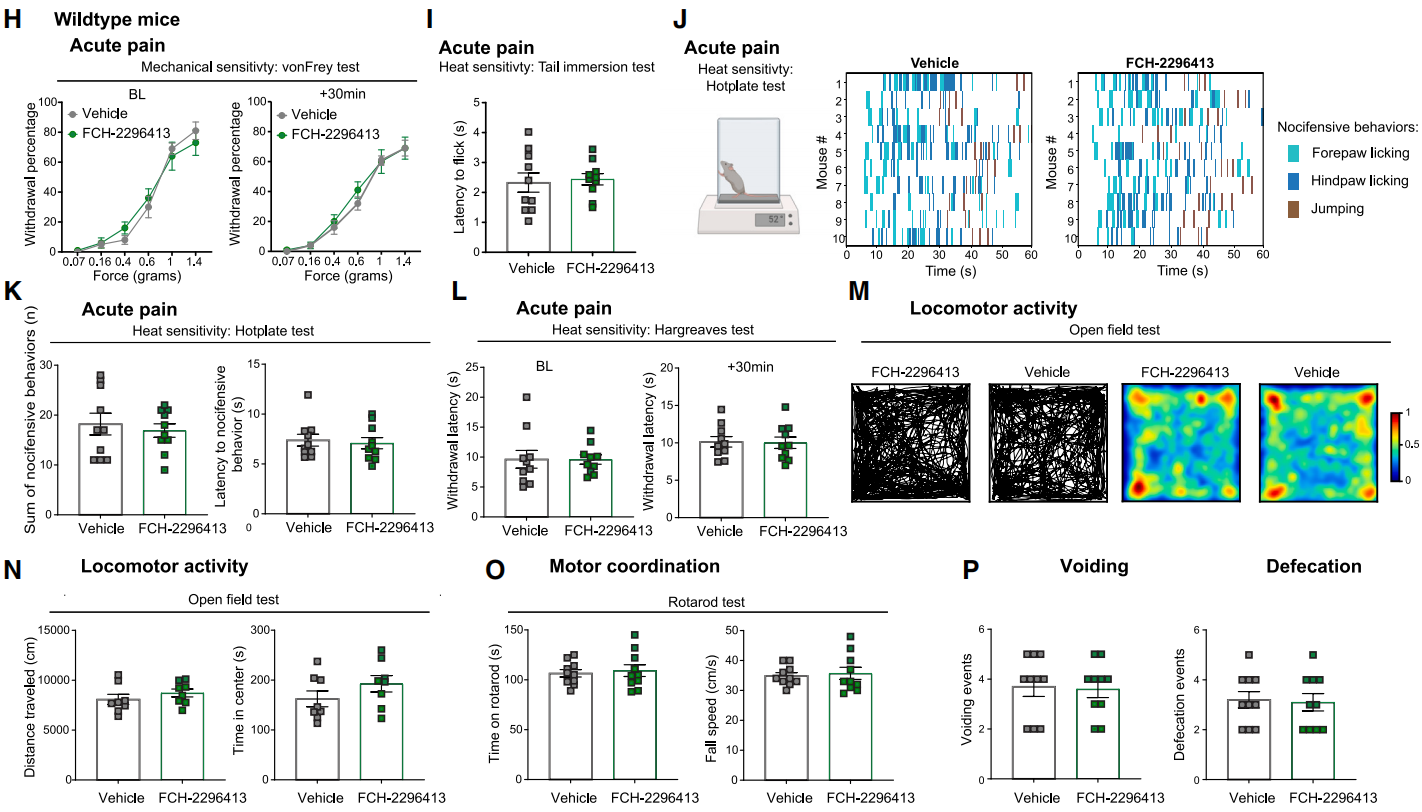
图6 FCH-2296413不影响WT小鼠行为
这项研究的意义在于提供了一种新的工具,可以用于研究和治疗疼痛等周围神经系统相关疾病,同时避免了传统药物可能引起的中枢神经系统副作用。HCAD系统的成功开发和验证为未来在神经科学研究和临床治疗中提供了广阔的应用前景,特别是在需要精确控制神经活动而不影响大脑功能的场合。