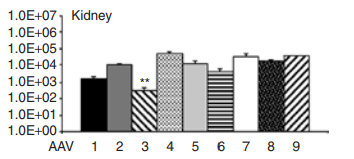
AAV的复制缺陷性、人类的非致病性和相对的非免疫原性使得AAV成为最受欢迎的基因治疗载体之一。目前许多肾脏疾病可以通过基因治疗来解决。然而,与其他器官系统相比,基因传递到肾细胞是低效的,这在一定程度上是由于肾脏排除了50 kDa以上的分子,而且大多数基因传递载体的质量都是(megaDaltons,缩写为MDa)。分子生物学的最新进展使我们能够对AAV衣壳进行改造,来提高对肾脏的靶向性和转导效率。根据文献报道和实践经验,肾脏研究中常用的AAV血清型包括AAV1、AAV2、AAV5、AAV6、AAV7、AAV8和AAV9。在条件敲除小鼠诱导疾病发生之前,利用AAV 2/9介导基因表达,研究结果显示蛋白尿、血浆肌酐、血浆尿素、血浆胆固醇、组织学改变和长期生存率均有改善。

肾脏常用载体有 AAV2、AAV8 和 AAV9。
可以通过尾静脉注射、肾脏皮质直接注射、肾动脉注射或输尿管逆行注射等多种方式实现AAV在肾脏中的稳定持续表达,每种方法具有不同的特点和适用场景。
1、尾静脉注射
尾静脉注射最为便捷,对肾脏也不造成任何损害,但目的基因蛋白在肾脏的表达量偏少。
2、其他注射方式
常见的注射方式还有肾脏皮质直接注射、肾动脉注射或输尿管逆行注射等方法。肾动脉、肾皮质直接注射或输尿管逆行注射的方法,都会对肾脏造成一定的损害,主要感染肾小管上皮细胞。
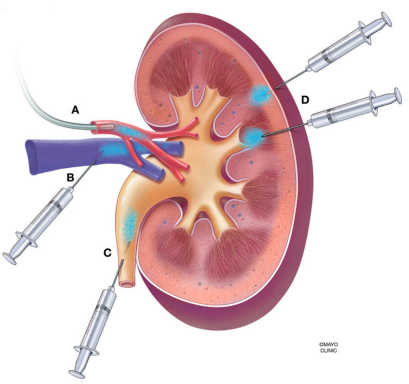
图2 肾脏AAV给药方式,A肾动脉灌注,通过导管或注射器;B肾静脉逆行灌注;C逆行输尿管灌注;D经肾囊壁直接向肾实质注射。
实例一:AAV2/Anc80可以特异性并高效转导肾间充质细胞,包括周细胞、成纤维细胞和系膜细胞【3】
血清型:AAV2/Anc80;
启动子:CMV,CASI;
实验动物:C57小鼠;
注射方案:眶后静脉注射,1.0×10^12 vg/只,表达4周;
实验结果:通过静脉注射不同血清型AAV病毒AAV-CMV-eGFP-WPRE,结果显示4周后,AAV2/8和AAV2/Anc80是唯一表现出肾脏转导的AAV血清型,其中Anc80的转导率比AAV8高3-5倍。免疫荧光染色结果显示Anc80-GFP的表达仅限于肾间质、肾小球和肾小球旁区域。此外与CMV启动子相比,CASI启动子的周细胞和成纤维细胞转导效果更好,对系膜细胞转导效率低。
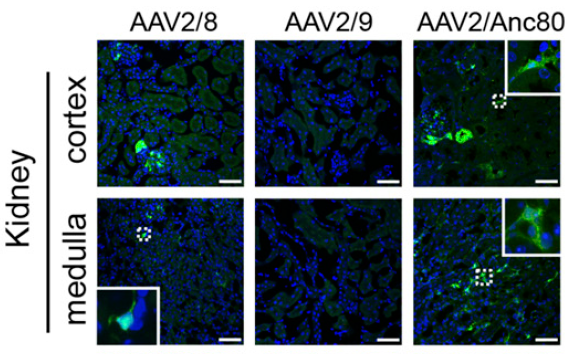
图3 AAV 2/Anc80高效转导肾间质细胞和系膜细胞
实例二:经尾静脉注射给予的AAV9可转导肾脏足细胞【4】
血清型:AAV9;
启动子:hNPHS1,mNPHS1;
实验动物:Pod-rtTA TetO-Cre NPHS2fl/fl小鼠(诱导足蛋白敲除肾病小鼠模型);
注射方案:尾静脉注射,1.5×10^12 vg/只,表达8周;
实验结果:8周龄的Pod-rtTA TetO-Cre NPHS2fl/fl小鼠通过尾静脉注射AAV 2/9 -hNPHS1-mpodo、AAV 2/9-mNPHS1-mpodo或生理盐水。结果显示,8周后在注射AAV的小鼠肾皮质中,可以检测到AAV的ITRs。接受AAV载体注射的小鼠肾脏中,实时荧光定量PCR结果显示NPHS2( 编码 podocin足突蛋白)和HA标记的podocin足突蛋白mRNA增加。进一步的共定位分析表明,HA标记的podocin足突蛋白与足细胞标记物Nephrin有明显的共定位现象。
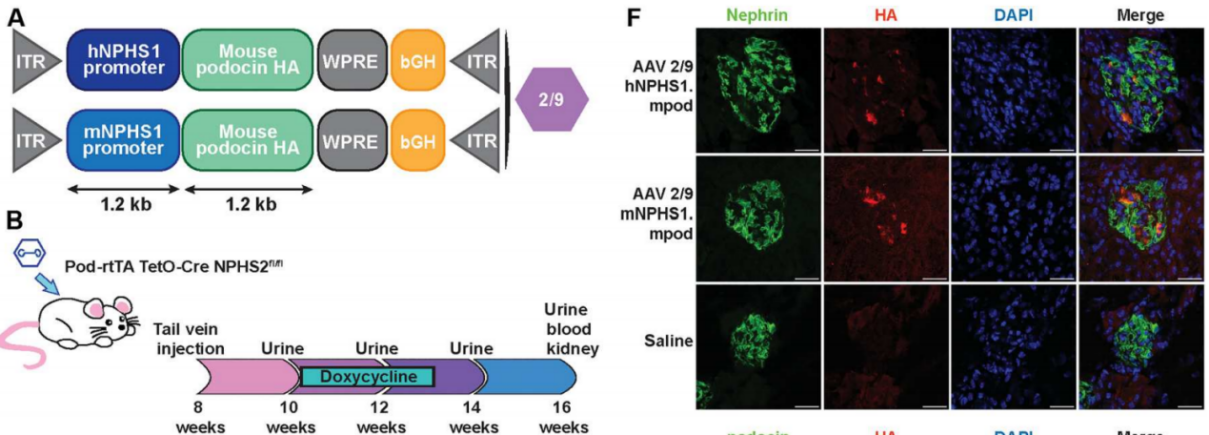
图4 尾静脉注射AAV9感染肾脏
实例三:过表达tRF3-IleAAT减轻了DKD模型中ECM的合成【5】
血清型:AAV9;
实验动物:DKD小鼠(糖尿病肾病模型);
注射方案:尾静脉注射,1.0×10^12 vg/只,表达8周;
实验结果:通过尾静脉注射AAV-tRF3-IleAAT 来过表达tRF3-IleAAT,并建立相应的NC组AAV-tRF-NC。在20周龄时,db/db + AAV tRF3-IleAAT组肾组织中,tRF3-IleAAT的表达水平显著升高,表明成功实现了过表达。
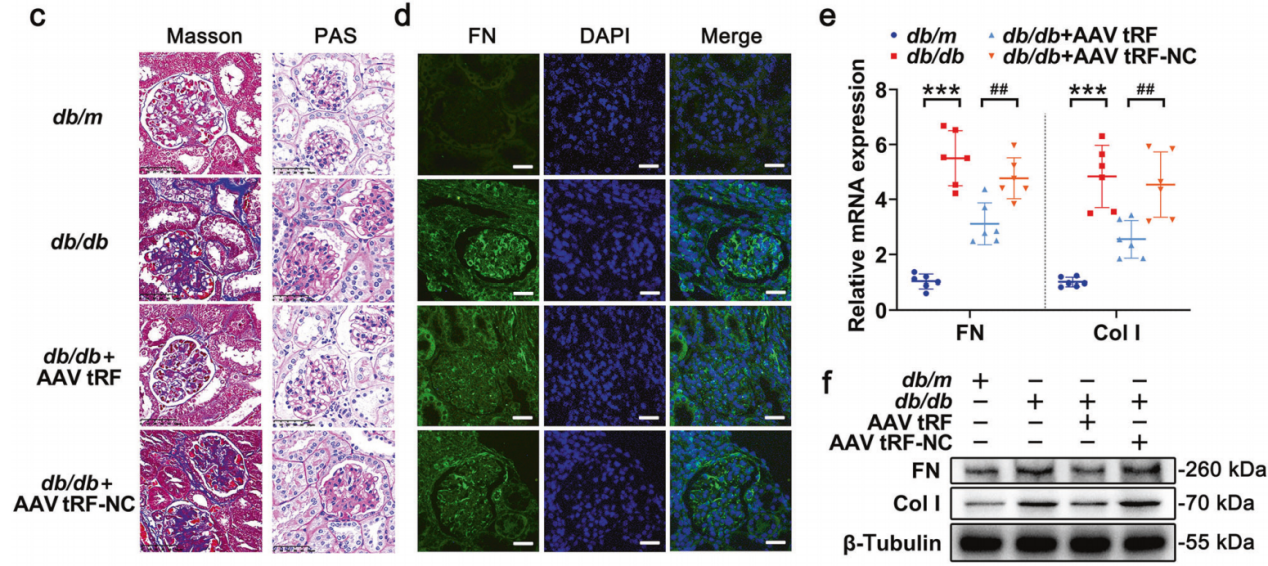
图5尾静脉注射AAV过表达tRF3-IleAAT
实例四:AAV2-GEC特异性转导肾小球内皮细胞【6】
血清型:AAV2-GEC;
启动子:CMV;
实验动物:C57小鼠;
注射方案:尾静脉注射,5.0×10^12 vg/kg,表达2周;
实验结果:为了选择肾脏特异性的AAV衣壳,使用了AAV2随机七聚体肽库,评估AAV2-GEC(AAV2-QVLVYRE)体内转导效率,结果显示在注射AAV2-wt的小鼠肾脏中未检测到GFP的表达,肝脏和心脏中GFP表达较强,脾脏中表达中等,而在AAV2-GEC注射小鼠的肝脏、心脏和脾脏中,GFP阳性细胞并没有与内皮细胞标记物共定位。在肾脏中,免疫荧光染色(IF)显示,AAV2-GEC介导的GFP表达仅限于肾小球,在所有肾小球中均具有良好的转导效率。
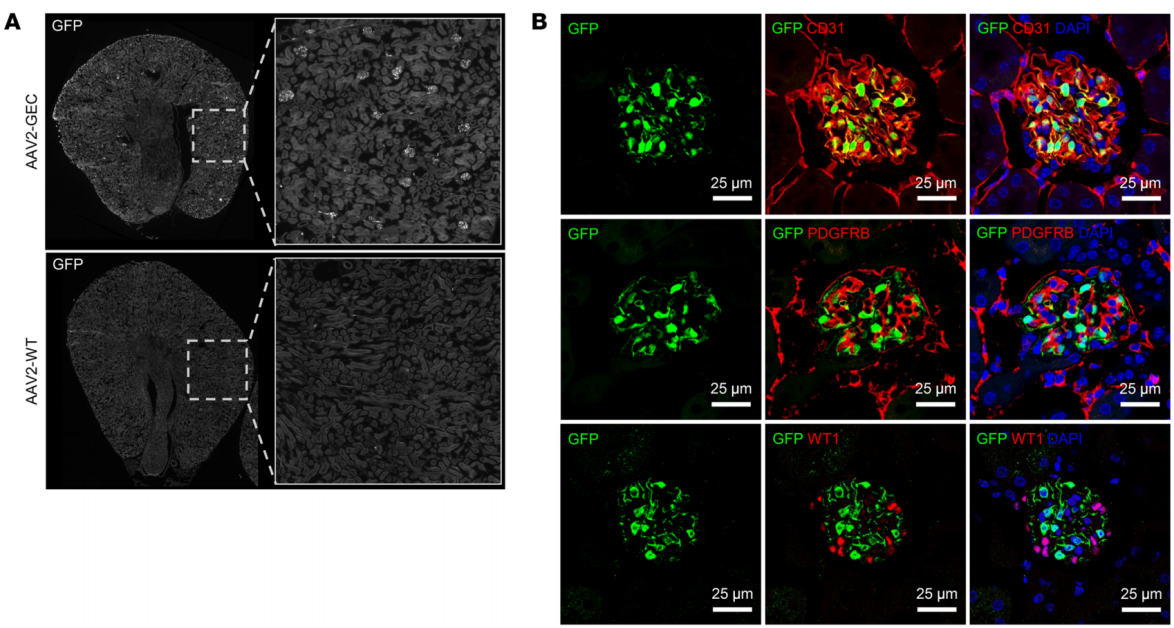
图6 AAV2-GEC介导GFP在肾小球内皮细胞表达
参考文献
[1] Zincarelli C, Soltys S, Rengo G, Rabinowitz JE. Analysis of AAV serotypes 1-9 mediated gene expression and tropism in mice after systemic injection. Mol Ther. 2008;16(6):1073-1080.
[2] Rubin JD, Barry MA. Improving Molecular Therapy in the Kidney. Mol Diagn Ther. 2020;24(4):375-396.
[3] Ikeda Y, Sun Z, Ru X, Vandenberghe LH, Humphreys BD. Efficient Gene Transfer to Kidney Mesenchymal Cells Using a Synthetic Adeno-Associated Viral Vector. J Am Soc Nephrol. 2018;29(9):2287-2297.
[4] Ding WY, Kuzmuk V, Hunter S, et al. Adeno-associated virus gene therapy prevents progression of kidney disease in genetic models of nephrotic syndrome. Sci Transl Med. 2023;15(708):eabc8226.
[5] Qiao YY, Ji JL, Hou WL, et al. tRF3-IleAAT reduced extracellular matrix synthesis in diabetic kidney disease mice by targeting ZNF281 and inhibiting ferroptosis. Acta Pharmacol Sin. 2024;45(5):1032-1043.
[6] Wu G, Liu S, Hagenstein J, et al. Adeno-associated virus-based gene therapy treats inflammatory kidney disease in mice. J Clin Invest. 2024;134(17):e174722.