在当今社会,肥胖和糖尿病等代谢性疾病已成为全球性健康难题。胰高血糖素样肽-1受体(GLP-1R)是一种在体内广泛表达的肽类激素受体,参与能量调节和葡萄糖稳态的维持,与肥胖和糖尿病等密切相关。GLP-1R还是临床上一些减肥药物(如塞美格鲁肽和利拉鲁肽)的靶点。然而,尽管GLP-1R在临床上具有重要作用,目前用于高时空分辨率下研究GLP-1R激活动态的工具依然非常有限。
2023年6月2日,苏黎世大学的研究人员在 eLife 杂志在线发表了题为“Optical tools for visualizing and controlling human GLP-1 receptor activation with high spatiotemporal resolution”的论文。该研究开发了一种基因编码的传感器GLPLight1,具有高灵敏度(最大ΔF/F0=528%)和时间分辨率(τON=4.7秒),能够实时、高时空分辨率地响应GLP-1信号,并监测人类胰高血糖素样肽-1受体(GLP-1R)的激活动态。
研究人员基于人源胰高血糖素样肽-1受体(hmGLP1R)进行设计,在hmGLP1R的第三个细胞内环(ICL3)中的K336和T343位氨基酸之间插入环形排列的绿色荧光蛋白(cpGFP),开发出初代GLP1荧光探针,但其对GLP-1荧光响应较弱。随后,研究者对该探针进行了系列优化,具体包括:1)去除内源性GLP1R N端分泌序列(第1-23位氨基酸);2)在探针C末端引入了内质网输出序列,以进一步增强膜表达;3)在第二胞内环(ICL2)及cpGFP 附近的两个受体残基进行L260K、K336Y、T343N突变,提升对GLP-1的荧光响应;4)突变C末端负责GLP1R内化的八个磷酸化位点,以减少探针蛋白的内化。最终,经过优化,获得了具有良好膜表达、高灵敏度(最大ΔF/F0=528%)和良好时间分辨率(τON=4.7秒)的GLP1荧光探针——GLPLight1,并筛选出一个具有良好的膜表达但对GLP-1无荧光响应的突变体(L141A, N300A, E387A),作为对照探针——GLPLight-ctr。
为进一步探究GLPLight1的表达及荧光响应特性,研究者利用腺相关病毒(AAV)在原代皮质神经元和293T细胞中进行体外表达。结果显示GLPLight1在细胞膜上表达良好,并且在原代皮质神经元细胞中对GLP-1显示出最大荧光响应456%(10 µM)。随后,研究者在HEK细胞中测量了GLPLight1荧光探针的光谱特性,发现其最大激发波长为500 nm,最大发射波长为512 nm。
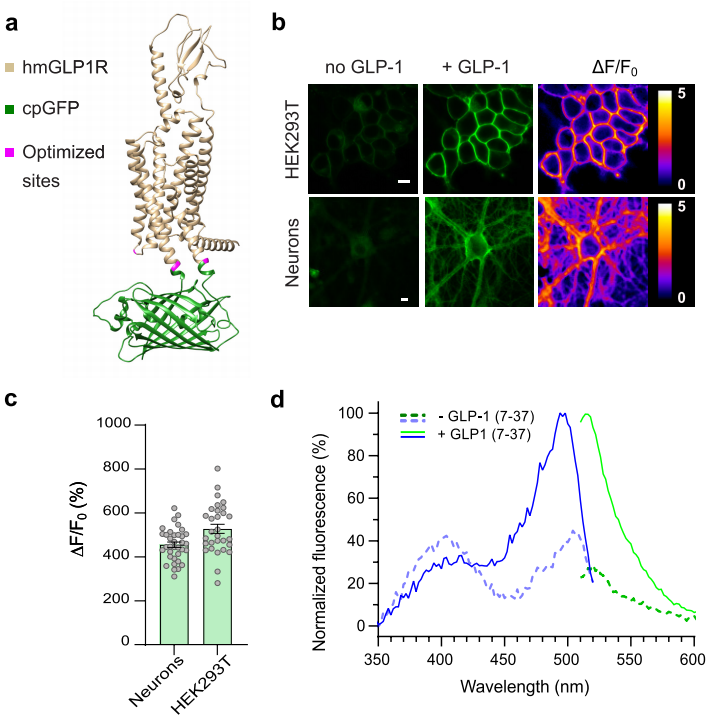
图1 GLPLight1的结构及光学特性
此外,研究者通过荧光素酶互补测定等方法,对GLPLight1探针与内源GLP1R对下游信号传导特性进行了比较。结果显示,GLPLight1对多种G蛋白(如miniGs、miniGq、miniGi)耦合作用显著降低;在高浓度的GLP-1(100 nM)作用下,虽然GLPLight1表现出强荧光响应,但下游的cAMP水平未增加,表明GLPLight1并不参与cAMP信号通路的激活。由此表明,GLPLight1可做为一个实时监测GLP-1R激活状态的有效工具,而不会受到信号传导过程中其他因素的干扰,同时也不会影响正常的信号传导途径。
GLPLight1是一种基因编码的荧光探针,不仅对GLP-1具有高度灵敏的响应,还能模拟内源hmGLP1R受体在配体激活下的状态,具有广泛的应用潜力,特别是在在药物开发领域。研究者对GLPLight1进行了系列体外药理学实验,通过在不同条件下添加对GLP1R具有药理学效应的各种配体,表征其药理学特性。Exendin-9(Ex-9)是一种已知的GLP1R肽拮抗剂,在体外表达GLPLight1的HEK293T细胞中添加1.0 µM GLP-1后,再添加10 µM Ex-9,结果显示Ex-9能在不到5分钟的时间内将信号部分逆转至最大GLP-1反应的42%(图2a-b)。利拉鲁肽和塞美格鲁肽是已知的GLP1R激动剂,并作为临床抗肥胖药物使用。实验表明,在HEK293T细胞中,GLPLight1对这两种激动剂的响应与GLP-1相当,几乎达到了最大激活(图2a)(图2a)。以上结果表明,GLPLight1可作为直接检测药物对hmGLP1R药理作用的工具。此外,关于GLPLight1对其他肽类的特异性研究显示GLPLight1不响应GLP-2及其他内源性B1类GPCR肽类(GIP、CRF、PTH、PACAP或VIP)。
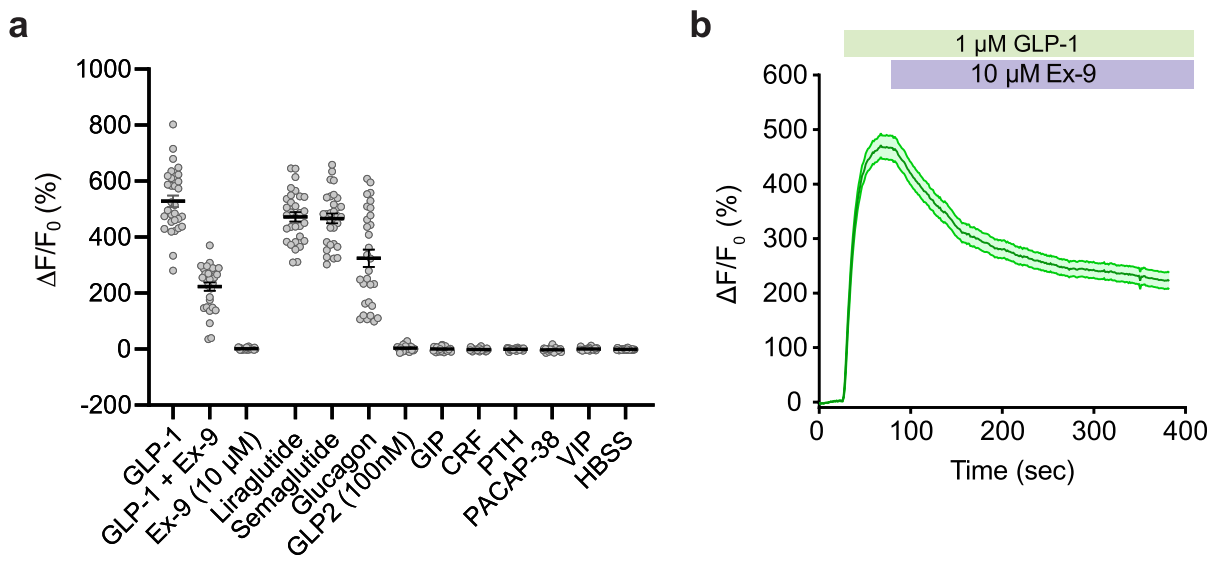
图2 293T细胞中GLPLight1药理学特性
为进一步验证GLPLight1是否能灵敏检测体外内源性GLP-1的释放,研究者人员将GLUTag细胞(一种能够分泌GLP-1/胰高血糖素的永生化肠内分泌细胞系)和HEK293T细胞(表达GLPLight1)进行共培养,然后再加入外源GLP-1。结果显示,与单独培养HEK293T细胞的对照组相比,HEK293T细胞与GLUTag细胞共培养时,GLPLight1对GLP-1的反应显著降低,表明 GLPLight1被GLUTag细胞分泌的内源性GLP-1预先激活。此结果表明,GLPLight1能够有效检测内源性GLP-1的释放,因此可作为一种潜在的筛选工具,用于研究在体外调控肠内分泌细胞(ECs)释放GLP-1的内在和外在因素。
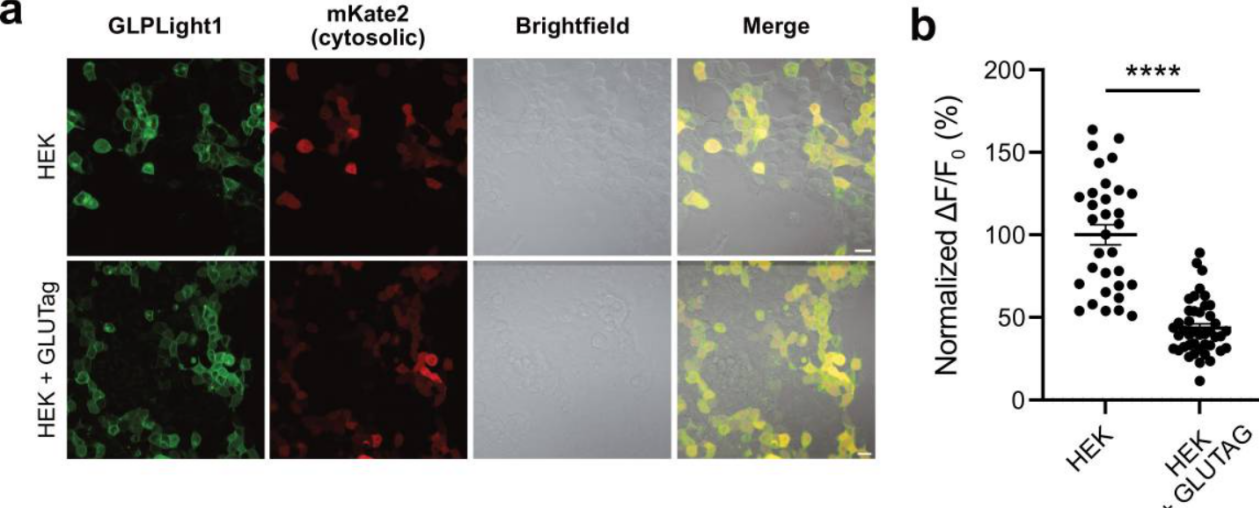
图3 GLPLight1检测细胞内源性胰高血糖素样肽- 1 ( GLP-1 )的释放
接着,研究人员使用GLPLight1建立了一个全光学检测方法,用于体外表征photo-GLP1,探究光学控制GLP1R激活的可行性。photo-GLP1是一种新型的光敏GLP-1衍生物,通过在GLP1肽链N端添加光笼分子(photocaging Molecule)构建而成,在LED光(λ=370 nm,0.64 mW/mm2)下进行20分钟的照射可产生野生型GLP1。研究结果发现,增加10s紫外光(405 nm)照射后,GLP1正常表达,GLPLight1的荧光明显增加,且更长时间的紫外光照射(100s)会导致更高程度的GLPLight1反应,表明GLP1可以成功解笼并在细胞上激活GLPLight1传感器。
研究人员发现GLPLight1传感器对GLP-1的反应速度受到photo-GLP1存在的影响,photo-GLP1的存在显著降低了传感器激活的速度。这表明photo-GLP1可能通过与GLP1R的细胞外域结合来影响其激活动力学。研究人员进一步利用GLPLight1探究了photo-GLP1解笼后GLP1R激活的空间信息,发现GLPLight1能够以高空间分辨率检测到GLP-1的反应,并且这种反应可以局限于细胞膜的特定区域。最后,通过使用cAMP荧光探针G-Flamp1,研究人员证实了解笼photo-GLP1可以控制hmGLP1R激活后的功能性信号传导,实现了对GLP1R信号传导激活的高时空分辨率的光学控制。以上结果显示GLPLight1对GLP-1衍生物的响应与天然受体相似,同时也证明了光学控制GLP1R激活的可行性。
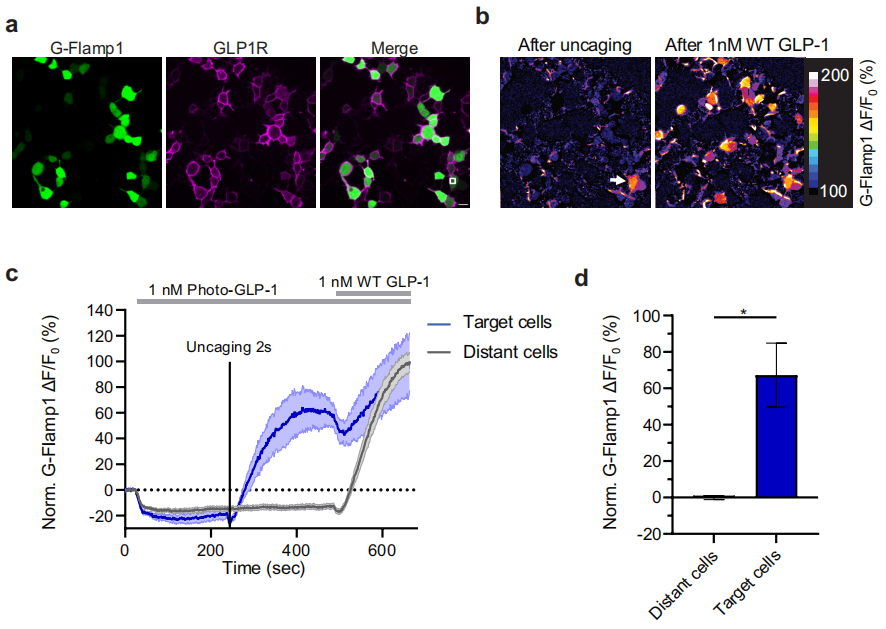
图4 photo-GLP1解笼后对细胞内信号传导的影响
此研究开发了一种基因编码的传感器GLPLight1,具有高灵敏度和时间分辨率,能够实时、高时空分辨率地响应GLP-1信号,并监测人类胰高血糖素样肽-1受体(GLP-1R)的激活动态。这为深入理解GLP-1/胰高血糖素/GLP1R信号系统在生理学中的作用,或促进针对GLP1R通路的药物筛选与开发提供了重要工具。
本文未经授权禁止转载
如有需要,可联系小编获取原文