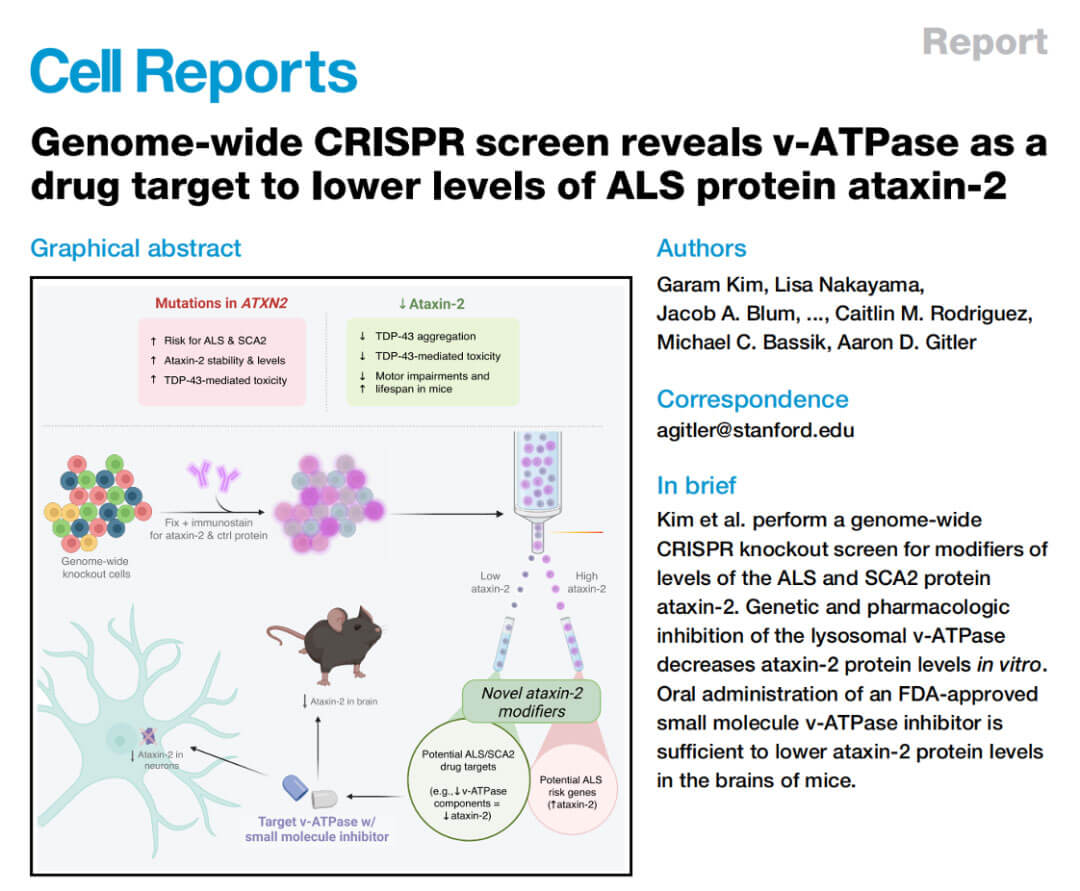
2022年10月,斯坦福大学Aaron D. Gitler教授在Cell Reports发表“Genome-wide CRISPR screen reveals v-ATPase as a drug target to lower levels of ALS protein ataxin-2”的研究工作,该研究通过全基因组CRISPR敲除结合流式细胞分选技术(FACS),筛选发现多个调控共济失调基因2(ATXN2)蛋白水平的关键基因,并通过一系列的体内体外实验验证了筛选结果中编码溶酶体囊泡ATP酶(v-ATP酶)成分的基因可以调节内源性ATXN2的蛋白水平。多种FDA批准的v-ATP酶小分子抑制剂有效降低了小鼠和人类神经元中的ATXN2的蛋白水平,并且口服这些药物中的一种(如etidronate)可以降低小鼠大脑中ATXN2的蛋白水平。
Ataxin-2(ATXN2)是一种RNA结合蛋白和应激颗粒组装的调节因子,与多种神经退行性疾病的发病机制相关,其中ATXN2基因1号外显子的CAG三核苷酸重复扩增拷贝数>32次是脊髓小脑共济失调2型(spinocerebellar ataxia type 2,SCA2)病致病原因。研究表明,未达到 SCA2 阈值的ATXN2基因中间重复扩增是肌萎缩性侧索硬化症 (amyotrophic lateral sclerosis,ALS)的危险因素。并有研究指出携带ATXN2基因中间重复扩增的ALS患者发病年龄更早、生存时间更短。
目前,一种使用反义寡核苷酸靶向ATXN2降低其蛋白水平的治疗策略已进入人体临床试验。开发新型的更安全更便宜的降低ATXN2蛋白水平的治疗方法,能够为患者提供更多的治疗选择以及减少不良反应。同时,还能够帮助我们理解ATXN2蛋白的正常调控过程。

ALS症状相对于SCA2症状的时间变化取决于ATXN2扩展的长度
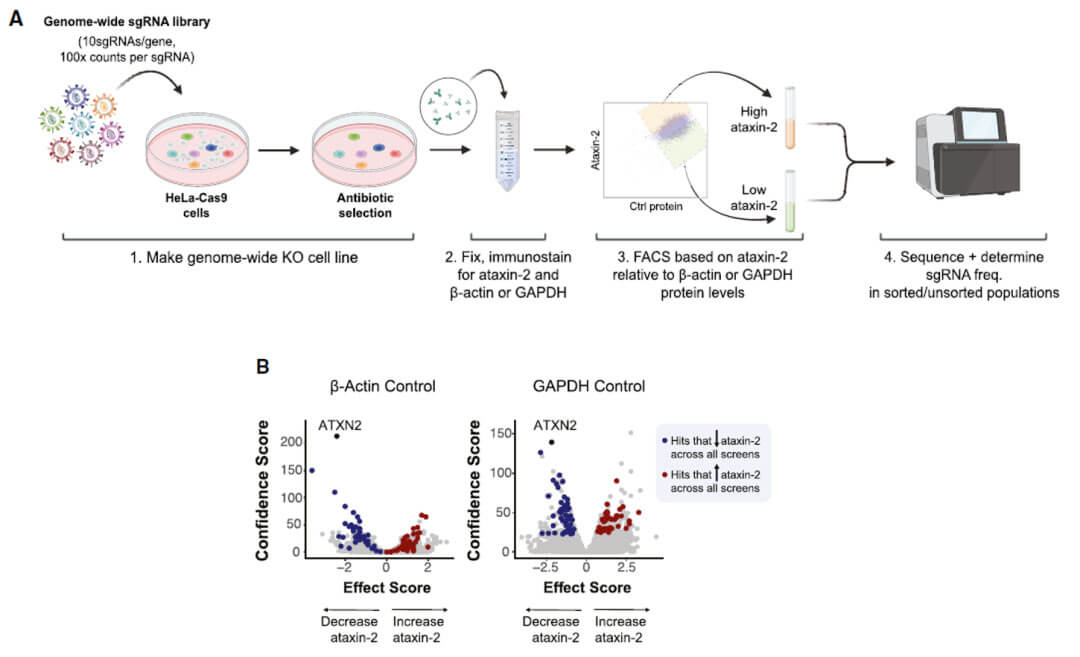
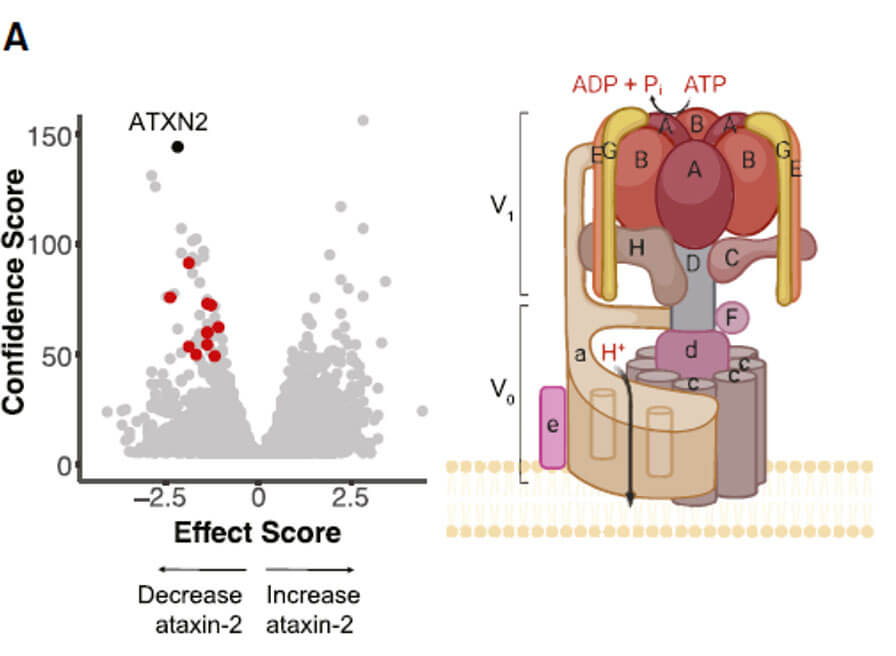
作者通过构建的CRISPR-Cas9和FACS联用的全基因组筛选方法,分选出ATXN2蛋白水平发生明显上调和下调的细胞库,对这部分细胞库进行二代测序发现影响ATXN2内源性蛋白水平的候选基因。两次实验均筛选到基因在火山图中分别以蓝色(下调ATXN2的蛋白水平)和红色(上调ATXN2的蛋白水平)表示出来。
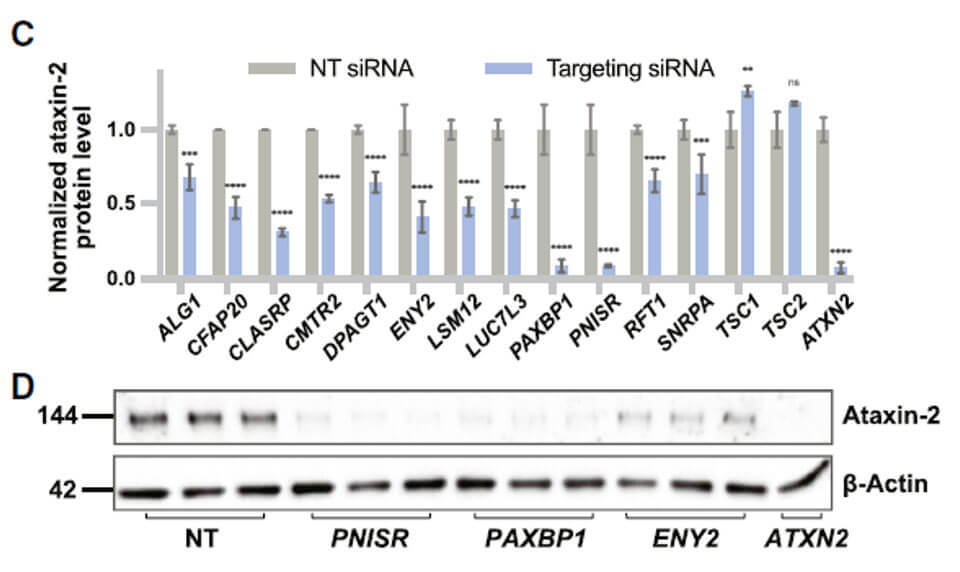
为了进一步验证筛选系统的可行性,作者通过siRNA敲低筛选出的候选基因,检测ATXN2蛋白水平的变化。验证筛选出的候选基因的确能够影响ATXN2的蛋白水平。
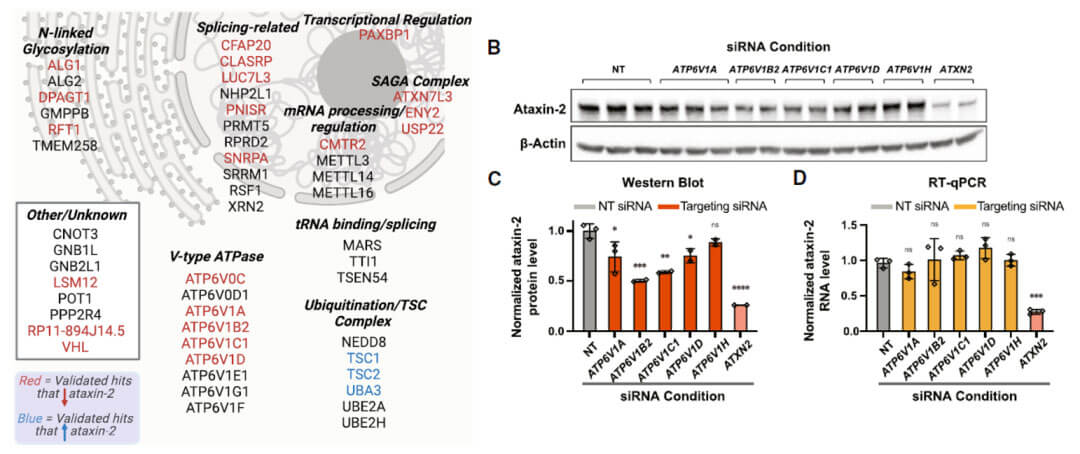
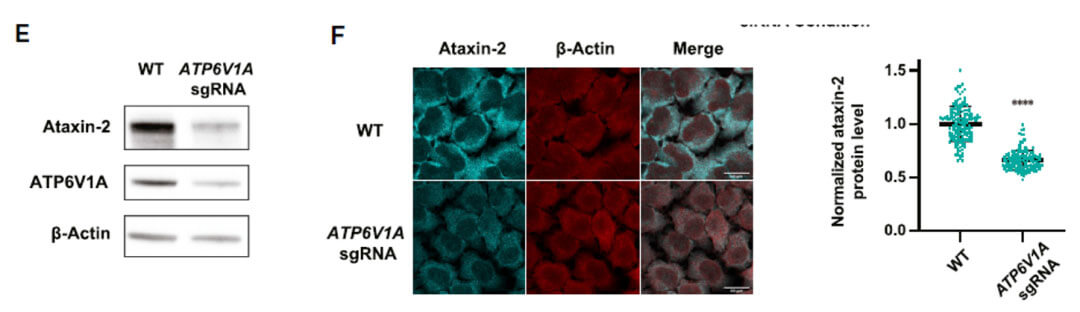
对筛选出的候选基因按功能和亚细胞定位进行分类,作者发现敲除一系列v-ATP酶(ATP6V0C,ATP6V1A,ATP6V1B2,ATP6V1C1,ATP6V1D)都会降低ATXN2的蛋白水平。并通过siRNA敲低的方式进行了蛋白水平上的验证,v-ATP酶的敲除只影响ATXN2的蛋白水平但是不影响mRNA的水平,暗示着v-ATP酶的敲除影响了ATXN2蛋白的降解。(作者并没有解释是通过蛋白酶体还是溶酶体发生的降解)
v-ATP酶是真核生物细胞内膜系统中发现的ATP水解驱动质子泵,主要通过水解ATP产生的能量维持氢离子转运,从而产生跨膜电化学梯度并实现生物膜内外PH值调节作用。不同亚基功能异常可导致多种疾病类型,比如ATP6V0A4、ATP6V1B1基因突变引起远端肾小管酸中毒,ATP6V1C1、ATP6V1B2、ATP6V0A3、ATP6V0D2基因突变则导致骨发育及代谢方面的疾病,而ATP6V1C1在乳腺癌的发病机制中发挥一定作用。也有研究证明 ATP6V0A4、ATP6V1B2基因突变常伴随严重的感音神经性耳聋。随着神经生物学研究的日益深入,v-ATP酶在神经系统性疾病中的作用也逐渐受到关注。
利用CRISPR-Cas9技术,构建ATP6V1A敲除的细胞系,通过检测蛋白水平和免疫荧光的手段,ATP6V1A敲除的确减低ATXN2的蛋白水平。
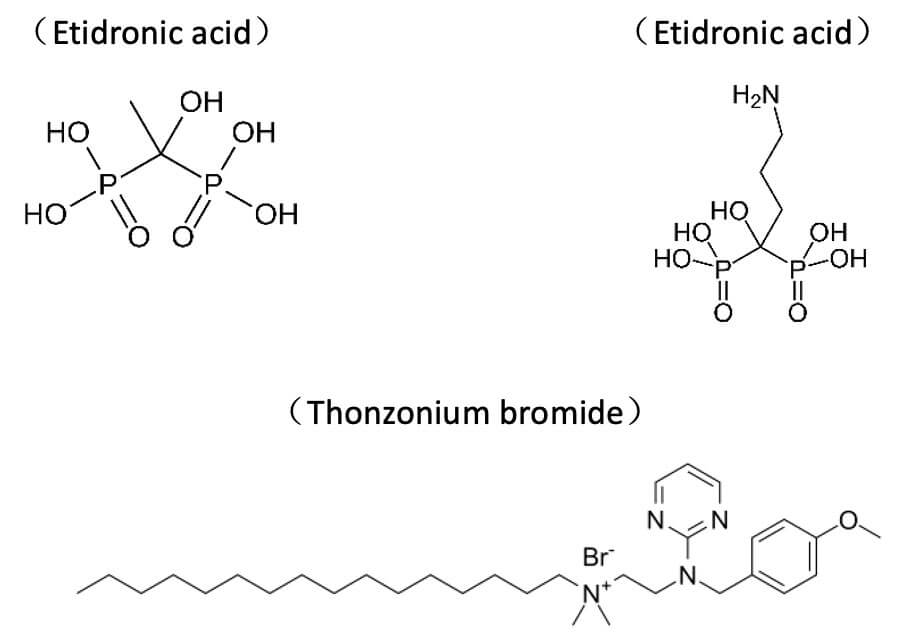
为了找到能够通过调控v-ATP酶的功能影响ATXN2蛋白水平的小分子抑制剂,作者找到三个FDA批准的药物(Etidronate,Alendronate 和 Thonzonium,前两者作为双磷酸盐类,其与无机焦磷酸的相似性导致其可以抑制v-ATP酶的活性,后者通过解除v-ATP酶质子泵的质子运输和ATP酶活性的联接来发挥抑制作用),Etidronate由于其较好的安全性,作者对其进行了进一步的研究。
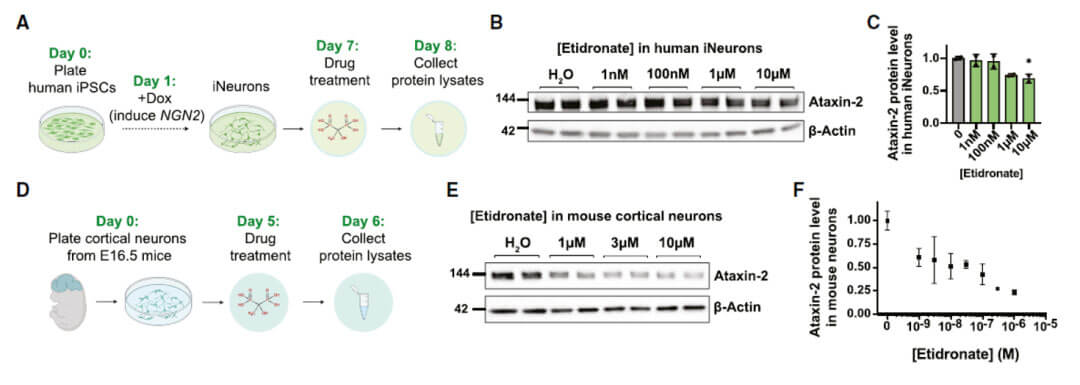
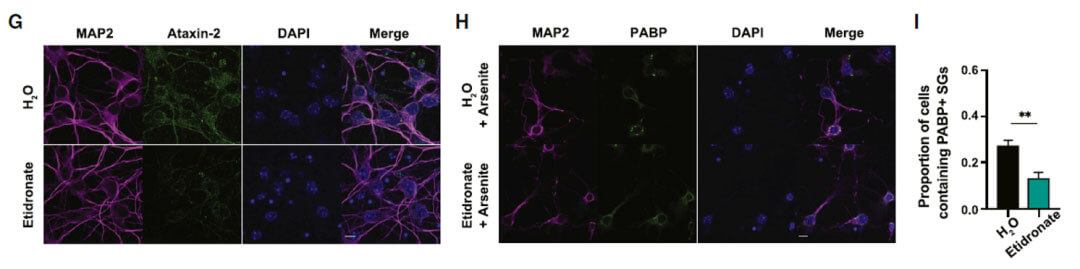
使用Etidronate处理两种不同方式来源的原代神经元细胞能够明显下调ATXN2的蛋白水平,并具有明显的剂量依赖效应。
使用Etidronate处理同样能够缓解亚砷酸盐诱导所形成的应激颗粒。
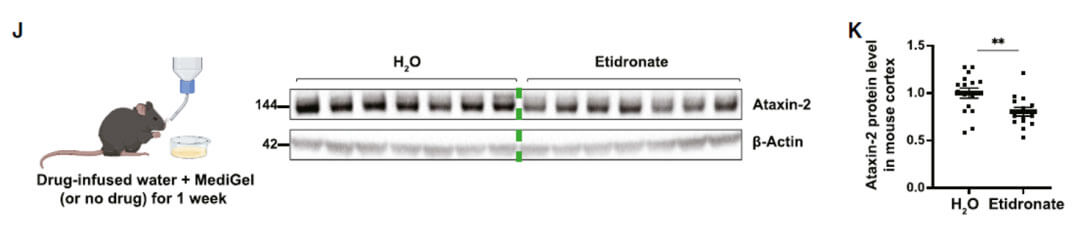
小鼠口服Etidronate一周后,能够明显降低大脑皮层中ATXN2的蛋白水平。
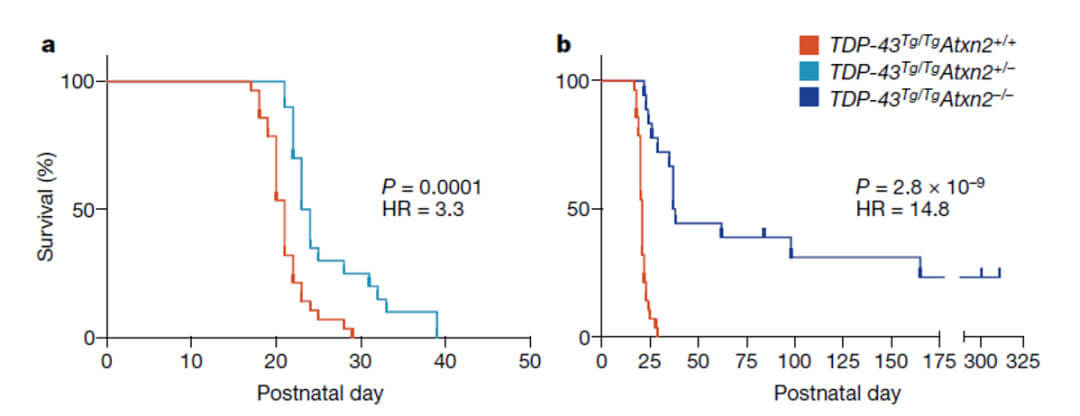
如同作者在讨论部分所提及的,该研究仍有一定的局限性,虽然观察到小鼠口服Etidronate后ATXN2蛋白水平的下降,但是Etidronate能否缓解相应的运动障碍以及神经退行性相关的表型仍不清楚。因为在作者另一篇文章中发现,相应的小鼠模型(TDP-43Tg/Tg)在未能够独立进食之前已发生死亡,所以限制了Etidronate的使用。不过,介于Etidronate能够很好的降低体内ATXN2的蛋白水平,作者相信Etidronate能够作为新的治疗药物在ALS或SCA2中发挥作用。
总之,本文提出v-ATP酶是肌萎缩性侧索硬化症和脊髓小脑共济失调2型的药物靶点,并证明了基于CRISPR-Cas9和FACS的筛选体系在鉴定疾病相关蛋白和药物研发中的价值,研究思路值得借鉴和学习。