浙江大学医学院胡海岚研究组在《中国科学:生命科学》中文版发表题为“神经元活动依赖工具开发应用的研究进展与展望”的综述文章[1],对各种活动依赖工具的原理及应用进行了总结与评述,文中提到Guenthner等人[2]通过活性类群靶向重组工具(targeted recombination in active populations,TRAP)最早实现了活性神经集群的永久性标记。他们将CreERT2敲入c-fos及Arc启动子的后面分别制备了FosTRAP和ArcTRAP小鼠,通过结合Cre依赖的携带目的基因的小鼠或是病毒进行特定时间区间内活性神经集群的标记。Allen等人[3]通过将iCreERT2基因由2A连接敲入完整的c-fos基因的后面进一步开发了TRAP 2小鼠,成功解决了TRAP小鼠存在的表达干扰问题,显著提升了工具的信噪比。
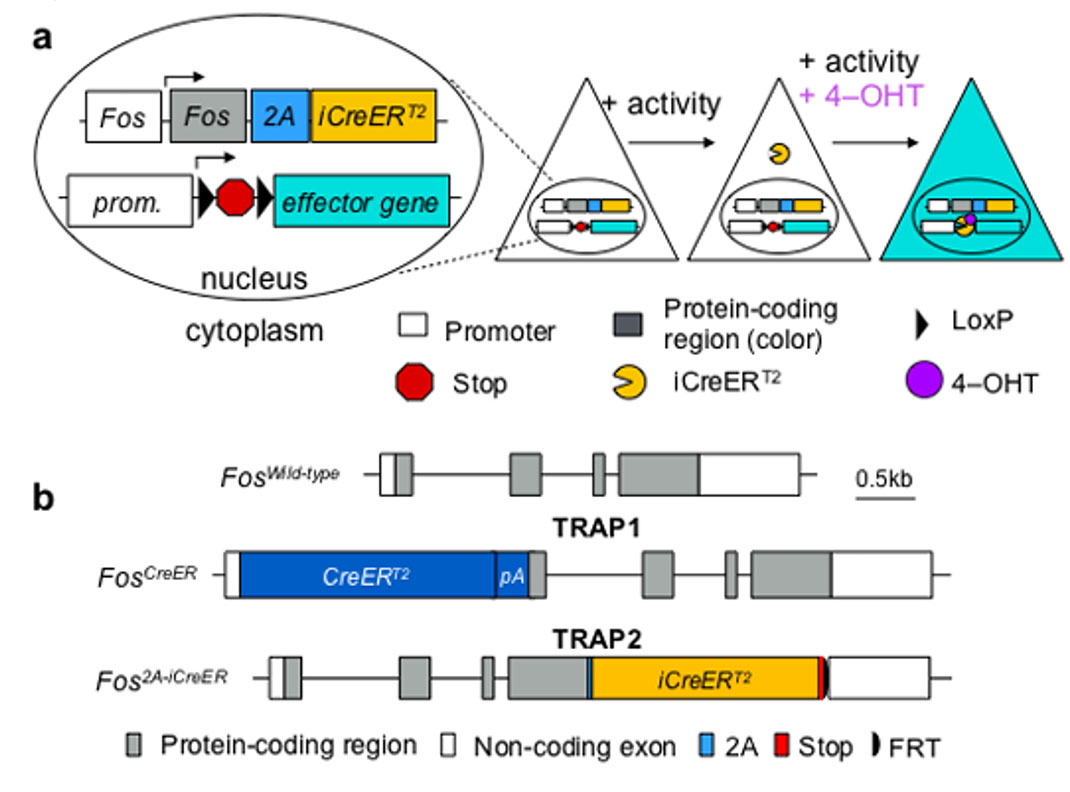
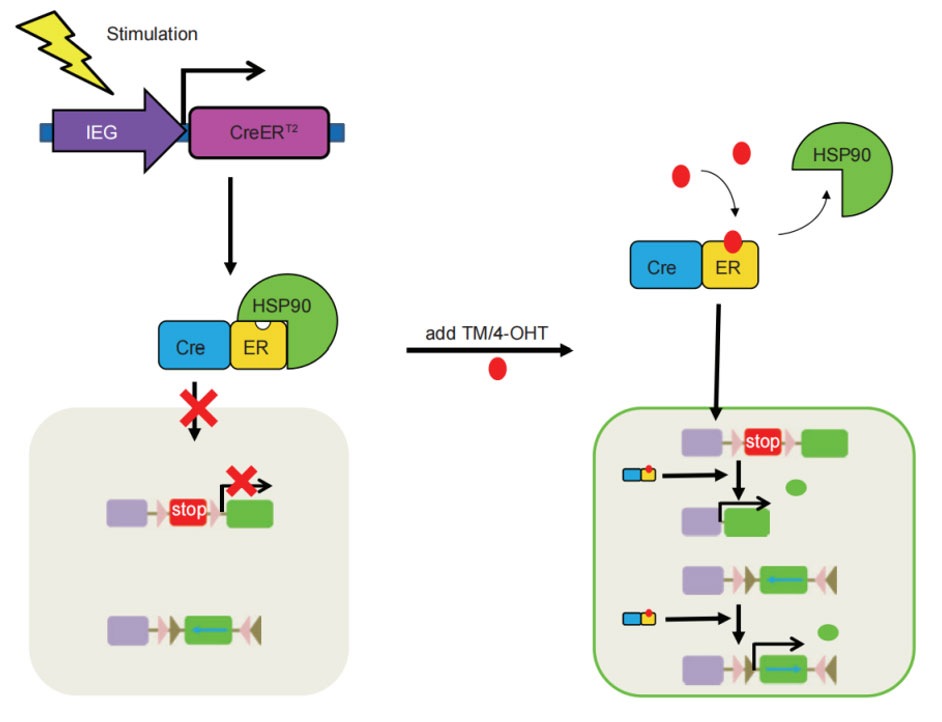
在Cre元件的C端接上雌激素受体(ER)的配体结合结构域,目前使用最多的是Cre-ERT2突变体,融合蛋白Cre-ERT2不能入核,定位在胞浆内,当雌激素衍生物他莫昔芬tamoxifen结合到Cre-ERT2受体结合结构域后,蛋白才会通过构象变化从锚定蛋白HSP90上解离下来,进入细胞核,识别loxP位点并发生重组。通过控制tamoxifen的注射时间,就可以调控基因重组的时间特异性。
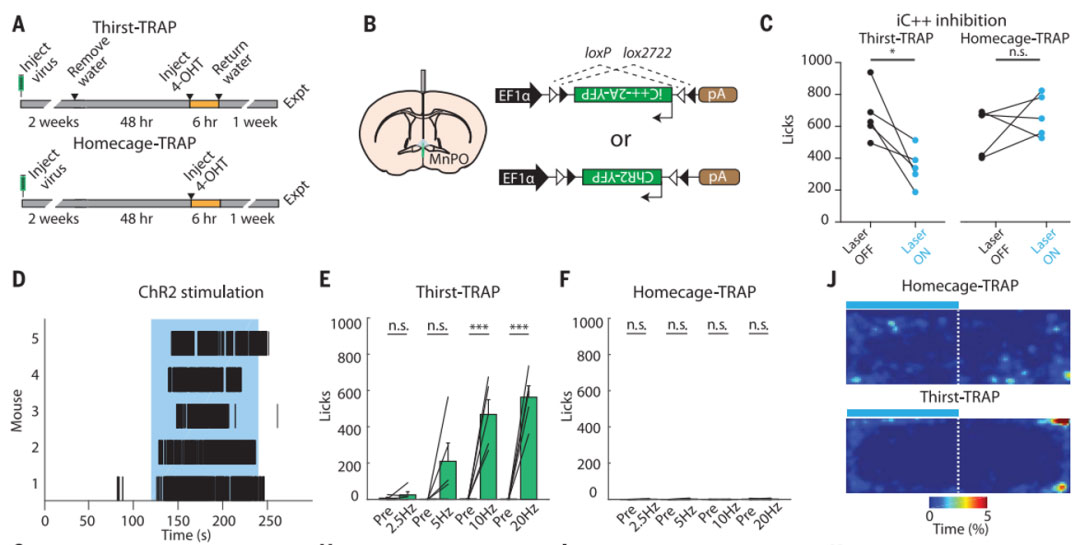
斯坦福大学的骆利群与Karl Deisseroth研究团队于2017年9月15日在Science期刊上发表题为“Thirst-associated preoptic neurons encode an aversive motivational drive”的研究论文[3],将TRAP2小鼠与AAV工具病毒结合的方式可使负责某种行为的神经元在人为的控制下永久地带上颜色,来实现特定时间窗内被激活的神经元的光遗传操控。研究者们将病毒AAV1-EF1a-DIO-ChR2-eYFP或AAV1-EF1a-DIO-iC++-TS-p2A-eYFP注射TRAP2小鼠在正中视前核(MnPO)脑区,连续48小时不给小鼠水喝,最终使老鼠脑内负责渴的神经元被光遗传元件标记,结果显示光抑制能减少水被剥夺小鼠对水的消耗,光激活能促进正常小鼠对水的消耗。MnPO可能是渴的大脑环路中的重要的一环,随后利用其波长的特征将这些带颜色的“渴神经元”分离出来。对从MnPO分离出的神经元的基因转录组进行分析,研究者发现,这一区域负责渴的神经元是谷氨酸能的兴奋性神经元。
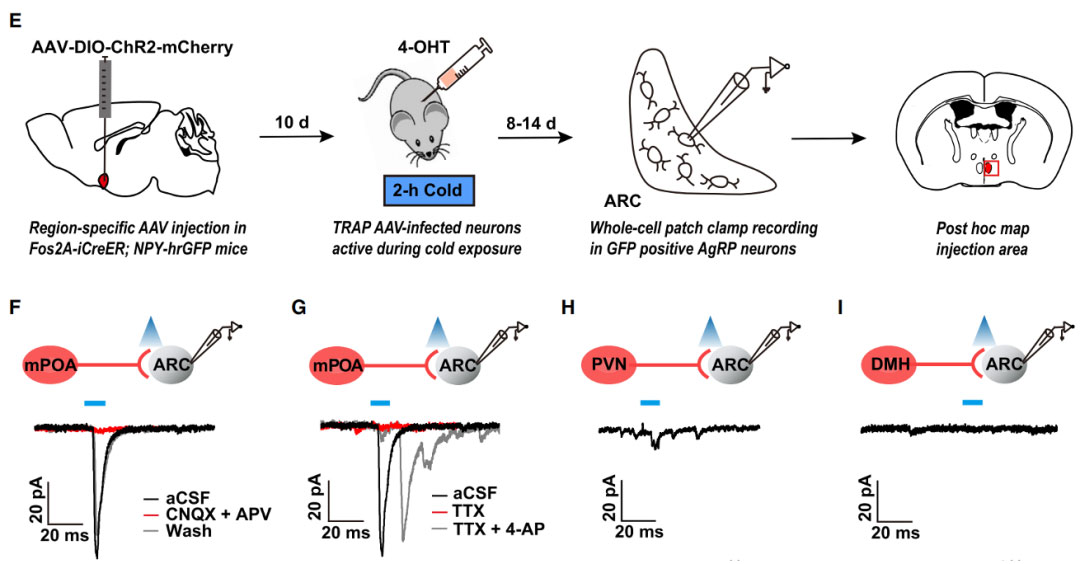
2021年8月10日,上海交通大学医学院黄菊研究员团队在期刊Cell Reports上发表一篇题为“An mPOA-ARCAgRP pathway modulates cold-evoked eating behavior”的新研究[4]。研究人员发现AgRP神经元在寒冷环境中被激活,并在功能上验证了mPOA-ARCAgRP神经通路对于寒冷诱发的进食行为是必要且充分的。为了验证mPOA-ARCAgRP通路介导了冷诱发的摄食行为,研究人员借助TRAP2小鼠,将病毒AAV-DIO-ChR2-mCherry注射在Fos2A-iCreER小鼠mPOA脑区,在寒冷暴露后10天给予4-OHT以诱导ChR2的表达,通过光遗传学激活冷反应性mPOA神经元到ARC的轴突投射末端可以显著增加进食次数和进食时间,表明激活mPOA-ARCAgRP通路可以引发寒冷诱发的摄食行为。
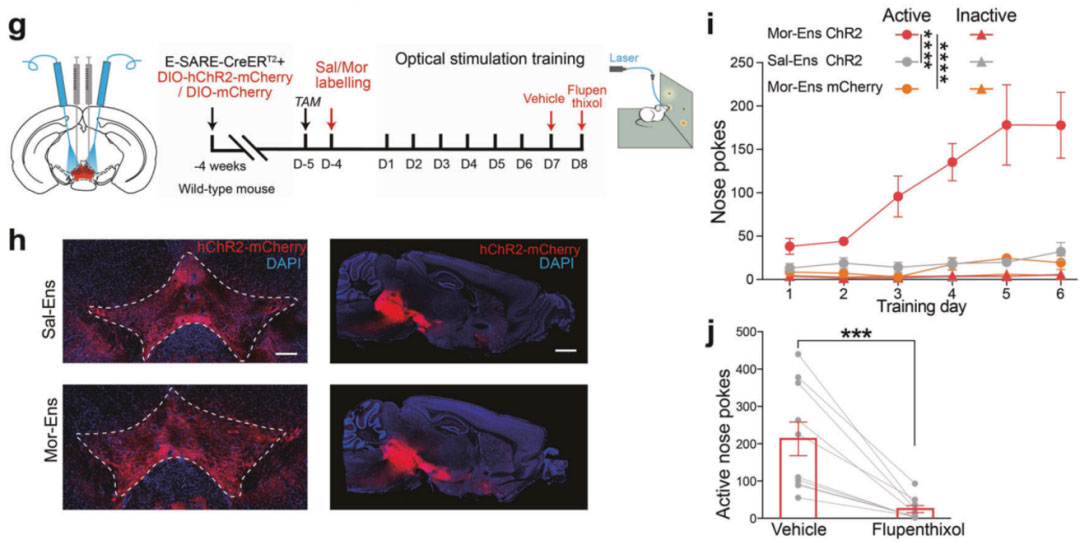
复旦大学脑科学研究院马兰/王菲菲团队于2021年10月12日在Molecular Psychiatry发表题为“CRHCeA→VTA inputs inhibit the positive ensembles to induce negative affect of opiate withdrawal”研究论文[5]。研究人员借助响应神经元活性的功能元件--E-SARE(AAV-E-SARE-CreERT2)标记中脑边缘系统的重要脑区腹侧被盖区(VTA)吗啡初次暴露激活的神经元集群(吗啡神经元集群),发现VTA吗啡神经元集群偏向性地投射到伏隔核(NAc)脑区。研究人员在小鼠VTA区注射AAV-E-SARE-CreERT2和AAV-DIO-hChR2-mCherry混合病毒并埋入光纤,吗啡暴露后标记VTA吗啡神经元集群,光激活可引起小鼠鼻触反应次数增加,使用氟哌噻醇(多巴胺拮抗剂)可抑制这一现象。同时,借助DA探针发现激活VTA吗啡神经元集群能够促进NAc多巴胺的释放。上述结果提示了VTA吗啡神经元集群偏向性地投射到伏隔核(NAc)脑区,激活VTA吗啡神经元集群能够促进NAc多巴胺的释放,引发小鼠的自给光行为,介导了多巴胺依赖的正性强化效应。
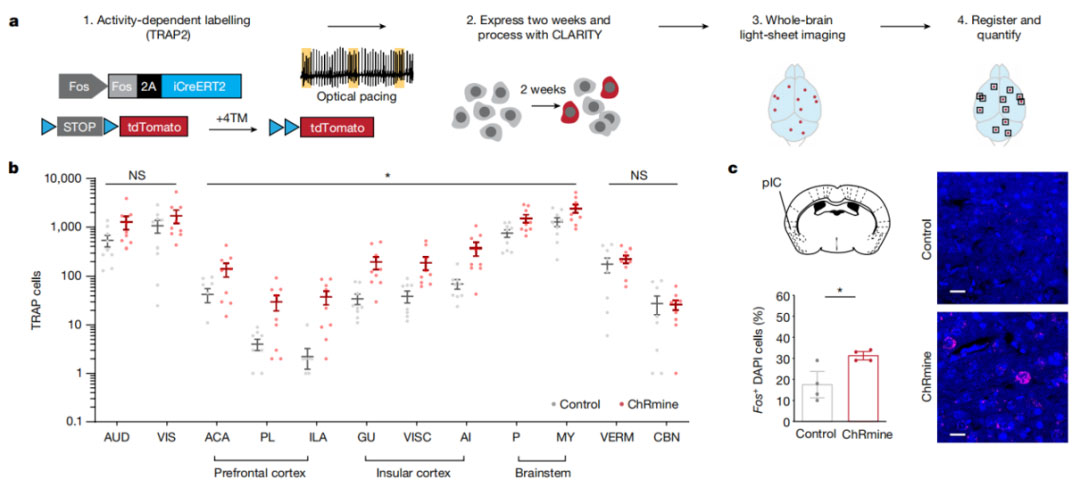
2023年3月1日, 斯坦福大学的 Karl Deisseroth 教授团队在 Nature 发表了题为“Cardiogenic control of affective behavioural state” 的研究论文,该研究证实了 心率升高与小鼠焦虑样行为的增加相关。研究者利用TRAP2小鼠筛选出受光学起搏影响的脑区,其中后岛叶皮层(posterior insular cortex)这一大脑中负责接收和处理身体信号的区域或介导了心率升高诱发的焦虑样和恐惧行为。此外,他们还发现,对后岛叶皮层的抑制能减少由光学诱导的心率升高所诱发的焦虑样行为。
[1] 王继华,胡海岚.神经元活动依赖工具开发应用的研究进展与展望[J].中国科学:生命科学, 2019, 49 (03) : 202-219.
[2] Guenthner CJ, Miyamichi K, Yang HH, Heller HC, Luo L. Permanent genetic access to transiently active neurons via TRAP: targeted recombination in active populations [published correction appears in Neuron. Neuron. 2013;78(5):773-784.
[3] Allen WE, DeNardo LA, Chen MZ, et al. Thirst-associated preoptic neurons encode an aversive motivational drive. Science. 2017;357(6356):1149-1155.
[4] Yang S, Tan YL, Wu X, et al. An mPOA-ARCAgRP pathway modulates cold-evoked eating behavior. Cell Rep. 2021;36(6):109502.
[5] Jiang C, Yang X, He G, et al. CRHCeA→VTA inputs inhibit the positive ensembles to induce negative effect of opiate withdrawal. Mol Psychiatry. 2021;26(11):6170-6186.