小布解读 | GRASP—标记活体神经系统突触连接
发布时间:2024-03-11 17:40:41
GRASP(green fluorescent protein reconstitution across synaptic partners,跨突触伴侣的绿色荧光蛋白重建)利用绿色荧光蛋白GFP检测神经元之间的距离以及是否形成突触连接,是由斯坦福大学的华人科学家沈康(Kang shen)和美国洛克菲勒大学的Cornelia I. Bargmann联合开发的,该技术可实现对活体神经系统中的突触定位。简单来说,就是将GFP分割为两个组件,分离的GFP组件不具有发光功能。在两组神经元中分别表达GFP的两个组件,当两组神经元存在突触连接时,GFP的两个组件在突触部位自动结合形成完整的具有功能的GFP,此时突触结构产生绿色荧光。如果两组神经元不存在突触连接,则不产生荧光。
示例1:小鼠脑内mGRASP的检测
2011年,美国霍华德-休斯医学研究所、韩国科学技术院及浙江大学等机构的研究人员在Nature Methods上发表题为“mGRASP enables mapping mammalian synaptic connectivity with light microscopy”的研究论文,对携带GFP组件的载体进行了改造,开发出了哺乳动物GRASP(mGRASP)技术,可以实现小鼠大脑中神经元突触的定位,实现了光学显微镜下快速准确重建哺乳动物大脑神经网络。通过mGRASP可以观察这些疾病下神经网络发生了怎样的变化,从而推断其病理机制。
在小鼠左脑半球CA3神经元中表达非Cre依赖的pre-mGRASP(rAAV CAG-pre-mGRASP-mCerulean),在右脑半球中表达Cre重组酶依赖post-mGRASP(rAAV CAG-Jx-rev-post-mGRASP-2A-dTomato)。分裂- GFP片段在单独表达时都不发出荧光,但mGRASP是跨突触重组的,在mCerulean标记的CA3轴突和dTomato标记的CA1树突相交的位置,沿着dTomato标记的CA1顶端和基部树突显示离散的荧光点(图1B,C)。
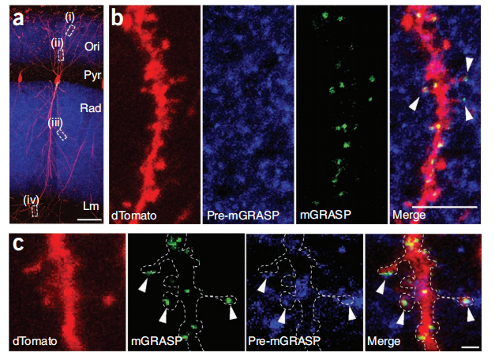
图1:海马CA3-CA1连通的mGRASP重构。
- 单个CA1神经元中重组mGRASP荧光的离散点。(B,C)裁剪高放大图像,其中蓝色轴突与红色树突相交(箭头)重构的mGRASP信号。比例尺,5µm(B)和1µm(C)。
示例2:mGRASP变体的选择和实验策略
2014年,美国霍华德-休斯医学研究所、韩国科学技术院及浙江大学等机构的研究人员在Nature Protocols上发表题为“Using mammalian GFP reconstitution across synaptic partners (mGRASP) to map synaptic connectivity in the mouse brain”的研究论文,作者介绍了几种具有Cre依赖性和荧光颜色选择的mGRASP变体,以便在实验策略中进行选择。这些mGRASP病毒构建体与大量Cre系相结合,可以选择和诱导突触标记,从而可以研究许多类型神经回路中的突触连接模式,如细胞类型特异性的局部和远程连接(图2)。

图2:mGRASP变体的原理图和mGRASP辅助电路映射的实验设计
- mGRASP变体示意图。(B,C)通过将mGRASP AAV变体注射到野生型(非特异性)或细胞类型特异性Cre小鼠系感兴趣的大脑区域,可以绘制出各种远程(B)和局部回路(C)。
示例3:Dual-eGRASP区分单个神经元上的两个突触群
2018年首尔国立大学生物科学学院研究人员在Science上发表题为“Interregional synaptic maps among engram cells underlie memory formation”的研究论文,为了比较神经元中两个不同的突触前群体投射到单个突触后神经元,作者对GRASP技术进行了改进,开发了一种增强的GRASP(eGRASP)技术,该技术通过引入一个弱相互作用域来促进GFP重构,增强GRASP信号强度,并进一步进化eGRASP以重建青色或黄色荧光蛋白(图3A,B)。将颜色决定域置于突触前神经元(青色/黄色pre-eGRASP),将共同域置于突触后神经元(post-eGRASP),可以可视化两个突触群,这两个突触群来自两个不同的突触前神经元群,并投射到单个突触后神经元,作者将这种技术命名为dual-eGRASP(图3A)。作者成功地将这项技术应用于齿状回(DG)颗粒细胞上的突触,这些细胞分别来自外侧内嗅皮层(LEC)或内侧内嗅皮层(MEC),它们分别投射到DG的外层和中间分子层(图3D)。
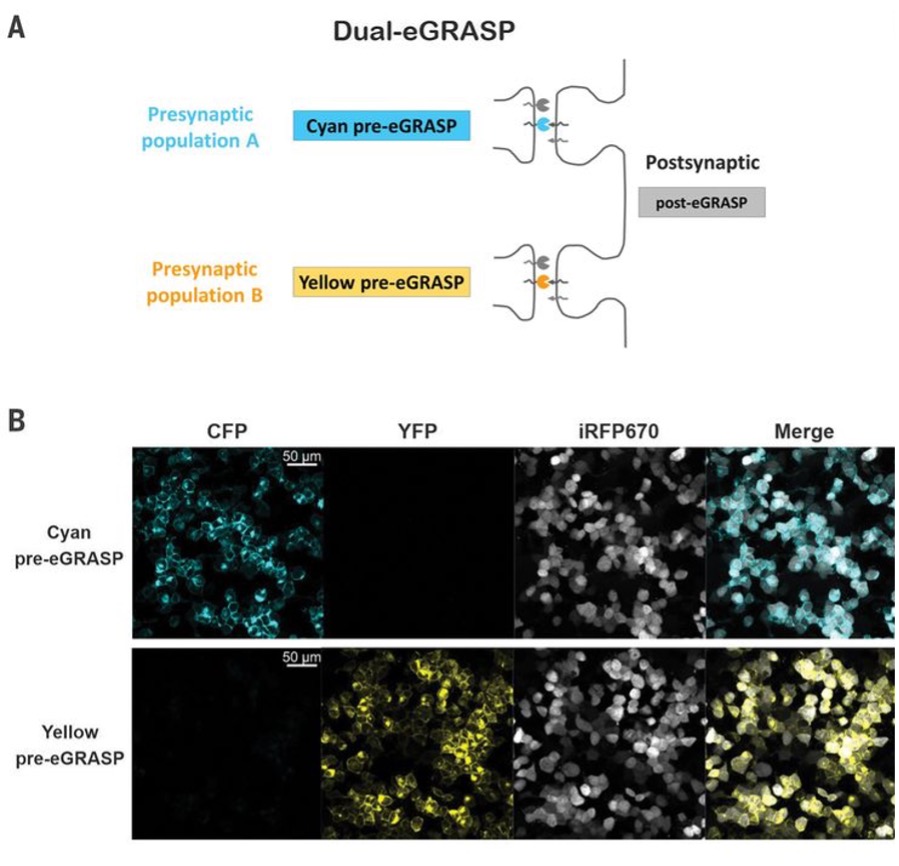
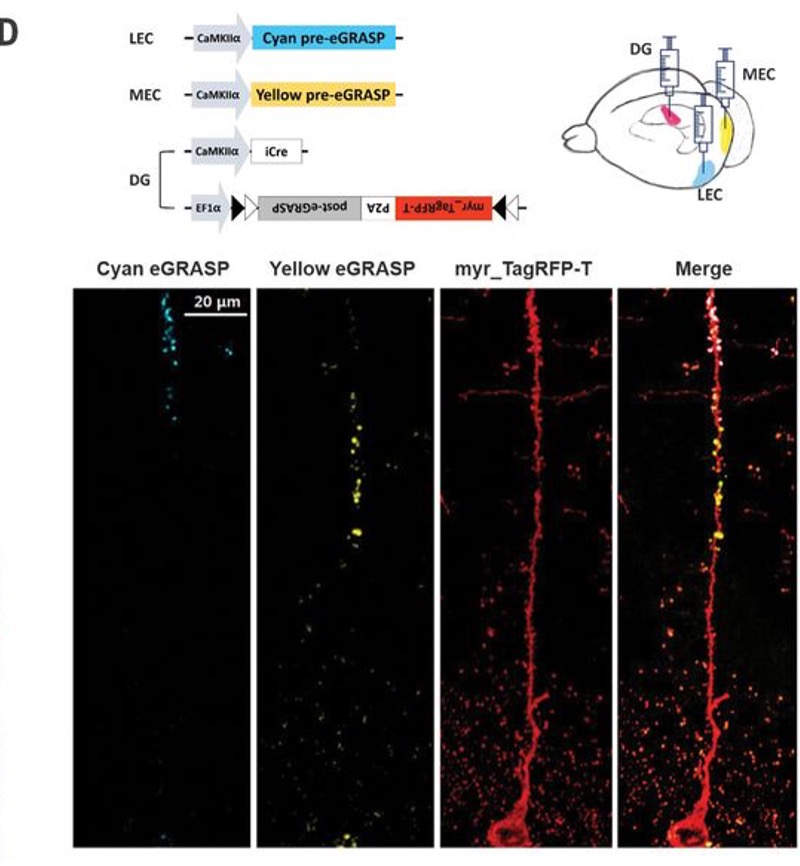
图3:Dual-eGRASP区分单个神经元上的两个突触群。
(A,B)青色和黄色eGRASP示意图。青色pre-eGRASP和黄色pre-eGRASP在两个不同的突触前细胞中表达,而普通的post-eGRASP在单个突触后细胞中表达。(D))LEC和MEC分别表达青色和黄色的pre-eGRASP,DG中post-eGRASP与肉豆蔻酰基化TagRFP-T (myr_TagRFP-T)一起表达。
示例4:利用mGRASP标记PTSD小鼠MD投射到ACC的局部微环路
利用mGRASP测试PTSD小鼠中增强的MD突触输入是否重塑了ACC的局部突触连接。该技术基于在突触前和突触后神经元中表达两个功能互补的非荧光GFP片段(AAV2/8-CAG-pre-GRASP-mCerulean AAV2/8-CAG-DIO-post-GRASP-P2A-tdTomato, Braincase (shenzhen)),专门标记MD和ACC两个神经元群体之间的突触,以获得更准确和特异性的可视化(图4M)。实验结果显示,WT小鼠ACC区PV+神经元的丘脑皮质突触频率明显高于锥体神经元(也就是CaMKII+神经元),这意味着MD和ACC PV+神经元之间可能存在更强的联系(图4N,O)。与WT小鼠相比,PTSD小鼠中的PV+中间神经元的丘脑皮质突触数量增加(图4Q,S)。而锥体神经元的突触在两组小鼠之间没有显著性差异(图4P,R)。说明在PTSD小鼠的恐惧消退过程中,MD优先投射到ACC的PV+神经元。
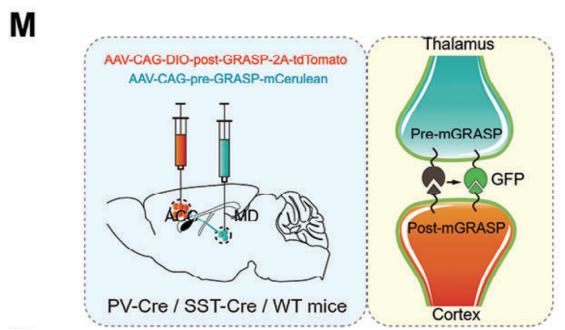
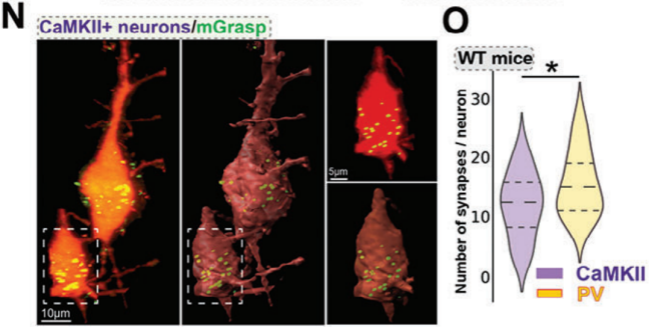
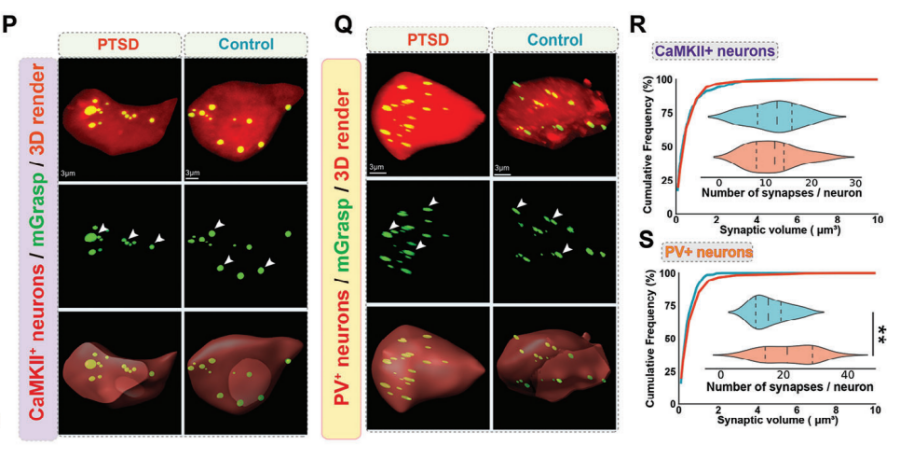
图4:在PTSD小鼠的恐惧消退过程中,MD优先投射到ACC中的PV+神经元
(M)使用PV-Cre、SST-Cre或CaMKII-Cre病毒标记突触的机制示意图。(N,O)WT小鼠丘脑皮质CaMKII+与PV+神经元突触频率高倍共聚焦图像(N)和量化图(O)。(P,Q)ACC中mGRASP标记的CaMKII+神经元(P)/ PV+神经元(Q)与突触(绿色)的高倍共聚焦(上)和3D图像(中、下)。(R,S)WT小鼠与PTSD小鼠丘脑皮质CaMKII+神经元(R)/ PV+神经元(S)突触频率量化图。
研究人员通过进一步对载体进行改造,开发出来的哺乳动物GRASP(mGRASP)和强化版双GRASP技术(dual-eGRASP)技术,不仅可以实现了小鼠大脑中神经元突触的定位,结合化学技术与计算机生物图像信息学技术,实现高通量的神经网络重建,而且可以用于神经系统疾病的研究,比如抑郁症、帕金森、癫痫等神经疾病可能存在神经元的异常连接,通过GRASP可以观察这些疾病下神经网络的变化,从而推断病理机制。
布林凯斯可提供及定制GRASP相关产品,现货产品如下:
| 产品类型 |
产品编号 |
产品名称 |
| 荧光标记 |
BC-1424 |
rAAV-EWB-DIO-myriRFP670V5-P2A-post-eGRASP |
| BC-1425 |
rAAV-CWB-pre-eGRASP(p30) |
| BC-1626 |
rAAV-CAG-pre-mGRASP-mCerulean |
| BC-1627 |
rAAV-CAG-DIO-post-mGRASP-T2A-dTomato-WPREs |
| BC-2371 |
rAAV-CAG-DIO-pre-mGRASP-miRFP670nano3-WPRE-hGH polyA |
| BC-2372 |
rAAV-CAG-post-mGRASP-T2A-dTomato-WPREs |
参考文献
- Feinberg EH, Vanhoven MK, Bendesky A, et al. GFP Reconstitution Across Synaptic Partners (GRASP) defines cell contacts and synapses in living nervous systems. Neuron. 2008;57(3):353-363.
- Kim J, Zhao T, Petralia RS, et al. mGRASP enables mapping mammalian synaptic connectivity with light microscopy. Nat Methods. 2011;9(1):96-102.
- Feng L, Kwon O, Lee B, Oh WC, Kim J. Using mammalian GFP reconstitution across synaptic partners (mGRASP) to map synaptic connectivity in the mouse brain. Nat Protoc. 2014;9(10):2425-2437.
- Choi JH, Sim SE, Kim JI, et al. Interregional synaptic maps among engram cells underlie memory formation. Science. 2018;360(6387):430-435.
- Xiao H, Xi K, Wang K, et al. Restoring the Function of Thalamocortical Circuit Through Correcting Thalamic Kv3.2 Channelopathy Normalizes Fear Extinction Impairments in a PTSD Mouse Model. Adv Sci (Weinh). Published online December 16, 2023.






