近年来,经工程化改造表达嵌合抗原受体(CAR)的T细胞在治疗血液系统恶性肿瘤方面具有变革性进展。CAR-T细胞的构建过程中,最常见的重组基因传递载体是复制缺陷逆转录病毒,如γ-逆转录病毒(γ-retroviruses,gRVs)或慢病毒,但这两类病毒载体会随机整合到细胞基因组中,导致T细胞功能异质性、转入基因沉默,甚至可能激活细胞癌变,这限制了细胞治疗产品的有效性和安全性。
基因编辑技术已实现在原代人类T细胞中精确整合转基因,这拓宽了基础研究和临床中工程T细胞改造的范围。腺相关病毒(AAV)是应用最广泛的体内基因治疗递送载体,通常不会整合到宿主基因组中,具有效率高及毒性小的特性,因此可作为T细胞基因工程改造的更安全的递送载体。然而,到目前为止,还没有一种AAV血清型能够高效转导小鼠T细胞。
2023年1月12日,加州大学旧金山分校Justin Eyquem团队和杜克大学医学院Asokan团队在 Cell 期刊发表了An evolved AAV variant enables efficient genetic engineering of murine T cells 一文。

该研究在AAV6的基础上利用饱和突变筛选出了一种高效转导小鼠T细胞的AAV变体Ark313,并通过CRISPR全基因组筛选确定QA2是Ark313高效转导的重要因素。Ark313可用于无核苷转染的DNA递送,CRISPR-Cas9介导的敲除以及大型转基因的靶向整合。Ark313能够实现向小鼠T细胞的高效转基因递送和大片段DNA的有效精确靶向整合,可用于构建更安全更精确的CAR-T和TCR-T细胞。这种高效的基因靶向为提高细胞治疗效率和进行T细胞免疫提供新的可能。
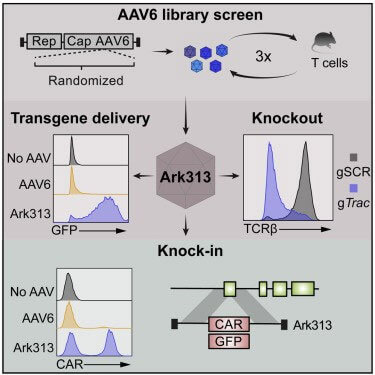
高靶向小鼠T细胞血清型Ark3筛选
作者首先对AAV2/6基因组(AAV2 Rep基因、AAV6 Cap基因)进行饱和诱导突变,突变主要发生在衣壳蛋白VP3亚基的可变区IV(454-460),该区段参与宿主细胞入侵及中和抗体诱导。进一步利用C57BL/6J小鼠脾细胞的原代T细胞对衣壳蛋白文库进行筛选,获得高靶向小鼠T细胞血清型Ark313。Ark313对鼠源T细胞的结合、吸收比例及转导效率均显著高于AAV6,这表明鼠源T细胞中存在特异性宿主因子促进Ark313的结合和吸收。最后通过CRISPR的全基因组敲除筛选,确定小鼠QA淋巴细胞抗原2(QA2)是是Ark313转导的必需宿主因子。
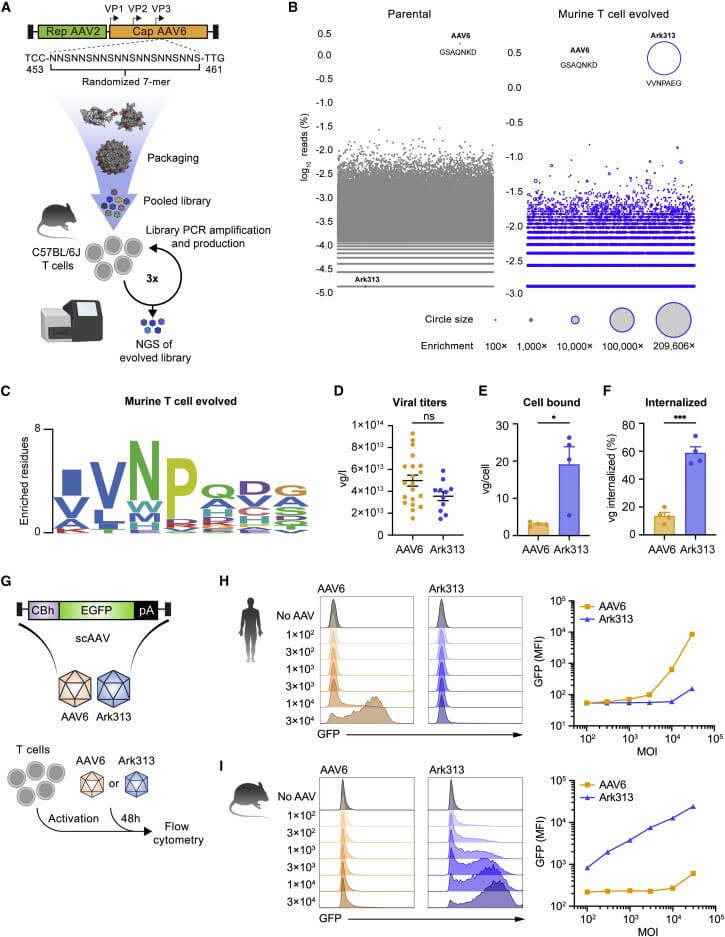
图1、结构引导的进化鉴定出具有鼠T细胞嗜性的AAV衣壳变异体
作者首先检测Ark313靶向Trac递送sgRNA表达盒的能力,流式细胞检测敲入率达到84%,而Ark313介导的非特异性整合是极罕见事件。其次评估了Ark313递送大片段DNA的能力,发现Ark313对HDRT(如GFP表达基因)的敲入效率可达30%-50%,远高于AAV6。为进一步减少与RNP核连接相关的细胞损失和提高编辑的细胞产量,将sgRNA与HDRT表达在单个载体上导致有效的敲入和低毒性。这些数据表明Ark313在原代鼠T细胞的瞬时基因递送和靶向整合方面的卓越性能。Ark31对HDRT和sgRNA共同递送的高转导敲入效率可促进体用于体外和体内应用的T细胞的大规模生产。
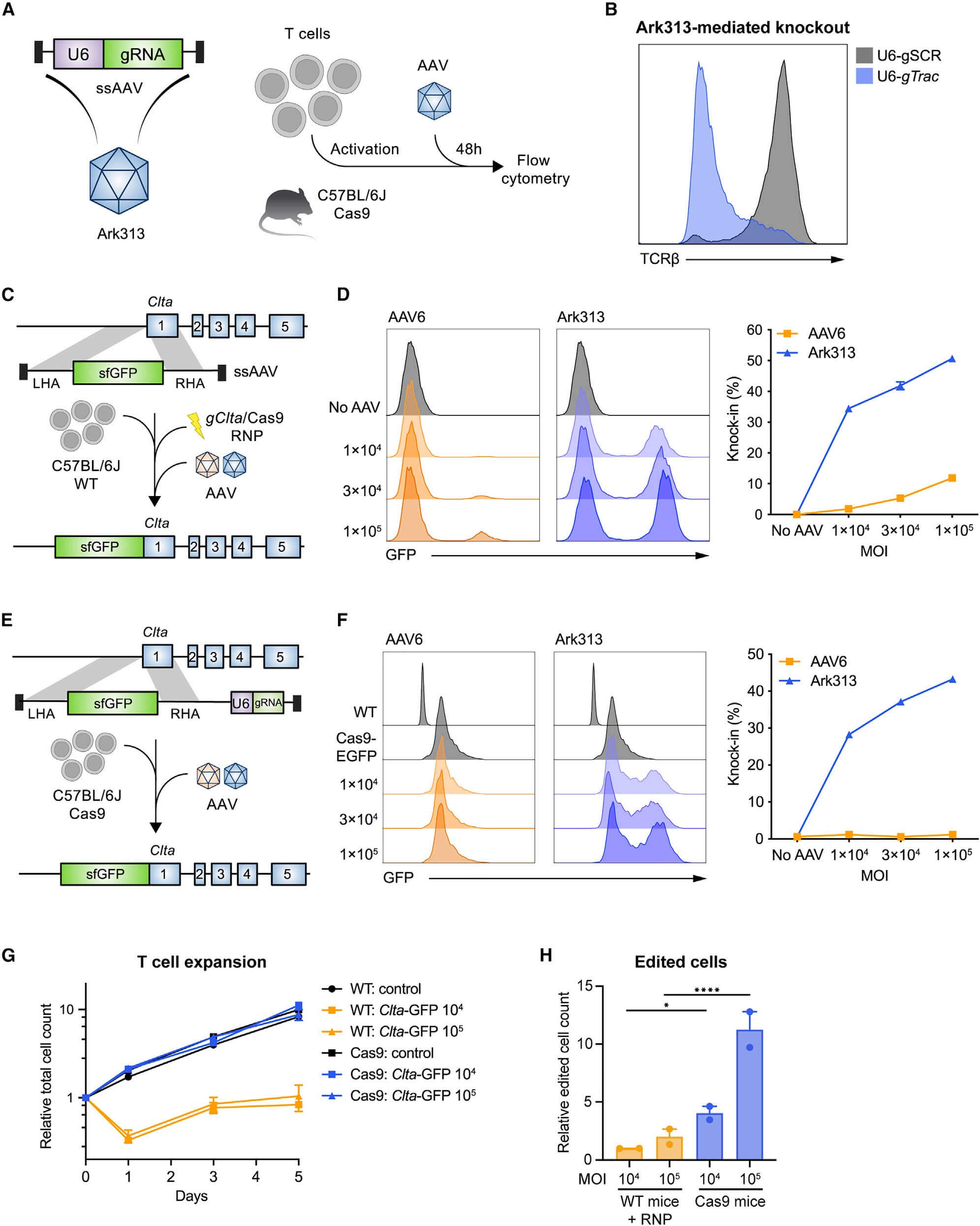
图2、Ark313可在原代鼠T细胞中实现有效的基因靶向性
作者试图利用Ark313进行T细胞改造以研究针对癌症的过继细胞疗法。首先设计一种靶向Trac外显子1的HDRT,用于在内源性启动子和与免疫治疗相关的整合受体下表达转基因(如靶向人源CD19的小鼠CAR、靶向hCD19的HIT或Trg OT-I TCR),检测结果表明Ark313介导的CAR的敲入效率可达45%,当与NHEJ抑制剂(M3814)联合使用时,Ark313介导的敲入效率可达75%。另外靶向hCD19的T细胞对表达抗原的细胞展示出显著的细胞毒性。当选择两个独立的Ark313载体分别靶向Clta和Trac基因时,超过8%的细胞实现了双重敲入,这进一步突出了Ark313在工程复杂的基因编辑T细胞疗法中的应用潜力。
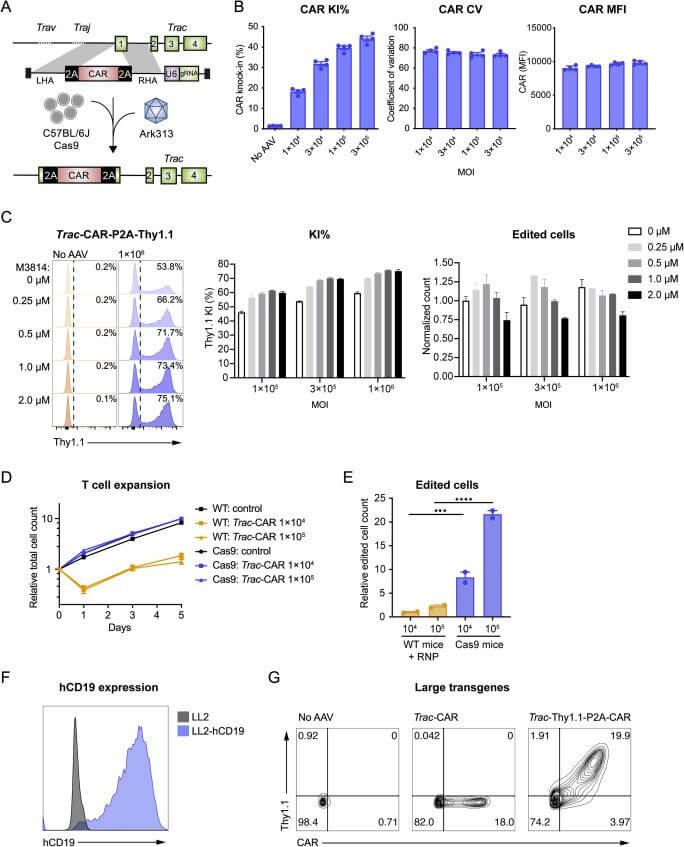
图3、将重组受体靶向Trac位点进行实验性T细胞免疫学
人TRAC-CAR-T细胞在控制B细胞急性淋巴细胞白血病(B-ALL)异种移植肿瘤方面优于逆转录病毒工程的CAR-T细胞。为探索TRAC-CAR-T细胞在免疫功能正常的实体瘤模型中是否保持优越性,作者利用Ark313构建Trac-CAR-T细胞,gRV构建CAR-T细胞,分别表达h19m28z。通过向C57BL/6J小鼠中注射LL2-hCD19细胞建模,9天后眶后注射单剂量的CAR-T细胞,结果表明gRV-CAR-T细胞在体内无法提高小鼠生存率,而Trac-CAR-T细胞可减小肿瘤大小且显著提升存活率。与人T细胞一样,抗原结合后Trac-CAR-T和gRV-CAR-T细胞的CAR表达均下降,Trac-CAR-T细胞恢复基线较慢,两次刺激后Trac-CAR-T细胞的CAR恢复表达得更快,且在刺激后中心记忆表型升高。这些发现表明了人类TRAC-CAR在小鼠实体肿瘤模型中的疗效作用,并突出了Ark313在免疫活性环境中测试下一代T细胞治疗方面的实用性。
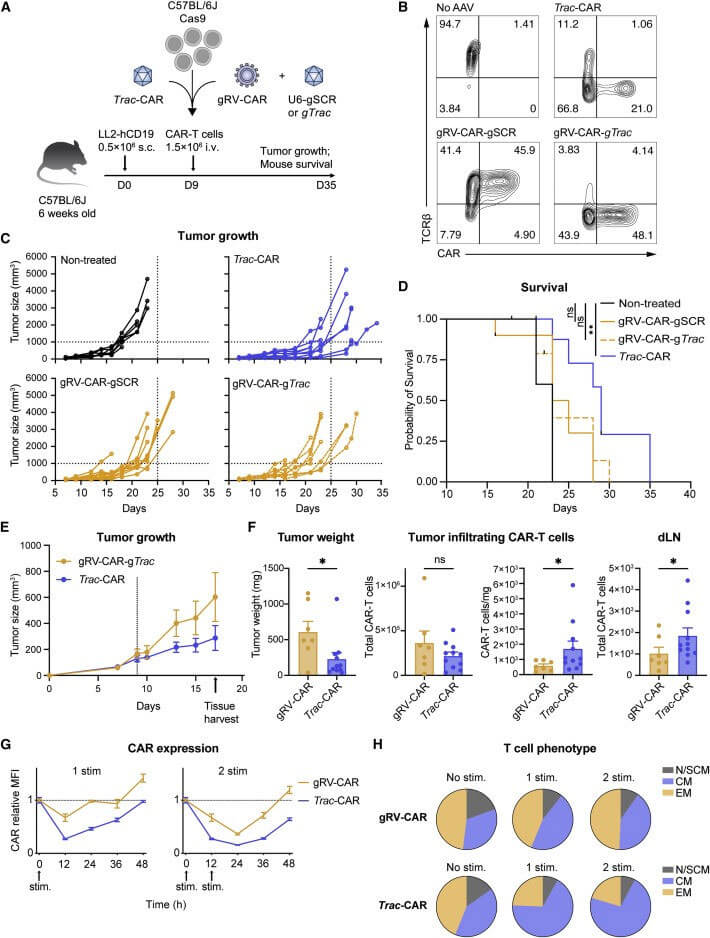
图4、免疫活性实体肿瘤小鼠模型中
综上所述,本文发现了AAV6的变体Ark313,可高效靶向鼠源T细胞,实现基因递送、大片段DNA的精确整合,另外Ark313为改进T细胞疗法提供了巨大潜力,也为T细胞免疫学研究开辟了新的道路。