“将欲取之,必姑与之。”神经环路研究中,在神经元预先补偿入胞受体实现载体重靶向(特异性感染)或预先补偿复制相关蛋白实现嗜神经病毒载体跨突触标记已成为广泛应用的策略。例如在狂犬病毒(Rabies virus,RV)示踪载体的工具化改造中:
(1)RV-EnvA-TVA系统:禽类肉瘤病毒的外膜蛋白EnvA可特异性识别受体TVA,而TVA在哺乳动物细胞中无内源性表达,预先在神经元内补偿TVA,可使EnvA假型化的RV-ΔG实现特异性感染;
(2)RV具有经轴突末梢吸收逆行跨突触传播的特性,糖蛋白缺失的RV(RV-ΔG)丧失跨突触能力,预先在神经元内补偿狂犬病毒糖蛋白RVG,可实现RV逆行跨单级示踪(下一级神经元无RVG,故不能继续跨突触)。
在传统的示踪系统中,蛋白的预先补偿依赖辅助病毒(通常为腺相关病毒,AAV)的递送而实现,但是在以往的研究中,通常仅使用AAV做局部递送。2017年,加州理工学院Gradinaru实验团队开发了用于C57BL/6小鼠上高效跨血脑屏障的AAV-PHP.eB突变体,使得全脑范围的蛋白补偿成为可能,也给示踪工具系统的开发与改进提供了新思路。
中科院徐富强团队于2022年初发表在《分子脑(Molecular Brain)》上题为“Brain-wide TVA compensation allows rabies virus to retrograde target cell-type-specific projection neurons”的文章即据此设计了“AAV-PHP.eB辅助的逆行标记系统”(AAV-PHP.eB-Assisted Retrograde Tracing Systems,即PARTS系统),以及“细胞类型特异的PARTS系统”(cell-type-specific PARTS,即cPARTS系统),通过AAV-PHP.eB全脑递送TVA受体,实现了基于RV-EnvA载体的全脑尺度广谱逆行标记及神经元细胞类型特异性逆行标记。

类似地,使用AAV-PHP.eB全脑递送RVG,在特定脑区感染糖蛋白缺失的狂犬病毒(RV-ΔG)实现逆向跨多级示踪。此外,结合由细胞类型特异性启动子控制的TVA,可以介导EnvA假型化的RV-ΔG实现起始细胞类型特异性的逆行跨多突触示踪。这项研究成果论文“Brain-wide N2cG compensation permits glycoprotein-deleted rabies virus to trace neural circuits across multiple synapses”于2023年2月发表在《创新光学健康科学杂志(Journal of Innovative Optical Health Sciences)》上。

01
Brain Case
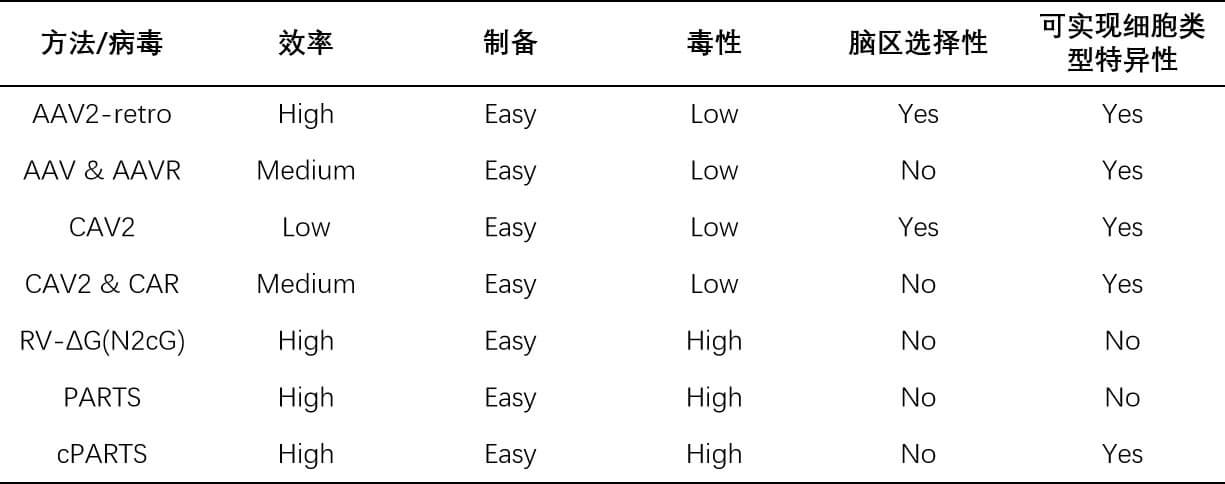
经神经元轴突末梢吸收逆行运输感染胞体的病毒示踪剂可用于绘制和操纵投射到特定脑区的上游神经网络。常用的逆行标记工具有N2cG假型的复制缺陷型RV(N2cG-RV-ΔG)、AAV2-retro、AAV9-retro等,然而,AAV2-retro、AAV9-retro具有脑区选择性,而N2cG-RV-ΔG只能广谱逆行感染而不能实现细胞类型特异性标记,解决这些问题亟待新的设计策略。
研究团队改用跨血脑屏障的AAV-PHP.eB全脑递送TVA受体,基于这一主干设计,一方面可以发挥AAV-PHP.eB跨血脑屏障的功能优势,将传统RV特定环路原位逆标(下图A, B)推广至全脑尺度的投射网络追踪(“PARTS”,下图C),另一方面可以借助Cre-lox系统对TVA元件的操控,将广谱逆行感染升级为细胞类型特异性标记(“cPARTS”,下图D)。
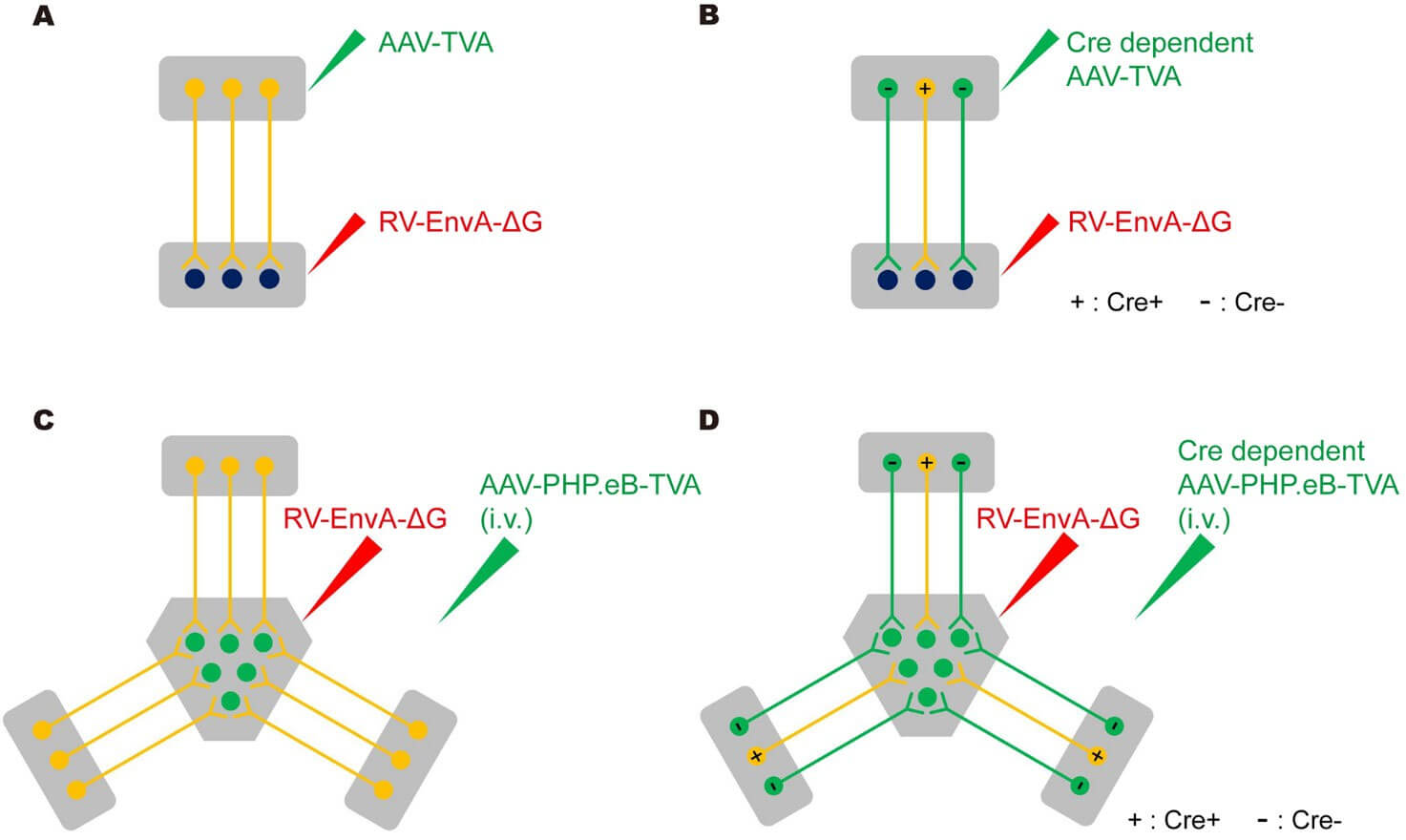
为了验证AAV-PHP.eB辅助病毒能否有效介导RV-EnvA的逆行标记,首先在S1→CPu环路中局部注射测试了PARTS和cPARTS的设计,PARTS和cPARTS均能实现传统标记系统对特定环路的示踪,利用cPARTS系统标记到了S1脑区内投射到CPu的投射性神经元群。
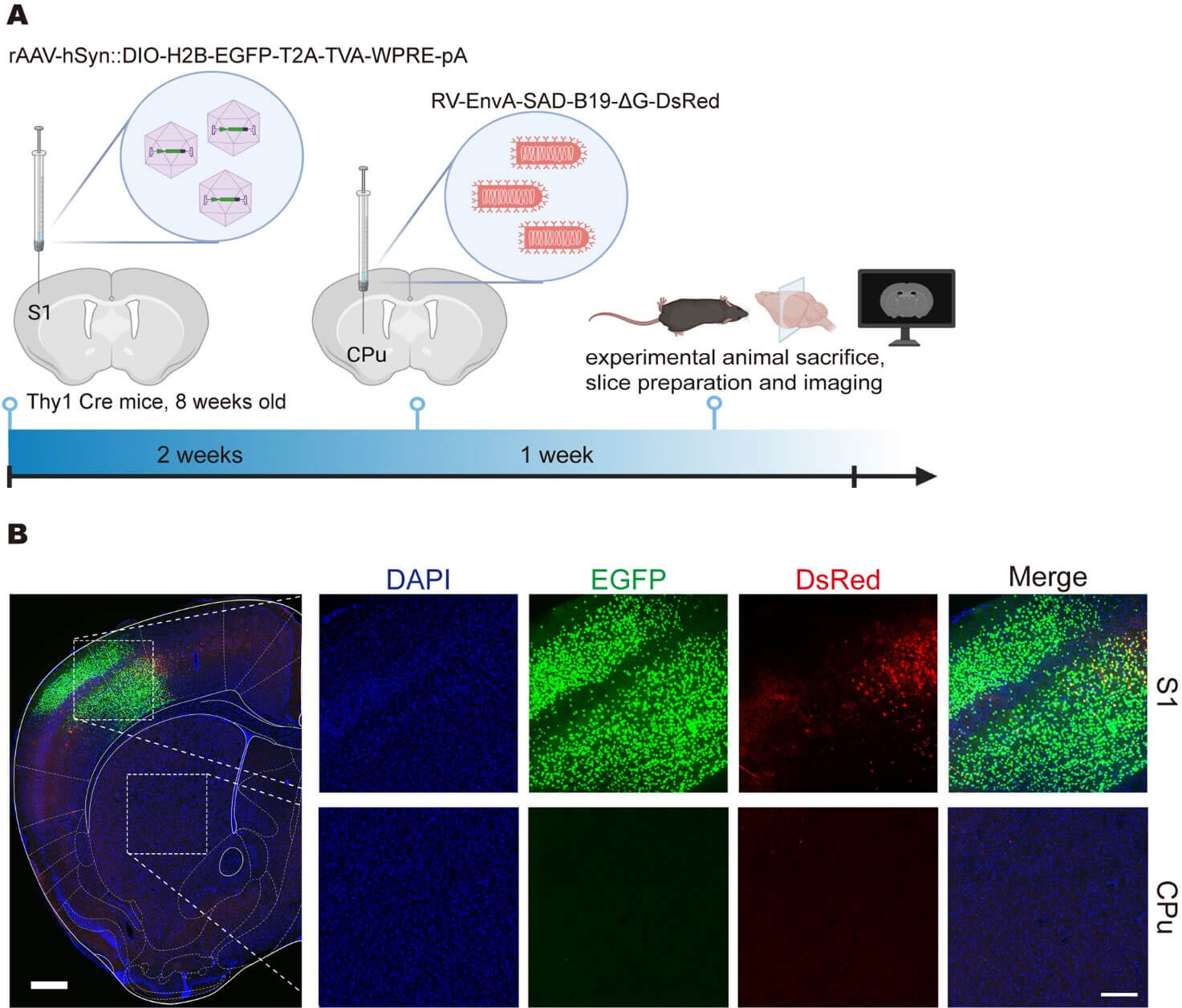
基于cPARTS系统局部注射标记S1脑区内投射到CPu的投射性神经元群
进一步地,作为对PARTS系统范式的验证,通过尾静脉给药将AAV-PHP.eB-TVA递送至全脑,VTA脑区注射RV-EnvA-ΔG-DsRed,VTA的多个上游脑区均可见DsRed报告蛋白表达,包括大脑皮层(CTX)、外侧缰核(LHb)、下丘脑外侧区(LHA)、未定带(ZI)、中脑网状核(MRN)和小脑核(CBN)等。
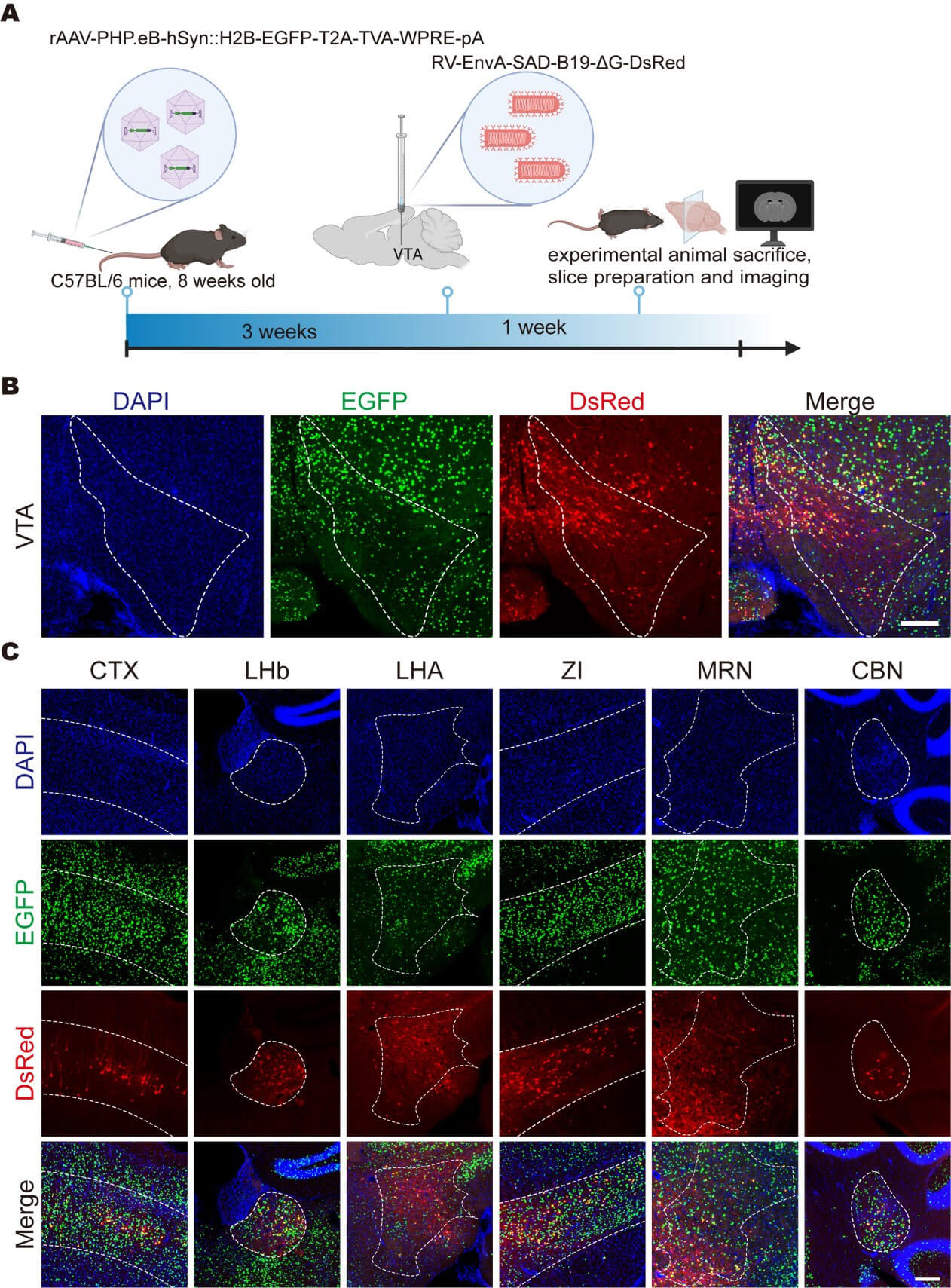
使用PARTS方法追踪VTA的广谱上游输入网络
作为对cPARTS系统范式的验证,Cre依赖的TVA经AAV-PHP.eB递送至VGAT-Cre转基因鼠的全脑,VTA脑区注射RV-EnvA-ΔG-DsRed后,标记到了上游脑区的GABA能神经元,包括外侧苍白球(GPe)、下丘脑外侧区(LHA)、未定带(ZI)、脑桥网状核(PRNr)、外嗅被盖核(LDTg)及前庭核(VNC)等。
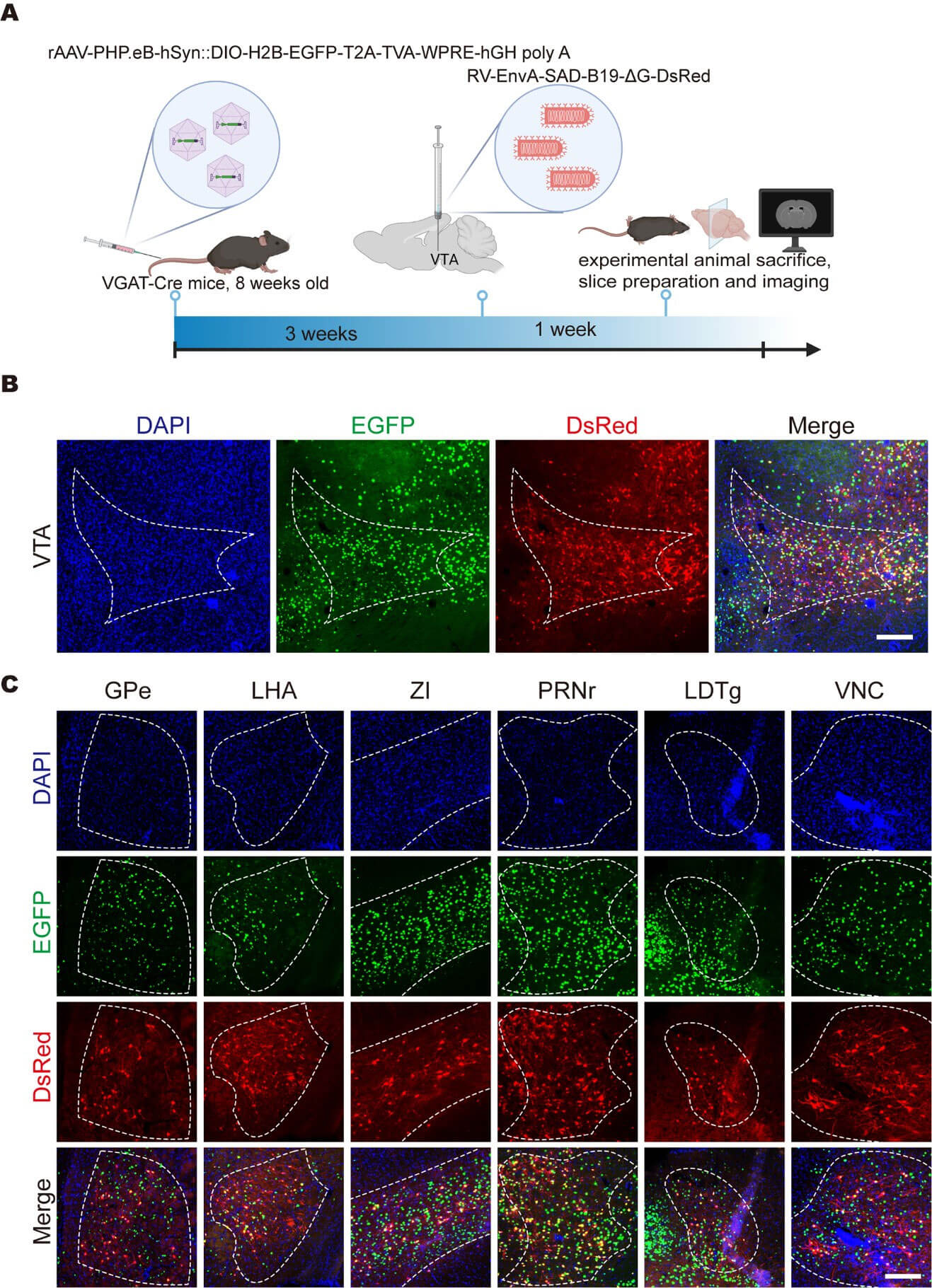
使用 cPARTS 方法追踪VTA的GABA能特异性的上游输入网络
02
Brain Case
可用于逆向跨多级突触示踪的病毒工具包括RV和伪狂犬病毒(PRV)Bartha株,但PRV不能感染灵长类动物。基于RV的跨多级示踪工具开发面临如下问题:(1)RV野毒安全性低,可对包括人类在内的动物致命;(2)作为RNA病毒,病毒生命周期中没有DNA阶段,不能通过Cre依赖的策略实现细胞类型特异性标记。
基于此,当使用跨血脑屏障的AAV-PHP.eB全脑补偿RVG,即可实现广谱的逆向跨多级示踪(下图A),这一设计在照顾到RV的安全性问题的同时,配合使用携载特异性启动子的AAV辅助病毒,也可以实现起始细胞类型特异性逆向跨多级示踪(下图B)。
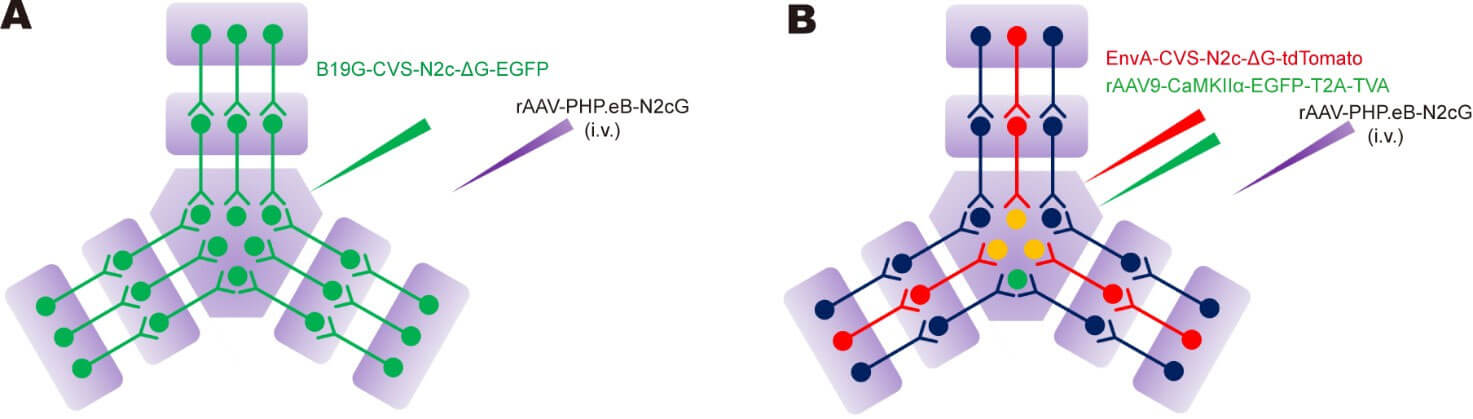
新型逆向跨多级突触示踪策略
为了验证前述设计策略,N2cG由rAAV-PHP.eB携载并经静脉给药在全脑补偿,B19G-CVS-N2c-ΔG-EGFP注射在MOp。丘脑腹侧前外侧复合体(VAL)、基底外侧杏仁核(BLA)、下托(SUB)、黑质(SNr)、简单小叶(SIM)、齿状核(DN)和尾壳核(CPu)等上游脑区均可见荧光信号。
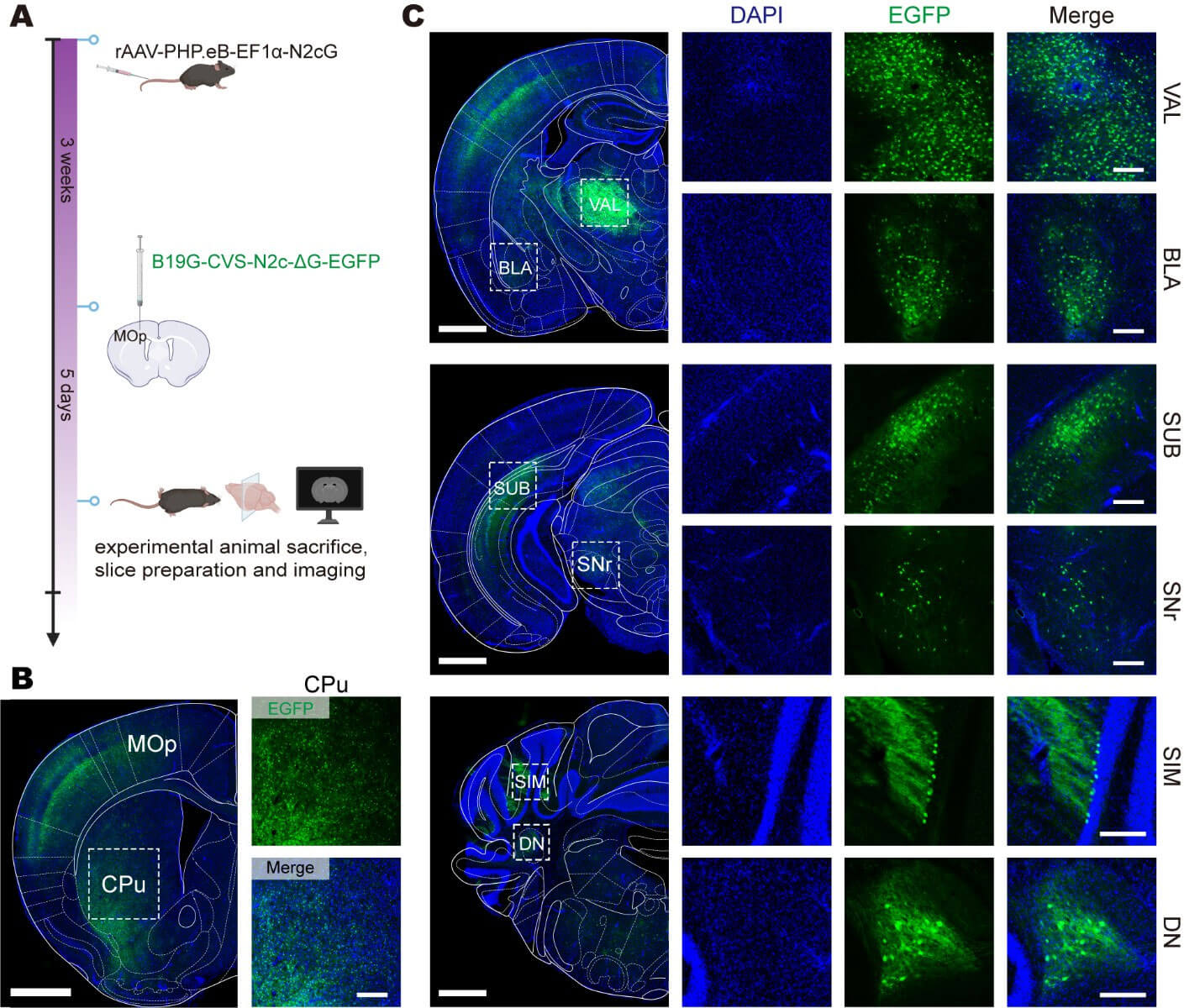
全脑补偿RVG实现全脑广谱逆行跨多级突触示踪
为了进一步追踪MOp中兴奋性神经元的输入网络,使用AAV9将CaMKIIα启动子控制下的TVA递送到到MOp中,同时通过尾静脉注射rAAV-PHP.eB进行全脑补偿N2cG,4周后在MOp注射EnvA-CVS-ΔG-tdTomato。许多上游脑区被CVS-ΔG-tdTomato标记,如前扣带区(ACA)、丘脑腹侧前外侧复合体(VAL)、上丘运动相关区(SCm)、黑质(SNr)和尾壳核(CPu)等。
这些结果表明,将EnvA假型化的RV-ΔG与携带由细胞类型特异性启动子控制的TVA的rAAV-PHP.eB联合使用,可以实现起始细胞类型特异性跨多级突触示踪。基于这一原理,研究人员也可以使用表达TVA的Cre依赖性AAV载体,结合Cre转基因动物实现特异性标记。
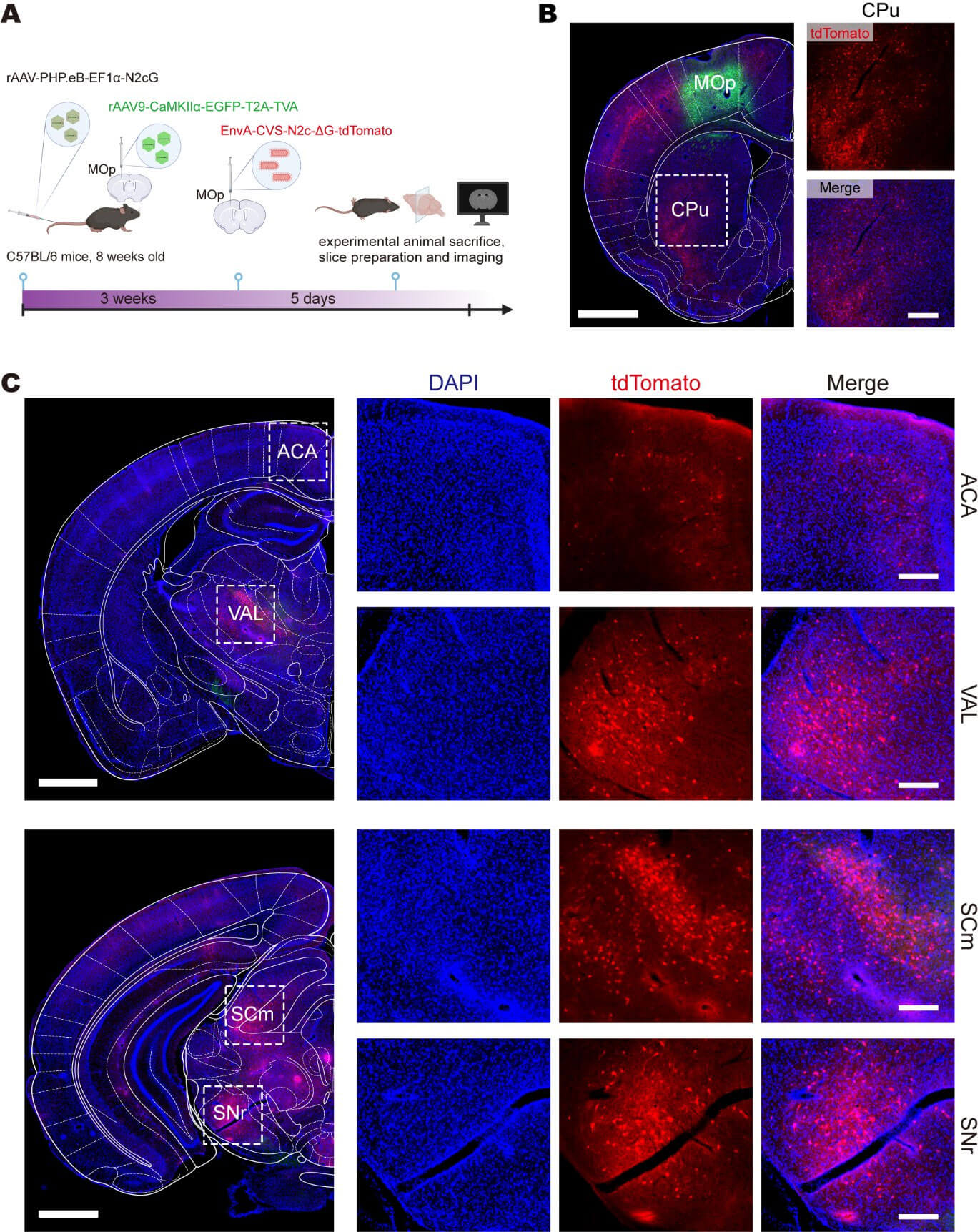
起始细胞类型特异性跨多级突触示踪
在常用的逆行追踪工具中,AAV2-retro逆行感染具有脑区偏好性,更倾向于感染皮层神经元;N2cG-RV-ΔG只能广谱逆行标记投射网络,PARTS/cPARTS策略克服了上述缺点。在广谱标记的基础上,使用转基因动物和AAV-PHP.eB携带的条件表达TVA元件可以实现细胞类型特异性逆行示踪。许多不同的病毒示踪剂或逆行示踪方法已被用于神经科学领域,研究人员可以根据实验需求选用合适的病毒工具。
使用跨血脑屏障的rAAV-PHP.eB作为辅助病毒对RVG进行全脑补偿,RV-ΔG可用于逆向跨多突触示踪。此外,结合细胞类型特异性启动子,用EnvA假型化的RV-ΔG可实现有效的起始细胞类型特异型逆行跨多级突触示踪。这一策略如用于非人灵长类动物的环路示踪,则需要使用针对该物种跨血脑屏障效果更好的AAV血清型,例如AAV.CAP-B10、AAV.CPP.16等。
PARTS/cPARTS系统及新型逆向跨多级突触示踪系统,把跨血脑屏障AAV载体的优势恰当地嫁接到RV示踪系统中,使基于RV的环路标记系统实现了由点到面的跨越!
布林凯斯也愿助您在科研道路上
实现由点到面的维度升级
上文涉及的病毒载体
布林凯斯均有现货在售
欢迎联系小布(18971216876微信同号)订购
原文链接:
https://doi.org/10.1186/s13041-022-00898-8 https://doi.org/10.1142/S1793545823400011