亨廷顿舞蹈症(Huntington’s disease, HD)是一种罕见的常染色体显性遗传病。患者一般在中年发病,出现运动、认知和精神方面的症状。亨廷顿舞蹈症临床症状复杂多变,患者病情呈进行性恶化,通常在发病 15~20 年后死亡。起病隐匿,进展缓慢,以舞蹈样动作伴进行性认知、精神功能障碍终至痴呆为该病的主要特征。
病因是亨廷顿基因上多核苷酸重复序列的错误表达,从而影响不同的分子通路,最终导致神经功能失调和退化。它的致病基因Htt(Huntingtin)编码Htt蛋白(Huntingtin protein),在它的第一个外显子中,包含了重复的CAG三联密码子。在HD中,这个三联密码子的重复次数会出现异常增加。拥有多36次CAG重复三联子的个体会患病。在大脑中表达的变异Htt蛋白通过不同分子机制导致神经功能退化。变异蛋白不仅促使该蛋白的异常功能增加而且导致正常功能的丧失。
在HD动物模型中,人们已经开发出能够减少或阻止突变体亨廷顿蛋白(mHTT)表达的治疗方法1–3。CRISPR/CAS9介导的基因编辑是永久性的,在体内能有效抑制mHTT的表达,研究证明CRISPR/Cas9在神经退行性疾病小鼠模型中缓解神经表型方面具有显著潜力4。然而,CRISPR/Cas9编辑是否可以用于编辑/纠正突变和改善患者的神经退行性效应仍有待验证。由于大型哺乳动物在大脑大小、发育和大脑结构上与人类更相似,因此在生物学和生理上与人类相似的大型动物模型的临床前研究中,评估CRISPR/Cas9安全性问题是很重要的。事实上,越来越多的证据表明,CRISPR/Cas9可以用于非人类灵长类动物,以模拟重要的大脑疾病,包括帕金森病和自闭症5-6。因此,迫切需要评估CRISPR/Cas9在大型动物中的安全性和治疗效果。
与人类的大脑类似,猪的大脑有广泛的皮质脑回,这可能赋予了大型哺乳动物独特的认知功能。目前猪已被用来模拟各种人类疾病的模型。暨南大学粤港澳中枢神经再生研究院李晓江教授团队曾在2018年建立了HD基因敲入(KI)猪7,它可以重现HD患者大脑中所见的选择性神经退行性变。
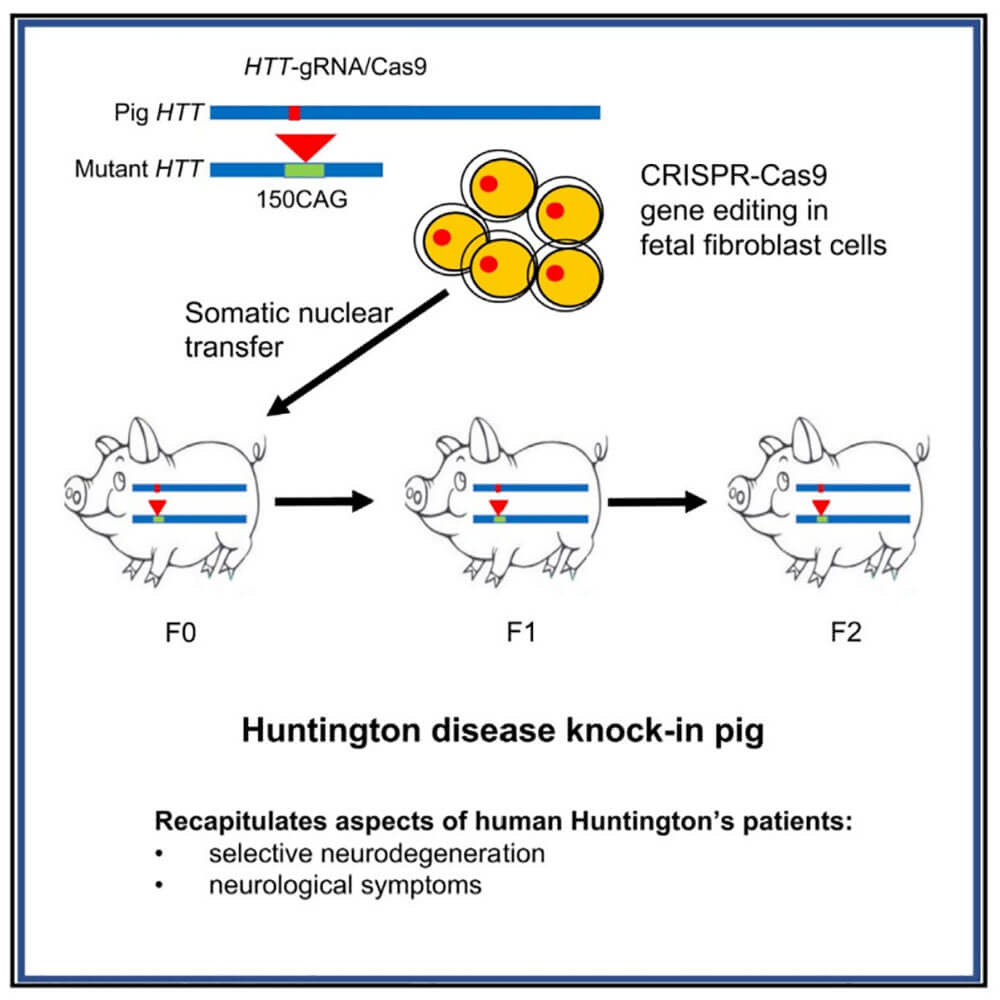
2023年2月16日,暨南大学粤港澳中枢神经再生研究院李晓江教授,李世华教授,闫森研究员,联合中国科学院广州生物医药与健康研究院赖良学研究员在Nature Biomedical Engineering上发表题为 Cas9-mediated replacement of expanded CAG repeats in a pig model of Huntington’s disease 的研究论文 。该工作利用AAV病毒载体表达CRISPR/Cas9基因编辑的技术修复及敲除亨廷顿猪模型的突变基因,评估了CRISPR/Cas9在猪大脑中的可能毒性,并使用HD KI猪来检测CRISPR/Cas9对去除mHTT及其相关表型的影响。

本文研究工作使用AAV9靶向HD KI猪的突变HTT基因来检测治疗效果。将AAV9病毒立体定向注射到6月龄猪大脑纹状体中,表达gRNA和Cas9的病毒按1:2的比例混合,并将30μl的混合病毒(共1-1.5×1012 vg)注射到猪纹状体的两侧(每侧15μl);通过耳廓静脉将gRNA和Cas9的病毒注射到3-7日龄仔猪体内,2 × 1013 VG/kg,每只仔猪大约1.8 × 1013 VG。研究结果显示,CRISPR/Cas9介导的基因组编辑没有显著毒性,单次脑立体定向注射或静脉注射CRSPR/Cas9并部分替代mHTT,可以有效减少神经退行性变,缓解神经表型。
该研究证明CRISPR/Cas9对神经退行性疾病大型动物模型的治疗发挥突出作用,CRISPR/Cas9在治疗人类神经系统疾病方面具有巨大的潜力。
大动物,如犬、猪、非人灵长类动物,是疾病机制研究、药物筛选的重要实验对象。然而,在大动物体内实现基因递送需要用量巨大、品质优异的病毒载体,但目前常规的293生产体系难以稳定提供。
基于上述需求,布林凯斯利用具有自主知识产权的基于昆虫细胞SF9的OneBac生产体系,推出适用于大动物的高质、高量AAV生产服务,向科研界和药物研发领域稳定提供大于1E+14的AAV病毒载体。