基于SAD-B19株狂犬病毒改造的逆行跨单突触系统可标记特异类型神经元的输入网络[1],已被用于解决大量的神经科学问题,且在神经科学领域得到广泛的推广和应用。但这套系统跨突触后只能标记到少量的上游神经细胞,可能忽略有关联的输入网络连接,且毒性较大,不利于长时间搭载功能基因进行神经活动检测或功能操控,因此如何提高其跨突触效率及减小毒性是神经科学界努力的方向。密码子优化的嵌合型糖蛋白(oG)可辅助SAD-B19-ΔG跨突触示踪效率提高20倍[2],多个实验室都采用表达oG的腺相关病毒作为辅助载体来追踪神经网络上游输入[3-5],但其毒性大,只能用于结构网络的解析。
在SAD-B19-ΔG基础上改造的自身失活的狂犬病毒,通过快速降解病毒复制相关的N蛋白,可携带Cre或Flpo重组酶结合表达功能探针的腺相关病毒等用于功能网络的初步研究,但也存在制备工艺复杂,自身表达弱,不能搭载功能探针等缺陷[6],且能否用于高效跨突触标记和操控功能网络未知。
Chatterjee等报道了无毒的G跟L蛋白双缺失的SAD-B19-ΔGL,但其只有极弱的表达能力,只能通过搭载Cre或Flpo重组酶结合表达功能探针的AAV病毒或转基因动物等用于功能网络的活动监测与操控,同时,由于L基因比较大,需要采用合适的辅助病毒载体策略或制作表达L的转基因动物来实现跨单突触[7]。Reardon等[8]建立了CVS-N2c株狂犬病毒改造的逆行跨单突触系统,在基因组缺失了自身糖蛋白N2cG后,通过反向补偿N2cG,与SAD-B19疫苗株相比其逆行跨突触能力明显增强且对神经元的毒性进一步减小,可表达钙离子探针和光遗传探针等功能探针用于功能环路的解析,因而在神经环路示踪中更有优势,但也存在制备非常困难、滴度低等缺点,因而在后续的环路示踪研究中鲜见报道。
从上述现状看,发展兼顾结构与功能网络解析的减毒、高效逆向跨单突触的工具病毒,仍然是整个神经科学领域的紧迫需求。
近日,中科院深圳先进技术研究院徐富强团队在《中国神经再生研究(英文版)》杂志2023年8期的研究发现,B19G相关的细胞系可用于快速包装和制备高滴度的CVS-N2c-ΔG,且利用高滴度的B19G假型的CVS-N2c-ΔG感染新型N2cG和EnvARVG细胞系,可快速获得高滴度的N2cG包裹的CVS-N2c-ΔG和EnvARVG假型的CVS-N2c-ΔG。
通过活体研究发现:①N2cG包裹的CVS-N2c-ΔG逆行转导投射神经元的效率显著优于AAV-Retro;② CVS-N2c-ΔG逆行跨单突触效率优于常用的SAD-B19-ΔG;③ CVS-N2c-ΔG可搭载功能探针用于神经活动监测,且可维持的时间窗口达3周;④ CVS-N2c-ΔG可表达足够的重组酶以进行有效的转基因重组。开发减毒、高效逆向跨单突触的病毒示踪剂,可为神经环路的结构和功能研究提供了有用的工具。
病毒的逆行标记可用于解析投射到特定脑区的上游神经网络。徐富强团队既往研究报道了N2cG包裹的SAD-B19-ΔG具有高效沿轴突末端逆行标记特定脑区上游网络的能力[9]。如果N2cG 包裹的CVS-N2c-ΔG病毒也能够高效逆行标记,将更有利于结构环路标记和功能操控。而目前常用的逆行标记工具主要利用腺病毒相关病毒(adeno-associated virus,AAV),如效率相当的AAV2-Retro和AAV9-Retro,但它们具有脑区选择性[9-11]。因此,徐富强等还比较了CVS-N2c-ΔG(N2cG)和AAV9-Retro的逆标能力。将CVS-N2c-ΔG(N2cG)和AAV9-Retro混合注射到尾状壳核(背侧纹状体)脑区,14d后可见CVS-N2c-ΔG(N2cG)比AAV9-Retro逆行标记效率更优,可高效标记AAV9-Retro标记效率低的神经通路,如VTA/SNc→背侧纹状体通路(图1)。
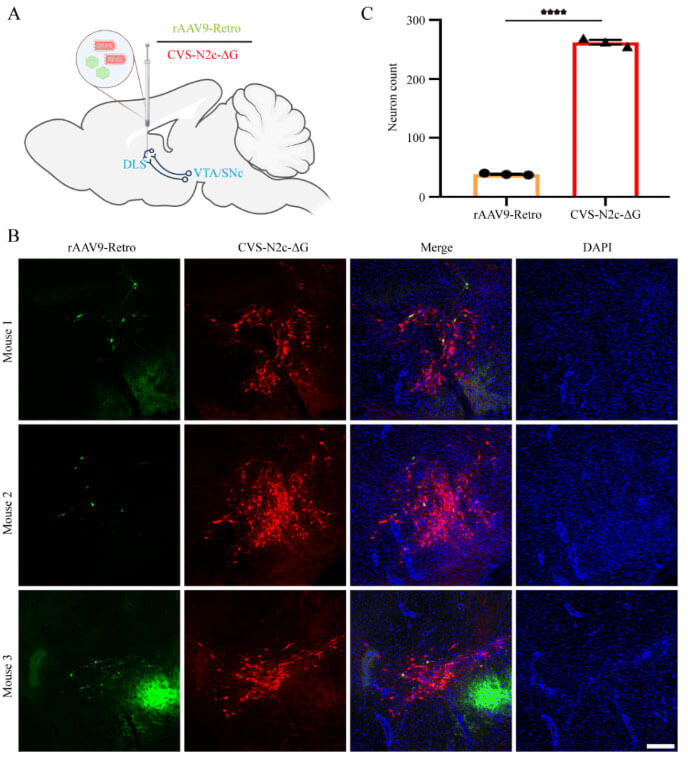
图1:CVS-N2c-ΔG(N2cG)逆行标记投射神经元的效率优于AAV9-Retro(图源:Lin et al., Neural Regen Res, 2023)
不同来源病毒株结合不同来源的外膜糖蛋白可能具有不同的跨突触效率或者其他嗜性。为了验证密码子优化的嵌合型糖蛋白是否能够辅助CVS-N2c-ΔG进行高效逆行跨单突触传播,将携带Cre重组酶控制表达的密码子优化的嵌合型糖蛋白和TVA的AAV作为辅助病毒,混合后注射到Thy1-Cre转基因小鼠的腹侧海马区,3周后在同一位点分别注射EnvARVG包裹的CVS-N2c-ΔG和SAD-B19-ΔG,7d可见CVS-N2c-ΔG/oG 系统跨突触效率比SAD-B19-ΔG/oG 系统高,为后者的3-4倍(图2)。因此,CVS-N2c-ΔG/oG可作为重要的逆行跨单突触系统,有望用于解析特定脑区特异类型神经元的上游输入连接网络。
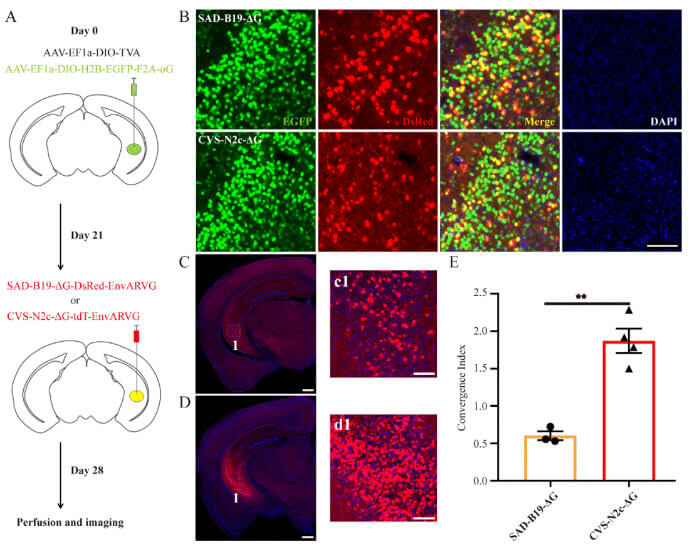
图2:CVS-N2c-ΔG/oG系统逆行跨单突触效率优于SAD-B19-ΔG/oG系统(图源:Lin et al., Neural Regen Res, 2023)
总之,徐富强团队成功地建立了一套改进的生产系统,可用于快速拯救和制备高滴度的CVS-N2c-ΔG病毒,且新方法制备的CVS-N2c-ΔG病毒在神经环路的逆行标记、跨单突触靶向、功能监测和转基因重组等方面表现出色,这将有助于神经环路的结构和功能研究以及疾病机制的解析。然而,CVS-N2c-ΔG病毒的毒性尚未完全消除,接下来,需要进一步对其改造以减弱毒性,使其适合搭载功能基因进行更长时间的功能操控与监测。
徐富强,中国科学院深圳先进技术研究院研究员,国家杰青,国科大特聘教授。近年主要研发用于神经环路结构和功能解析、细胞基因治疗的技术方法和工具,发明的600种转化产品被国内外1000余家实验室应用,举办的5届病毒载体技术培训班参会者有3000余人次,成果大多以技术“入股”。在包括《Science》《Nature》《Nature Biotechnology》《Nature Neuroscience》《Neuron》《Nature Communications》《Science Advances》《PNAS》等期刊发表了140篇论文,申请专利60余件。
原文链接:
https://doi.org/10.4103/1673-5374.358618

徐富强实验室