突触是神经系统的基本结构单元,其结构可塑性对于调节大脑功能至关重要,与大脑的生理和病理状态密切相关。目前基于分裂荧光蛋白(FPs)研究突触组织的方法,在体内评估突触动力学时受到限制,因为分裂FPs的结合是不可逆的。2024年1月8日,韩国高等科学技术学院Won Do Heo 团队在Nature Methods杂志上发表题为“Real-time visualization of structural dynamics of synapses in live cells in vivo”的文章,研究人员基于二聚体依赖荧光蛋白(ddFP)策略开发了可实时检测完整突触结构变化的可逆性荧光蛋白系统-SynapShot。该系统可实时监测生理刺激下突触结构的可逆和双向变化,其双色配置(绿色和红色)能同时观察两组不同的突触,还能与光遗传学技术结合。

研究人员巧妙地将二聚化依赖的荧光蛋白(ddFPs)与工程化突触粘附分子相结合,构建出了SynapShot系统。在设计阶段,他们基于前人的方法(SynView和mGRASP)设计了多种融合构建体。在HEK293T细胞中,研究人员分别表达NRX1β融合的Pre-SynapShot和NLG1融合的Post-SynapShot蛋白,再将两种细胞共孵育。结果发现,GA融合的NRX1β和B3融合的NLG1组合在细胞接触位点展现出最高的荧光强度(图1a-e)。为了验证SynapShot是否能准确指示完整突触的位置,研究人员在培养的海马神经元中表达Pre-SynapShot和Post-SynapShot。结果观察到,在不同神经元的相邻纤维相交处出现了明亮的绿色斑点,且ddGFP信号仅在靠近表达Pre-SynapShot神经元且同时表达Post-SynapShot的棘突上被检测到,这表明该方法特异性极高(图1f-i)。免疫细胞化学实验进一步证实,SynapShot的荧光信号能与内源性兴奋性和抑制性突触前、后标记物共定位,准确报告功能性突触的位置(图1j-l)。
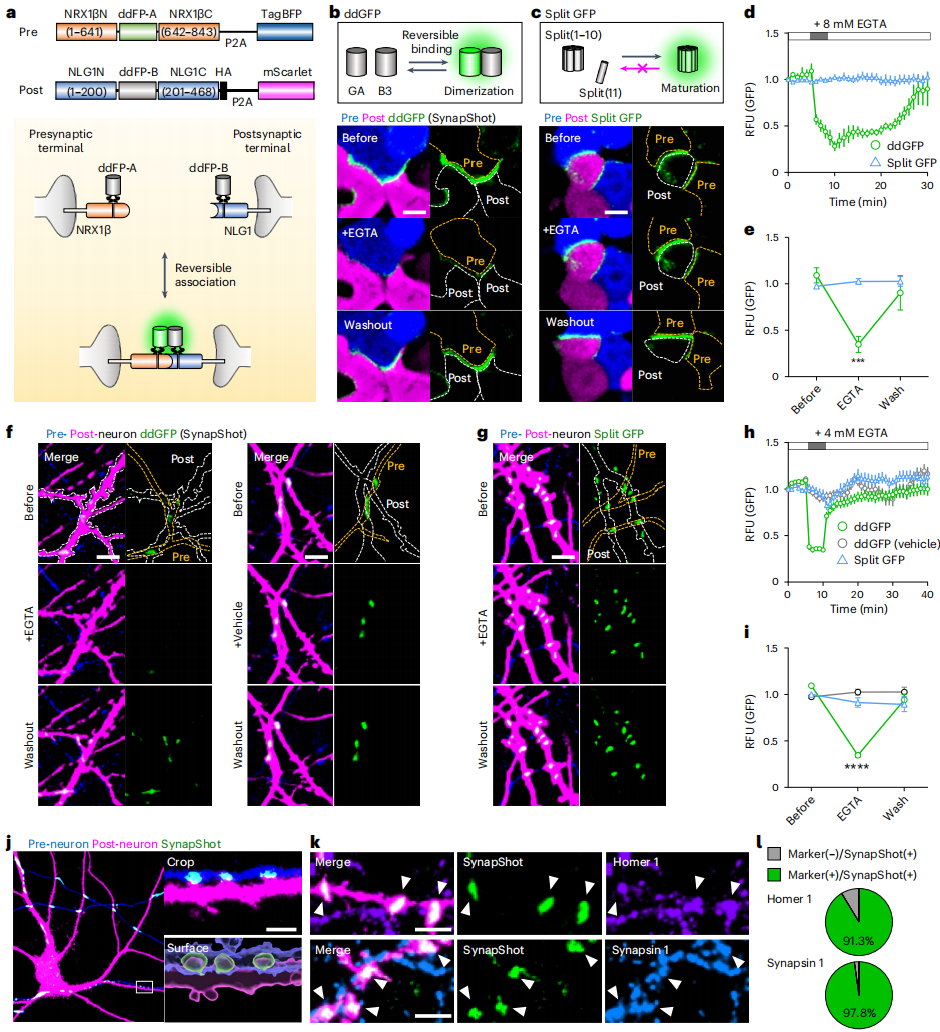
图1 SynapShot可视化可逆的突触连接
为了探究突触结构动态与SynapShot信号之间的关系,研究人员对神经元进行了长达24小时的延时成像。结果发现,树突棘的大小变化与SynapShot信号呈正相关,树突棘增大时,SynapShot信号增强;反之,树突棘缩小时,信号减弱(图2a-f)。为了进一步验证SynapShot在生理刺激下的可逆性,研究人员用NMDA受体拮抗剂(APV)处理神经元,同时进行延时成像。结果显示,SynapShot信号显著降低,且树突棘随之收缩;而传统的split-GFP信号在APV处理后却保持稳定甚至有所增加(图2g-l)。这一对比充分证明了SynapShot能够可靠地报告完整突触中与功能相关的结构变化。光漂白后荧光恢复实验结果显示,在单个突触光漂白后,约50%的SynapShot信号能在30秒内快速恢复,而SynView(通过NRX1β和NLG1结合来实现突触可视化)信号则毫无恢复迹象。这表明SynapShot在监测突触分子动态变化方面具有独特优势。

图2 用SynapShot监测完整突触结构动态变化
ddFP有一个特性,即ddGFP或红色ddFP(ddRFP)的拷贝A能以相似的结合亲和力与拷贝B(B3)结合,分别产生绿色或红色荧光。基于此,研究人员开发出了激发光红移的SynapShot,实现了同时可视化由两个突触前神经元和一个突触后神经元形成的两组不同的突触(图3a,b)。通过在不同神经元中分别表达绿色和红色的Pre-SynapShot以及Post-SynapShot,他们在同一树突的不同位置检测到了绿色和红色的斑点(图3c),为分析单个突触后神经元上的多个突触输入提供了可能。为了验证红色SynapShot是否能与蓝光激活的光遗传学工具结合使用,研究人员在表达OptoTrkB的突触后神经元中,监测光诱导的脑源性神经营养因子(BDNF)内源性信号激活后的突触变化。实验结果表明,激活OptoTrkB后,树突棘增大了两倍,SynapShot信号增加了2.7倍,强度更是提升了3.7倍。这一实验不仅展示了双色SynapShot的强大功能,还凸显了它与光遗传学技术结合在精准调控和监测突触动态方面的巨大潜力。
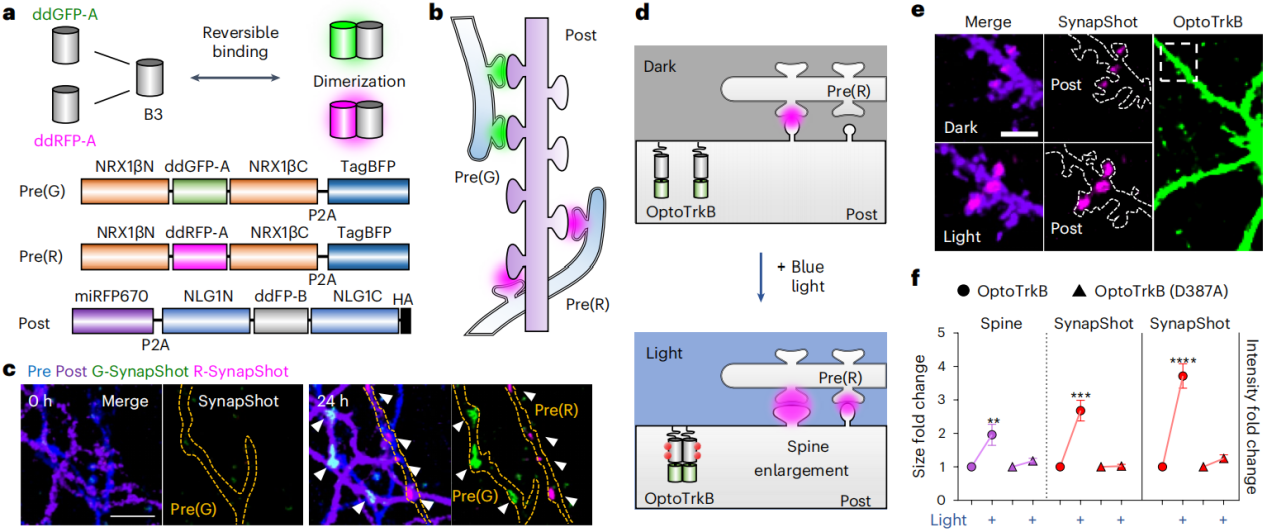
图3 双色SynapShot与光遗传学兼容性
研究人员还对源自SynapShot的ddGFP信号和mGRASP的split-GFP信号进行成像以作比较,小鼠连续5天接受视觉辨别任务训练(图4d、e),与水奖励相关的舔舐次数随时间显著增加,但在表达SynapShot和mGRASP的小鼠之间没有差异(图4f)。为了监测学习过程中SynapShot荧光的动态变化,在任务进行到第3天时对V1神经元进行了体内树突成像。结果显示在部分树突棘上,SynapShot的ddGFP信号(G)与树突荧光信号(R)的比值(G/R比)在整个任务过程中发生动态变化,这表明与学习相关的突触强度变化可以在体内被追踪。相比之下,大多数split-GFP信号并没有表现出与SynapShot类似程度的信号动态变化,并且在大多数单个突触点上往往失去了信号(图4g,h)。在分析平均荧光的变异系数时,SynapShot成像的突触点的信号变化程度比split-GFP系统更高。这些结果表明,与mGRASP系统相比,SynapShot能够更精确地检测细微调整的突触变化(图4i,j)。
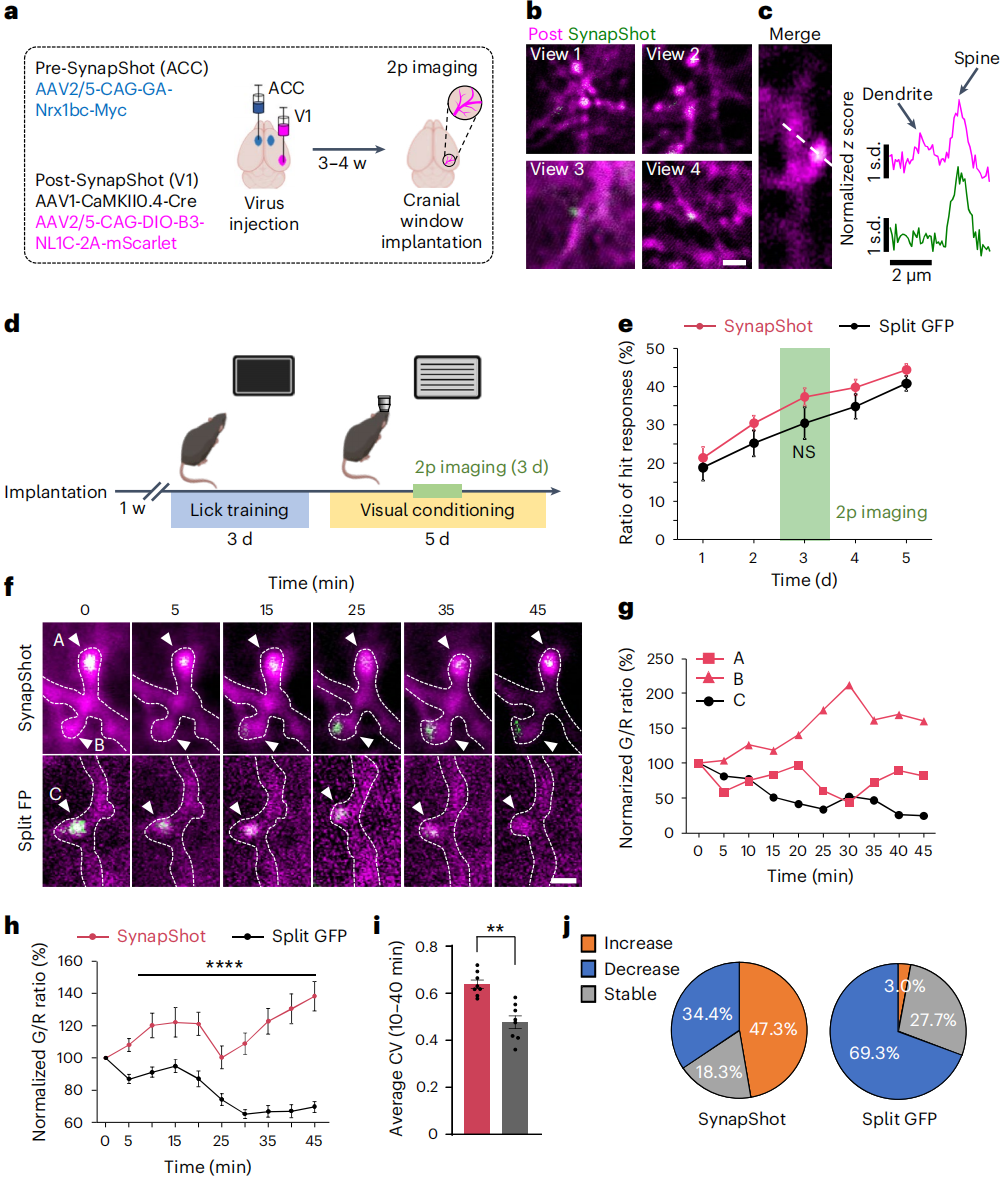
图4 视觉辨别任务中ACC-V1连接中的SynapShot信号
为了确定这些变化是否反映了与学习相关神经元功能活动,研究人员在清醒小鼠的颅骨窗口,评估了接受来自次级躯体感觉皮层(S2)轴突投射的初级运动皮层(M1)上的SynapShot信号(图5a-c)。结果显示小鼠运动时,M1神经元相同树突棘上的ddGFP信号中,单个荧光点的强度会随着时间的推移而逐渐增加,且信号存在波动;而在麻醉小鼠中,观察到信号逐渐减弱(图5d)。相比之下,在麻醉状态下,SynapShot信号强度逐渐降低(图4e,f)。在1小时的过程中,清醒和麻醉状态下的平均信号有显著差异(图5g)。从整体水平分析,清醒和麻醉状态下的信号也有明显差异(图5h)。总之,这些结果证明了SynapShot在监测自由活动的活体动物单个突触动态方面的实用性。此外,在相同的实验条件下,表达mGRASP的小鼠没有显示出荧光的动态变化。
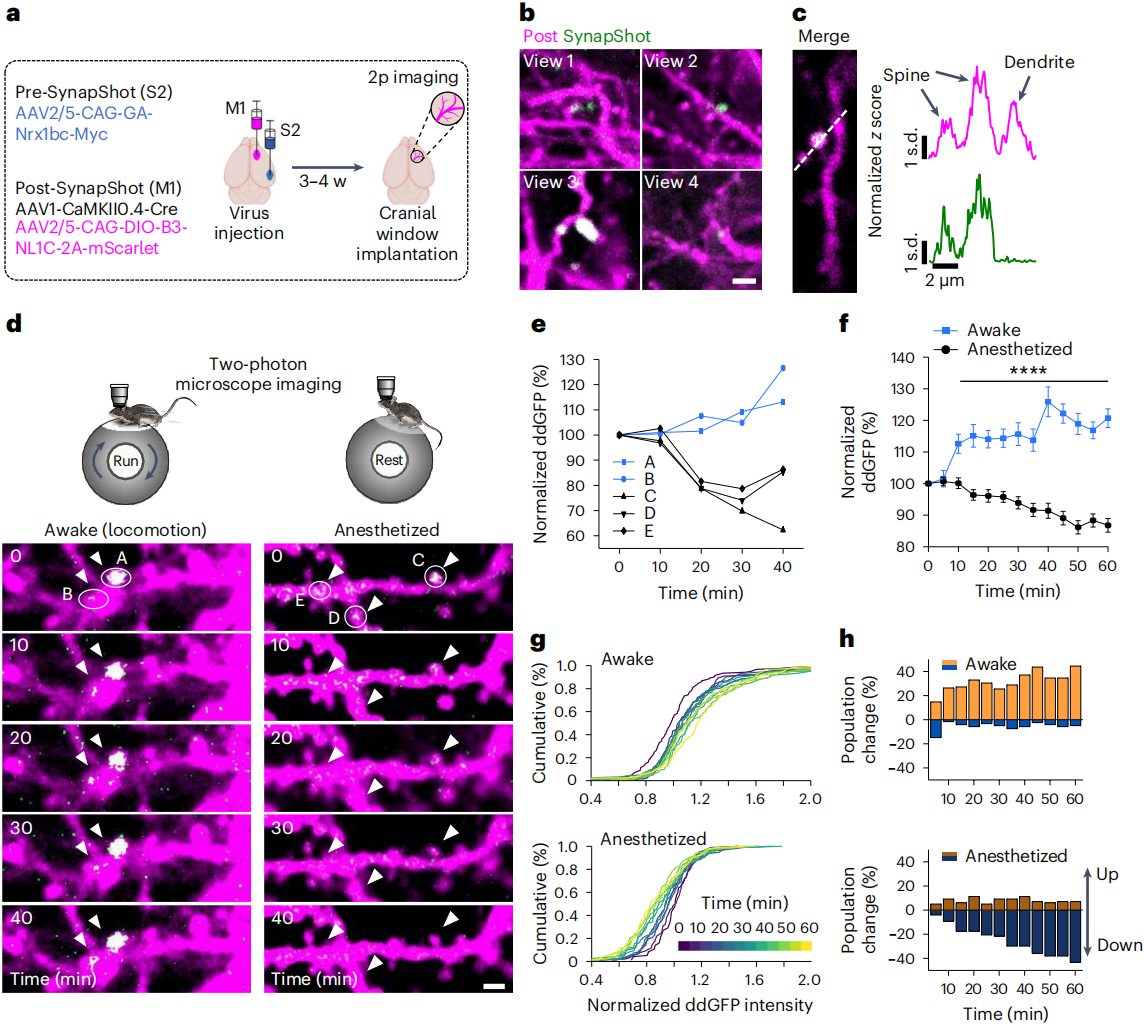
图5 可视化小鼠体感-运动神经环路中突触的结构可塑性
SynapShot技术为神经科学研究带来了革命性的变化,它就像一个“超级显微镜”,让我们能够实时、清晰地观察到突触的动态变化。从设计原理的巧妙构思,到在细胞和动物实验中的出色表现,SynapShot展现出了巨大的科研价值。但该技术存在局限性,在多聚甲醛等固定剂中ddFP 信号会大幅减弱,因此更适用于活细胞和完整大脑中突触动态的实时可视化。