狂犬病毒(rabies virus,以下简称为RV),RV归类于弹状病毒科狂犬病毒属。病毒外壳呈弹状,有包膜包裹,核衣壳螺旋对称,内含负义单链RNA,编码5种病毒蛋白。其中G蛋白与RV的感染与传播息息相关,在失去G蛋白的情况下,RV无法形成感染性病毒颗粒,也无法感染与传播。野生型RV具有逆向跨突触传播的特性,可以用于灵长类及啮齿类动物神经解剖学的研究[1]。利用RV做示踪工具病毒有独特优势,除特异性跨突触传播外,RV感染中枢系统后,主要标记神经元,几乎不标记胶质细胞;对没有突触连接的神经纤维不感染,毒性低,被感染的神经元几乎不发生明显病变及裂解[2]。
Wickersham等[3/4] 基于RV疫苗株Sad B-19感染性克隆构建的重组狂犬病毒,敲除G蛋白基因并携带GFP、mCherry等荧光蛋白基因,结合EnvA/TVA 系统可实现细胞特异性起始感染。因为EnvA识别的受体蛋白TVA只分布在禽类细胞表面,利用重组囊膜蛋白包装RV,产生的病毒粒子不能直接感染哺乳动物,若利用AAV、慢病毒、逆转录病毒等将 TVA 表达在哺乳动物的细胞膜上,则这种RV可特异性识别并感染表达了TVA的神经元。由于这种RV的G蛋白(RV-G)基因缺失,进入神经元后,可复制并表达外源基因,但不能包装产生成熟的病毒粒子来感染上一级神经元。如果同时在这类神经元中外源性补充RV-G,即可在该类神经元中产生成熟的假病毒粒子,可以用来跨突触感染上一级神经元。进入上一级神经元后,RV-G缺失的病毒可以复制并表达外源基因,但不能继续跨突触感染。此过程使RV可控地逆向跨单级突触标记特异类型神经元的输入网络得以实现。
随着反向遗传学手段的成熟,目前构建出的复制缺陷型RV具有较低的毒性和较高的安全性,在神经环路研究中应用广泛,通常会结合电生理学、光遗传学、化学遗传学等方法,剖析神经环路的功能性组合,探讨神经环路在生理及病理等情况下的工作原理。
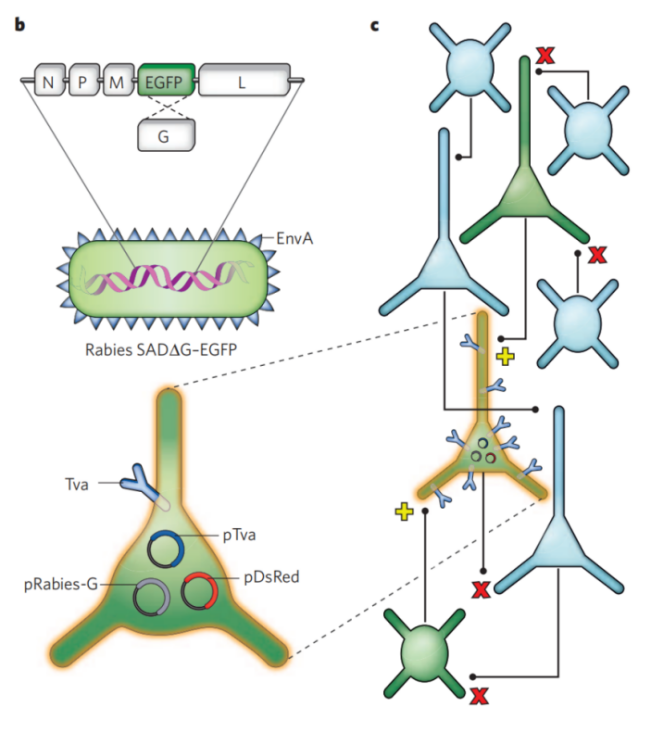
虽然RV逆向跨单突触系统在神经环路研究中的应用逐渐得到推广,实验技术上也日趋成熟,但是对于很多新手来说需要注意的地方有很多,下面,小布就以我们公司RV逆向跨单突触系统在中枢标记的注射测试结果为实例,分享一些使用tips。
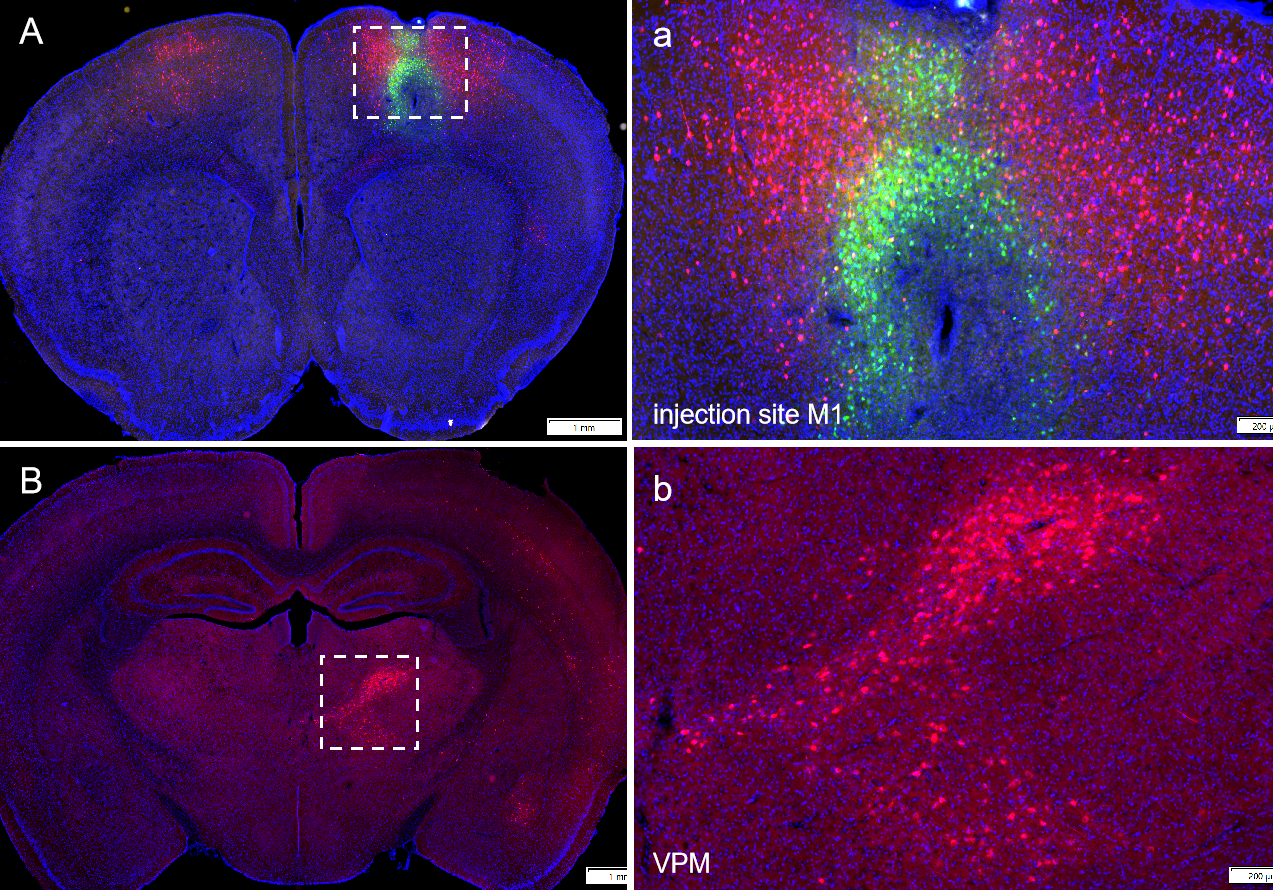
实例一
AAV辅助病毒:rAAV-EF1α-DIO-EGFP-T2A-TVA,rAAV-EF1α-DIO-N2cG
RV病毒:CVS-EnvA-ΔG-tdTomato
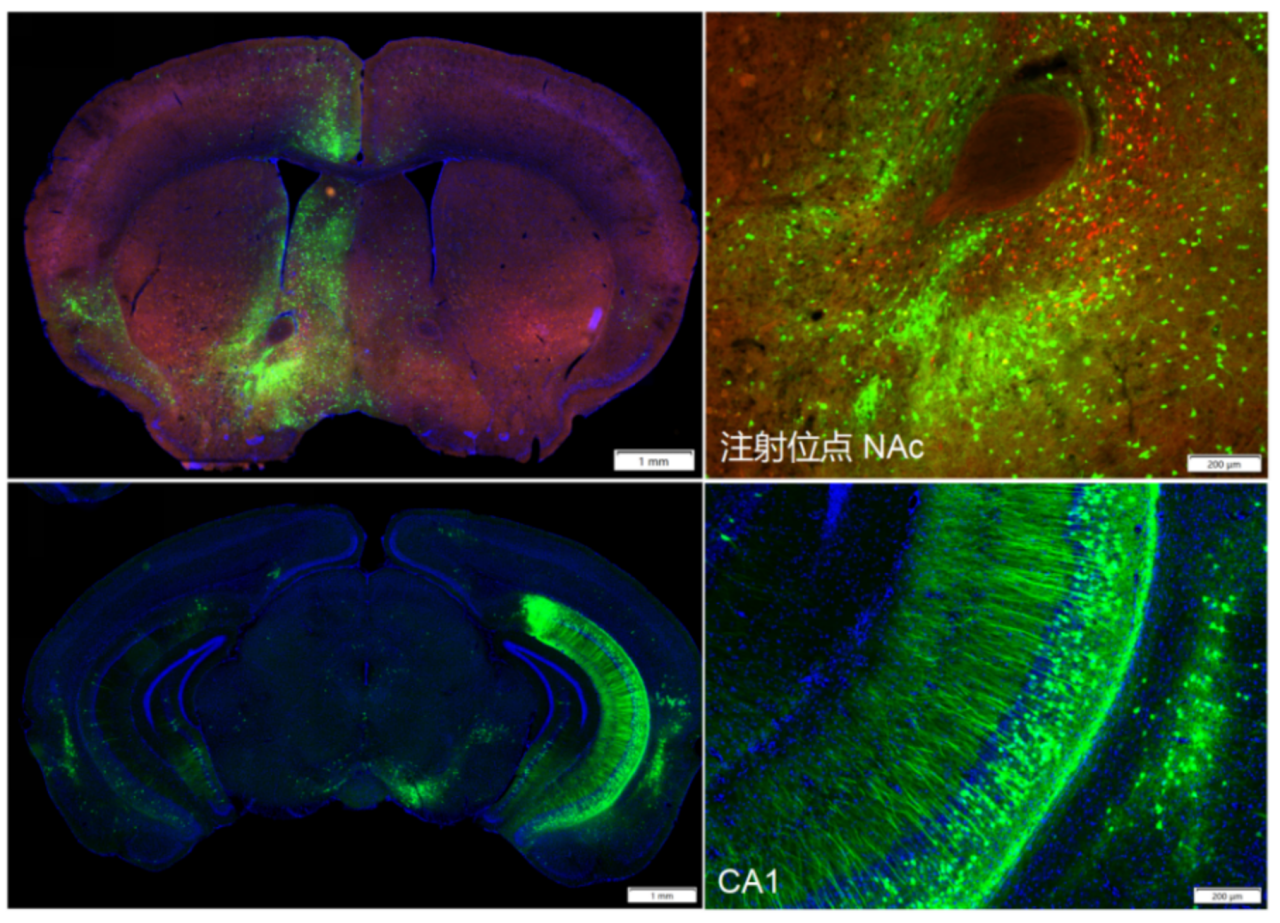
实例二
AAV辅助病毒:RMT-mCherry-1/5-N2c
RV病毒:CVS-EnvA-ΔG-EGFP
参考文献
1、Moschovakis AK, Gregoriou GG, Ugolini G, et al. Oculomotor areas of the primate frontal lobes: a transneuronal transfer of rabies virus and [14C]-2-deoxyglucose functional imaging study. J Neurosci. 2004;24(25):5726-5740.
2、Kelly RM, Strick PL. Rabies as a transneuronal tracer of circuits in the central nervous system. J Neurosci Methods. 2000;103(1):63-71.
3、Wickersham IR, Finke S, Conzelmann KK, Callaway EM. Retrograde neuronal tracing with a deletion-mutant rabies virus. Nat Methods. 2007;4(1):47-49.
4、 Arenkiel BR, Ehlers MD. Molecular genetics and imaging technologies for circuit-based neuroanatomy. Nature. 2009;461(7266):900-907.
5、Reardon TR, Murray AJ, Turi GF, et al. Rabies Virus CVS-N2c(ΔG) Strain Enhances Retrograde Synaptic Transfer and Neuronal Viability. Neuron. 2016;89(4):711-724.