在人类和动物中,一个部位的疼痛可以抑制其他部位的疼痛感知,这种现象在人类中称为条件性疼痛调制(CPM),在动物中称为弥散性伤害性抑制控制(DNIC)。尽管已有研究关注了脑干到脊髓的下行投射在DNIC中的作用,但关于大脑皮层如何调节“疼痛抑制疼痛”的机制仍不清楚。
2025年2月21日,中国科学技术大学张智/朱霞团队和安徽医科大学陶文娟团队合作在Nature Communications杂志发表了题为“Intra-somatosensory cortical circuits mediating pain-induced analgesia”的研究论文,揭示了S2到S1HL的前馈抑制环路,以及跨半球的对侧S2到S2再到S1HL的环路,分别介导同侧和对侧疼痛诱导的镇痛。

为了确定疼痛是否能抑制小鼠其他部位的疼痛,首先通过向左后足注射完全弗氏佐剂(CFA,1mg/ml,10μl),建立了炎症性疼痛模型。通过捏、注射辣椒素等方式施加伤害性刺激,结果发现,刺激小鼠的左前爪、右前爪或脸颊,都能显著抑制其左后爪的疼痛相关行为,提高疼痛阈值。具体而言,在von Frey测试中检测到疼痛阈值升高(即机械敏感性阈值增加),在热板测试中检测到舔舐反应的潜伏期延长,在刷子测试中动态评分降低,以及在自发疼痛测试中自发疼痛评分减少,并且在移除夹持刺激后20分钟这种效应逐渐减弱(图1a-b)。而且,这种镇痛效果在刺激去除后一段时间内会逐渐消失,并且与刺激强度有关,例如低浓度辣椒素(1μg/10μl)无法有效提高疼痛阈值,而5μg/10μl和10μg/10μl的辣椒素则效果显著(图1c-h)。此外,研究还排除了注意力分散对实验结果的干扰,证明“疼痛抑制疼痛”是真实的神经调控现象。
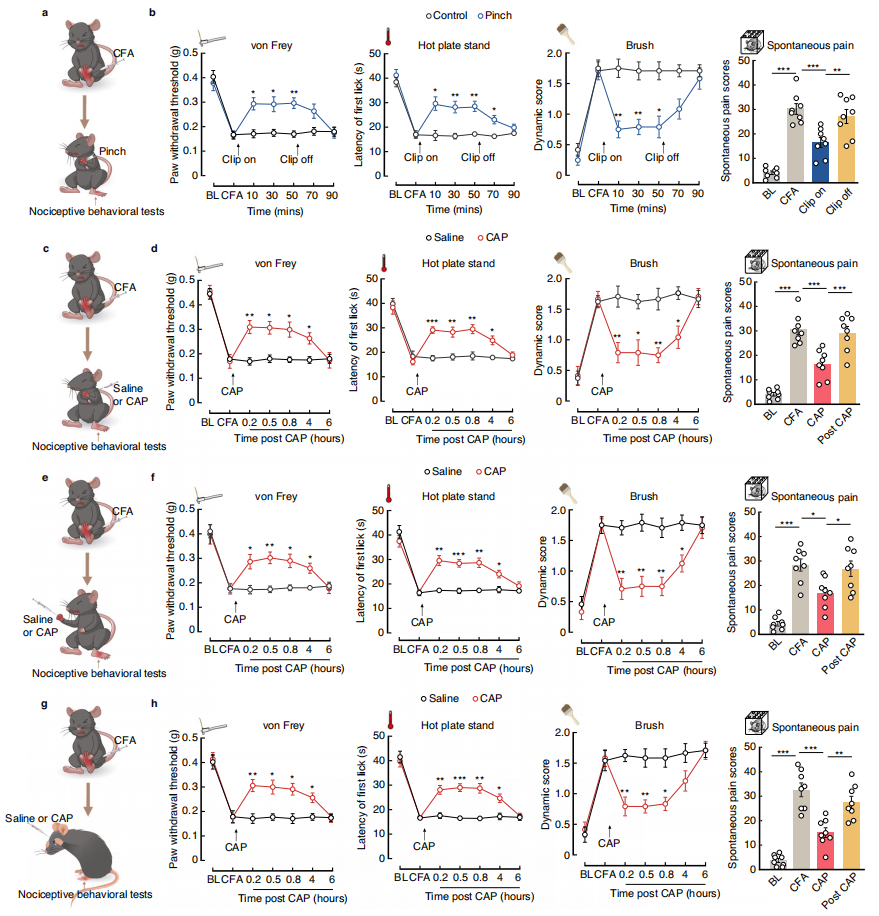
图1 在身体不同部位的有害刺激可诱导小鼠的后爪镇痛
Part . 2 在疼痛诱导的镇痛过程中,次级躯体感觉皮层的神经元活动增加
为了验证是否存在一个神经元集合可能存在于躯体感觉皮层,负责不同部位的疼痛,并介导疼痛诱导的镇痛。研究人员将表达他莫昔芬诱导型Cre重组酶的小鼠FosCreERT2 (Fos-TRAP2)与Ai14-tdTomato小鼠杂交,获得报告小鼠品系FosTRAP2:Ai14。在小鼠腹腔注射4-羟基他莫昔芬(4-OHT)后,向其左前爪、右前爪或脸颊注射辣椒素,2周后处死小鼠,检查全脑切片中tdTomato的表达,以此指示神经元的活动。在注射辣椒素的CFA小鼠中,与对照组相比,左前爪注射辣椒素后,右侧次级躯体感觉皮层(S2)、右侧初级躯体感觉皮层前爪区域(S1FL)和左侧对侧S2(contra-S2)的tdTomato表达显著增加,而右侧初级躯体感觉皮层的后爪区域(S1HL)的tdTomato表达显著降低(图2a-c);右前爪注射辣椒素的CFA小鼠,在对侧S1FL、S2和对侧S2中tdTomato表达显著增加,S1HL中显著减少;脸颊注射辣椒素的CFA小鼠,在岛叶皮层(IC)、初级躯体感觉皮层桶状区域(S1BF)、S2和对侧S2中tdTomato表达显著增加,S1HL中显著减少。这些结果表明,S2中表达c-Fos(被TRAP标记)的神经元在三个测试部位给予疼痛刺激时均增加,且激活的S2神经元主要集中在2-4层(图2d-g),而S1HL中表达cfos的神经元显著减少,表明躯体感觉皮层(S2和S1)参与了疼痛诱导的镇痛。
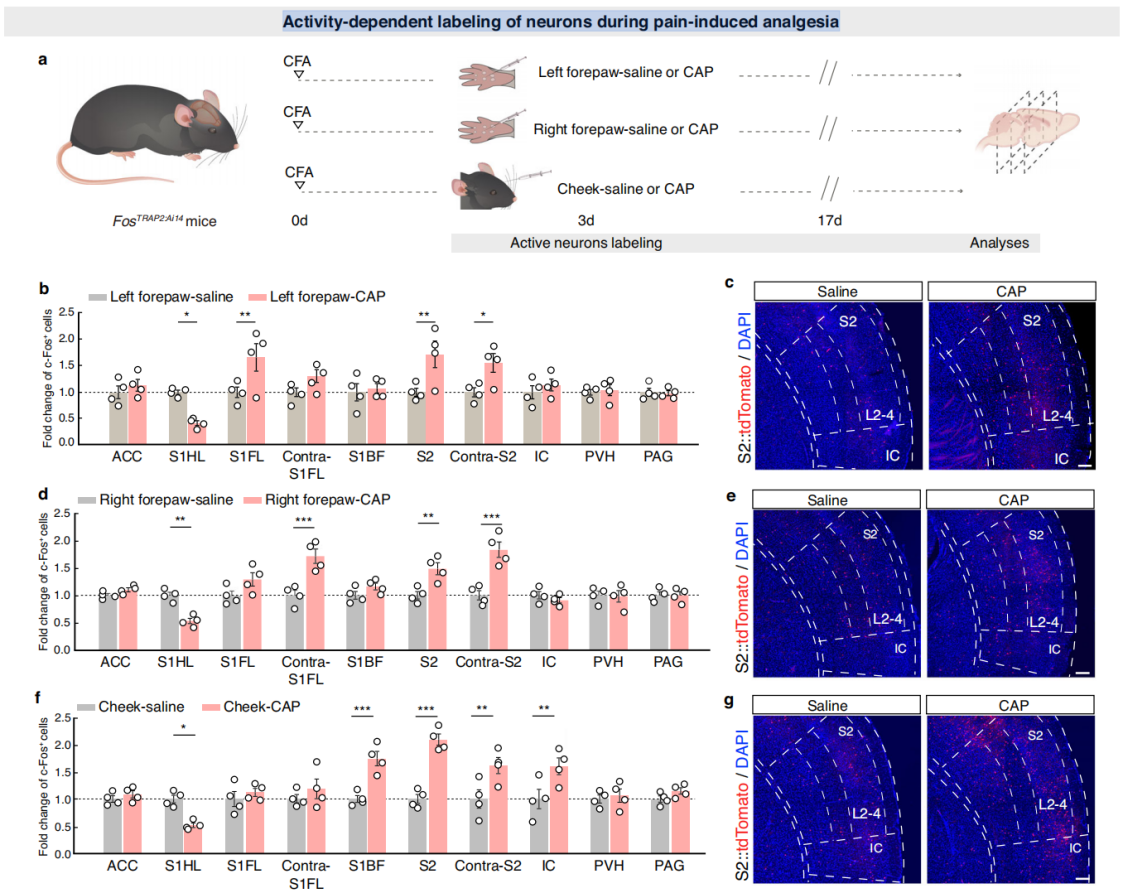
图2 疼痛诱导镇痛过程中神经元的活动依赖性标记
为了研究同一组神经元在不同部位的镇痛过程中是否被激活,研究人员使用FosTRAP2:Ai14 CFA小鼠,捕获右前爪或脸颊注射辣椒素时激活的S2神经元,并对这些小鼠进行c-Fos免疫组织化学染色,以标记左前爪注射辣椒素时激活的S2神经元。结果发现,CFA小鼠左前爪和右前爪注射辣椒素激活的S2神经元重叠率约为70%,左前爪和脸颊注射辣椒素激活的S2神经元重叠率约为72%。同时,通过盐水注射实验排除了S2神经元激活是由基础活动增加导致的可能性。综上所述,不同部位的有害刺激物在S2中激活了同一群神经元(图3h-l)。
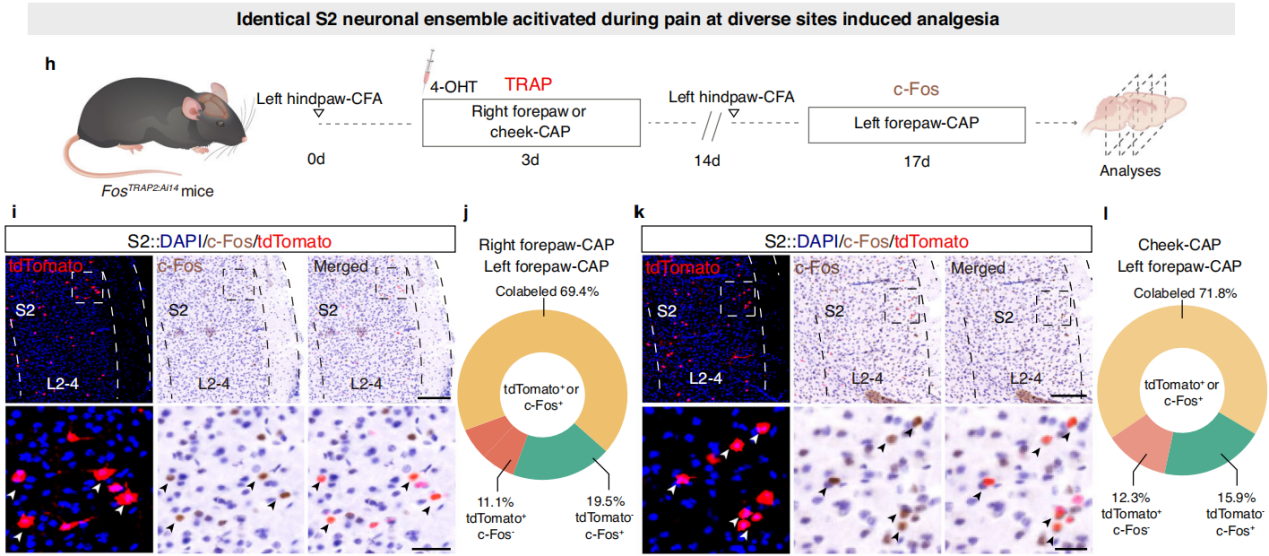
图3 相同的S2神经元集合在不同部位的疼痛过程中被激活
Part . 3 S2通过抑制S1HL-glu神经元活性来介导疼痛镇痛
为了研究S2和S1HL神经元在疼痛诱导镇痛中的潜在作用,研究人员利用微内镜成像技术,通过监测钙反应来同时分析S2和S1HL谷氨酸能神经元(S1HL-glu)的活动模式。向FosTRAP2小鼠的S2注射表达Cre依赖的钙成像指示剂GCaMP6m的腺相关病毒(AAV-DIO-GCaMP6m),S1HL注射AAV-CaMKII-GCaMP6m,并在相应位置安装微内镜梯度折射率(GRIN)透镜(图4a)。向小鼠左前爪注射辣椒素或生理盐水,结果显示,注射辣椒素的CFA小鼠,其被TRAP标记的S2神经元的Ca2+瞬变频率和平均z评分活动显著增加(图4b-c);而S1HL-glu神经元的Ca2+瞬变频率和平均z评分活动显著降低(图4d-e)。
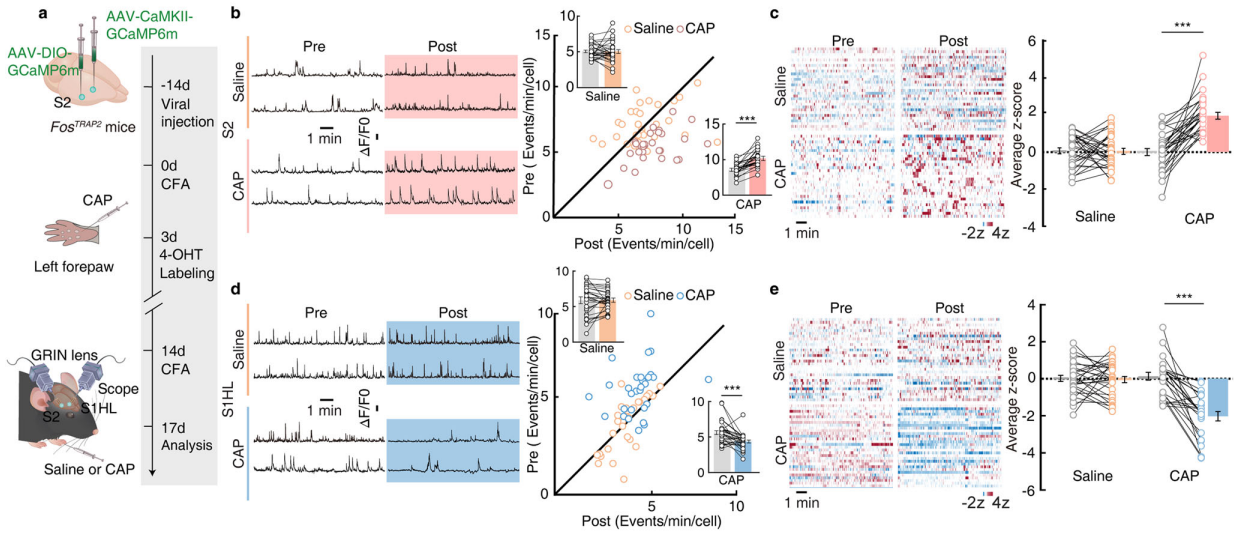
图4 S2和S1HL-Glu神经元在疼痛诱导镇痛过程中的钙活动
研究人员利用化学遗传学方法,向FosTRAP2小鼠S2注入Cre依赖的hM4Di-mCherry病毒(AAV-DIO-hM4Di-mCherry)抑制被TRAP标记的S2神经元,同时向S1HL注入AAV-CaMKII-GCaMP6m病毒监测S1HL-glu神经元活动(图5f)。结果显示,抑制S2神经元消除了注射辣椒素引起的S1HL-glu神经元Ca2+瞬变频率和平均z评分活动的降低(图5g-h),同时阻断了疼痛诱导的后爪镇痛;相反,化学遗传学激活S2神经元会显著增加CFA小鼠的疼痛阈值(图5i-j)。这些结果表明,S2通过抑制S1HL-glu神经元的活动来介导不同部位疼痛诱导的镇痛。
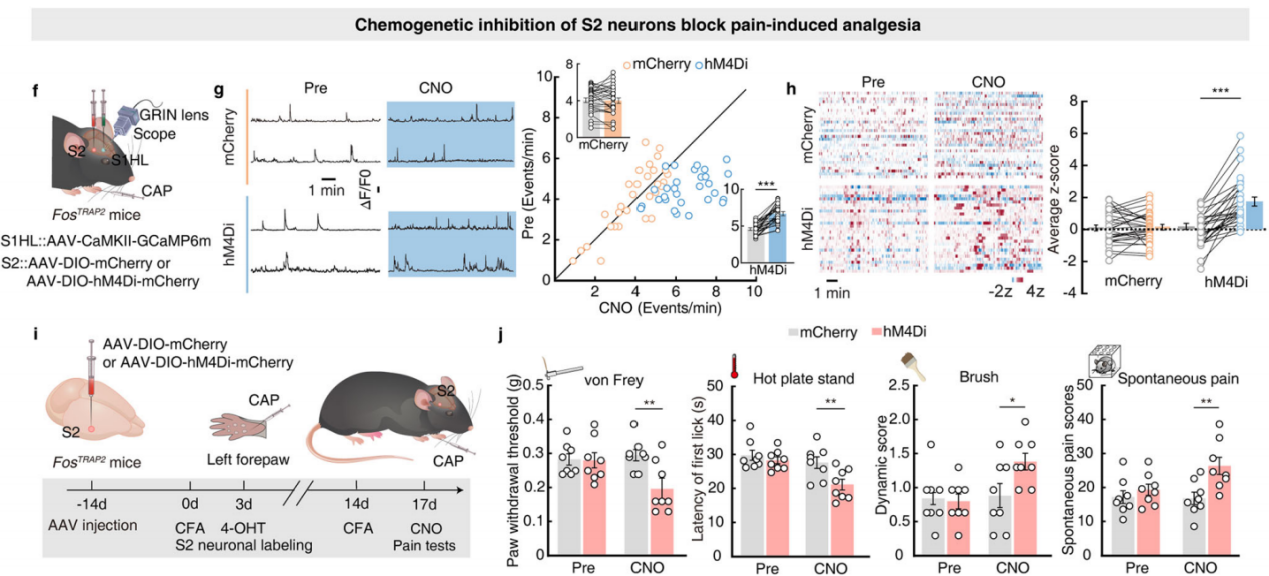
图5 S2神经元的化学生成抑制阻断疼痛镇痛
Part . 4 S2→S1HL前馈抑制环路调控镇痛
利用细胞类型特异性顺向跨单突触示踪系统,向FosTRAP2小鼠的S2注射携带Cre依赖的TK-GFP病毒(AAV-DIO-TK-EGFP),三周后再注射HSV-ΔTK-tdTomato病毒(图6a)。结果显示,在初级运动皮层、初级躯体感觉皮层的多个区域、对侧S2等部位检测到tdTomato+信号,且这些信号主要分布在S1HL的第4层,与谷氨酸特异性抗体共定位约30%,与GABA特异性抗体共定位约65%(图6b-c),表明TRAPed S2神经元主要支配S1HL第4层的GABA能神经元。采用细胞类型特异性逆向跨单突触示踪策略,向CaMKII-Cre小鼠的S1HL注射Cre依赖的辅助病毒,三周后注射狂犬病病毒RV-EnvA(图6d)。在S2中鉴定出大量与谷氨酸能神经元共染的DsRed标记神经元,在GABA合成酶谷氨酸脱羧酶2(GAD2)-Cre小鼠中也有类似发现(图6e-g),说明S1HL-glu和S1HL-gaba神经元均接受来自S2的直接支配。
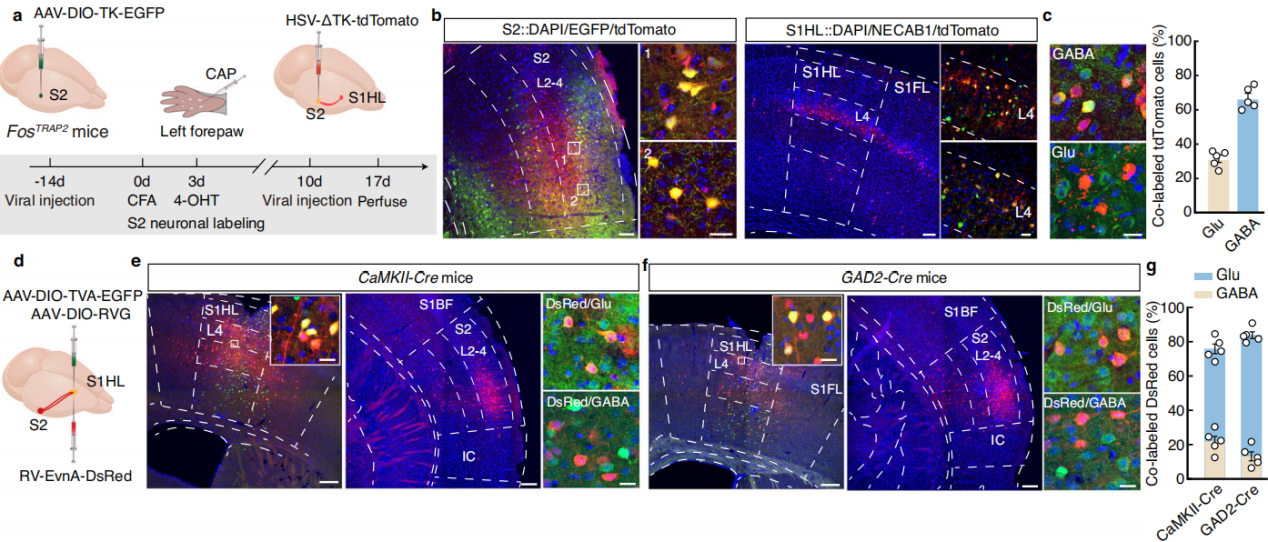
图6 示踪S2→S1HL环路
向FosTRAP2小鼠的S2注入AAV-DIO-ChR2-mCherry病毒,向S1HL注入AAV-CaMKII-GFP病毒(图7h-i),记录S1HL神经元的光诱发突触后电流。在-70mV的保持电位下,光刺激S2纤维可诱发S1HL-glu神经元产生可靠的兴奋性突触后电流(EPSCs),可被离子谷氨酸AMPA受体拮抗剂(DNQX)阻断;在0mV的保持电位下,光刺激还可诱发抑制性突触后电流(IPSCs),它也能被DNQX阻断,且IPSCs潜伏期长于EPSCs(图7j-k),表明S1HL-glu神经元受局部S1HL-gaba中间神经元支配,二者均接受S2直接输入。此外,在GAD2-Cre小鼠的S1HL注入相关病毒后(图7l-m),蓝光刺激局部S1HL-gaba神经元可使S1HL-glu神经元的IPSCs显著增加,且可被GABA受体拮抗剂(bicuculline)阻断(图7n-o),进一步证实了S2→S1HL-gaba→S1HL-glu前馈抑制环路的存在。向FosTRAP2小鼠的S2注入AAV-DIO-hM4Di-mCherry病毒,并在S1HL植入套管,进行化学遗传学抑制实验(图7p)。结果表明,化学遗传学沉默S2-S1环路后,后爪疼痛阈值的增加被消除,且沉默该环路不影响小鼠的运动功能(图7q),说明左前爪的伤害性刺激激活S2→S1HL-gaba→S1HL-glu前馈抑制环路,在不损害运动功能的情况下介导疼痛诱导的镇痛。
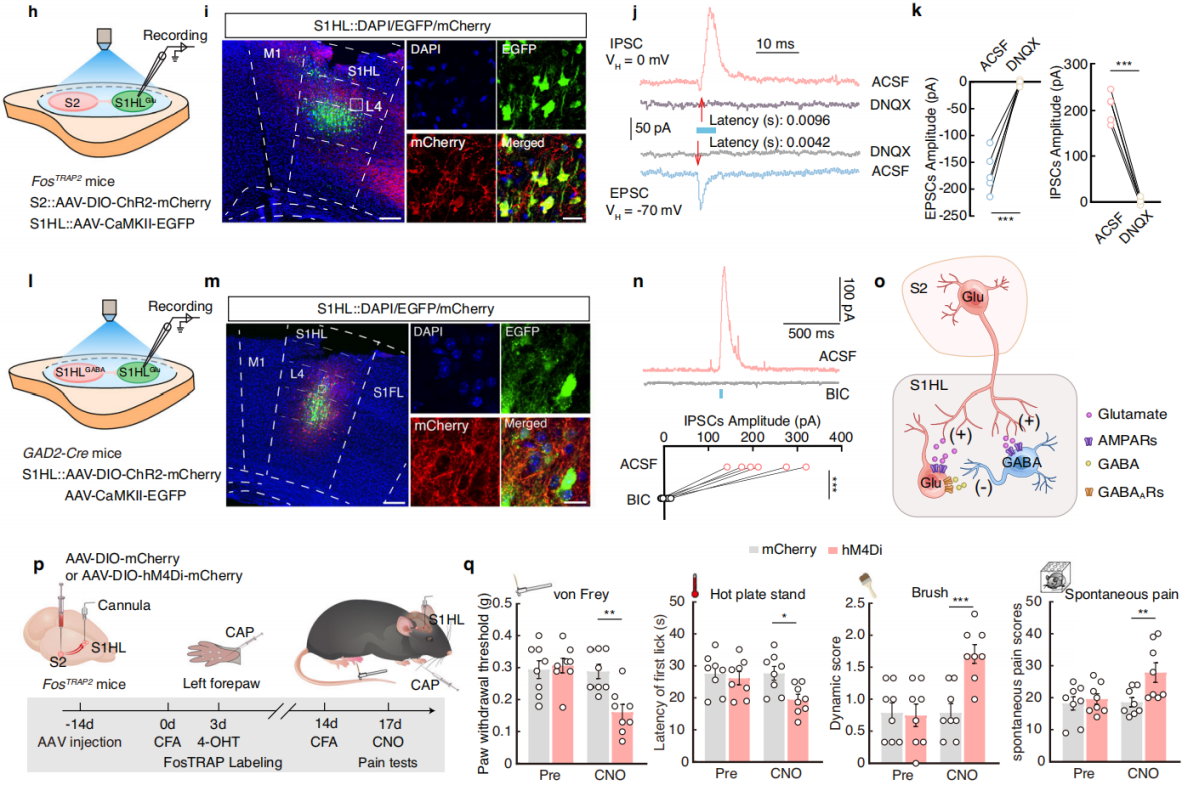
图7 S2→S1HL-gaba→S1HL-glu前馈抑制环路介导疼痛诱导的镇痛
Part . 5 对侧S2→S2→S1HL环路介导对侧疼痛镇痛
以往研究表明,在哺乳动物大脑中,躯体感觉处理具有侧化特征,即身体一侧的感觉信息主要在对侧大脑半球进行处理。已知右前爪(对侧身体部位)的伤害性刺激能抑制左后爪的疼痛相关行为,且右半侧身体的伤害性信息由对侧大脑半球编码。基于此,研究人员推测对侧S2对于S2→S1HL环路的支配,可能在CFA小鼠中,介导右前爪伤害性刺激诱导的左后爪镇痛。为验证该假设,研究人员采用了三级逆行追踪策略。首先,向C57小鼠的S1HL注射retro-AAV-hSyn-Cre病毒;同时向S2注射Cre依赖的辅助病毒;3周后,再向S2注射RV-ΔG-DsRed病毒(图8a)。在注射后进行检测,研究人员在皮层、丘脑等脑区以及对侧S2(且与谷氨酸抗体共定位)中检测到了DsRed+信号(图8b-d)。这一结果表明,S2→S1HL环路确实接收来自对侧S2的直接神经支配。通过向C57小鼠的对侧S2注射AAV-hSyn-Cre病毒,向S2注射AAV-DIO-YPet病毒,利用CLARITY技术使大脑半透明,实现全脑成像(图8e-f),观察S2神经元的投射。结果显示,S2与对侧S2有显著连接,同时向同侧S1和初级运动皮层(M1)投射(图8g-h),还存在大量皮质下投射,表明S2神经元与对侧S2相互作用,并支配S1HL。
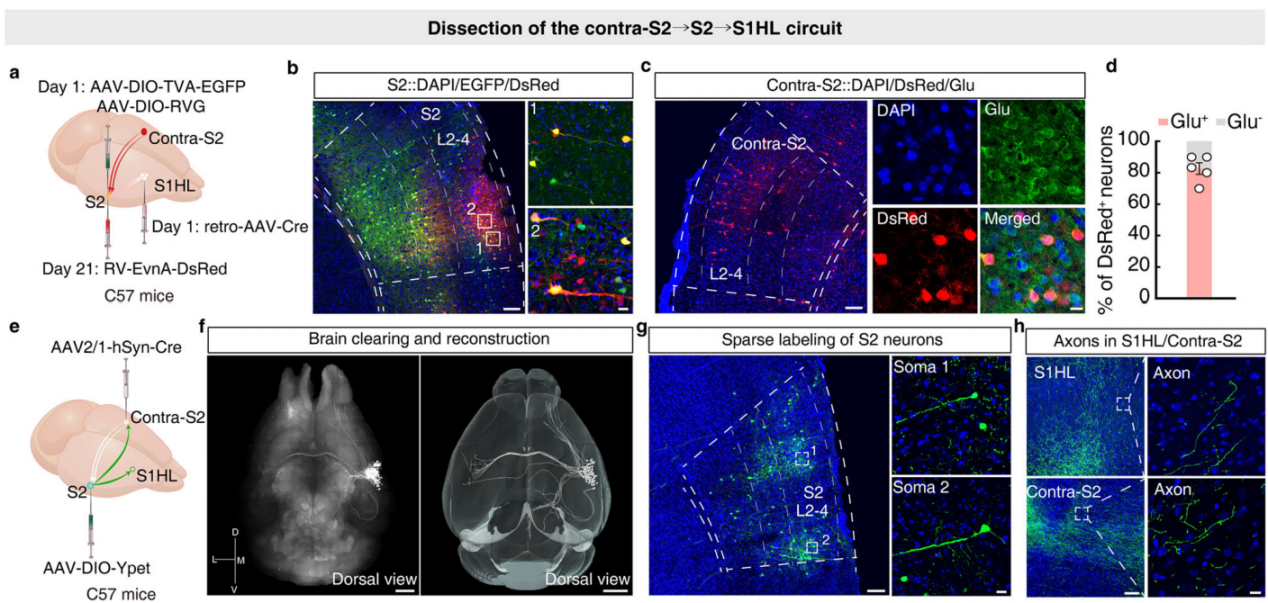
图8 示踪对侧S2→S2→S1HL环路
接下来检测了对侧疼痛诱导镇痛过程中对侧S2、S2和S1HL-glu的神经元活性,向FosTRAP2小鼠的对侧S2、S2和S1HL分别注入AAV-DIO-GCaMP6m和AAV-CaMKII-GCaMP6m病毒(图9i),通过微内镜成像监测钙反应。在向小鼠右前爪注射辣椒素后,发现对侧S2和S2神经元的瞬变频率和平均z评分活动均显著增加,而S1HL-glu神经元的这两个指标显著降低(图9j-o)。
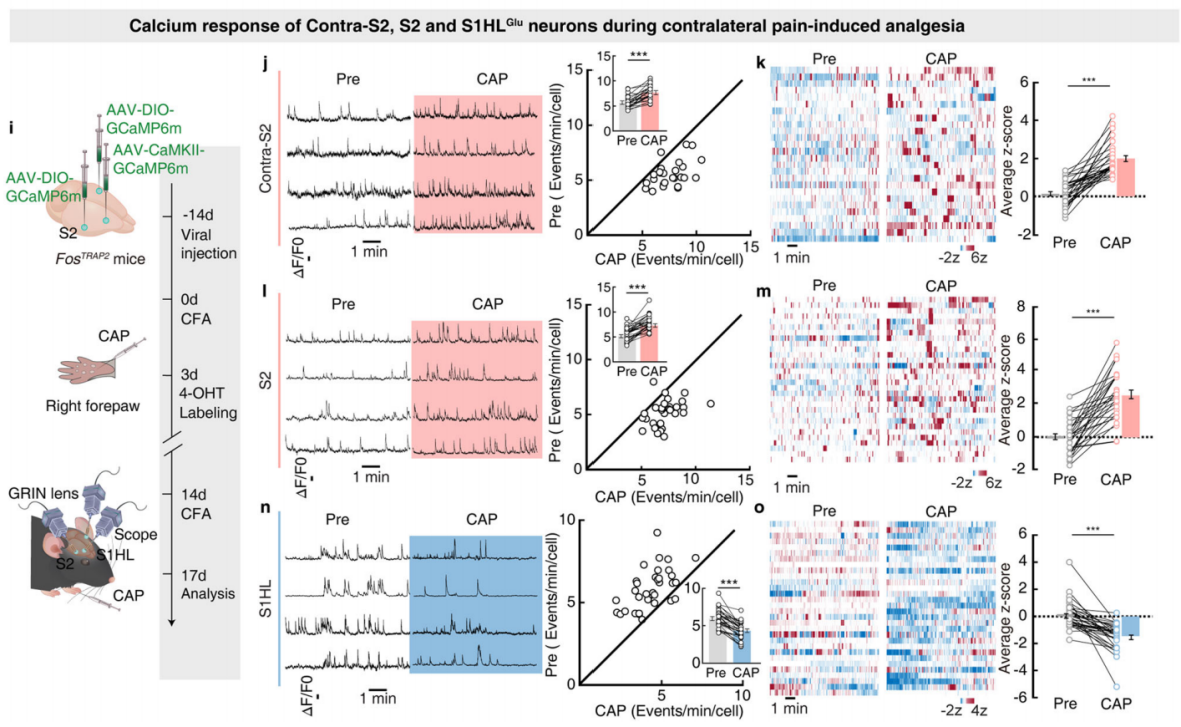
图9 对侧S2、S2和S1HL-glu神经元在对侧疼痛诱导镇痛过程中的钙活动
进一步利用化学遗传学病毒抑制对侧S2神经元,并通过注射AAV-DIO-GCaMP6m和AAV-CaMKII-GCaMP6m病毒来监测S2和S1HL-glu神经元的活性(图10a),结果显示,抑制对侧S2神经元后,由右前爪注射辣椒素引起的CFA FosTRAP2小鼠的S2神经元活动增加和S1HL-glu神经元活动减少均被阻断(图10b-e),表明在对侧疼痛诱导镇痛过程中,对侧S2→S2→S1HL通路被激活。为探究对侧S2→S2→S1HL通路对对侧疼痛诱导镇痛是否必要,研究人员向FosTRAP2小鼠的对侧S2注入AAV-DIO-hM4Di-mCherry或AAV-DIO-mCherry病毒,并在S2植入套管,进行化学遗传学抑制实验。结果显示,抑制对侧S2神经元后,由右前爪注射辣椒素引起的S2神经元活动增加和S1HL-glu神经元活动减少均被阻断,同时后爪疼痛阈值的增加也被消除(图10f-g),证明了对侧S2→S2→S1HL环路在对侧疼痛诱导镇痛中被激活,且是对侧疼痛诱导镇痛所必需的。
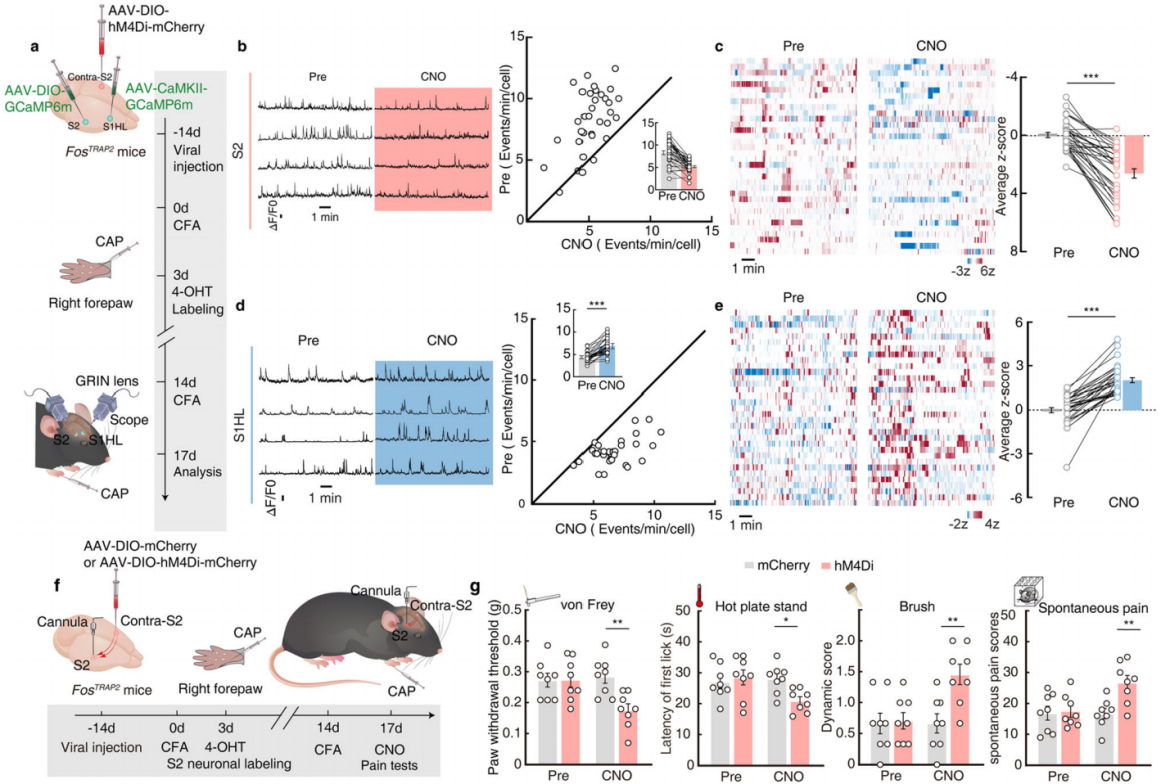
图10 对侧S2→S2→S1HL环路介导对侧疼痛诱导的镇痛
总 结
这项研究首次明确了躯体感觉皮层内介导“疼痛抑制疼痛”的神经环路,拓展了人们对疼痛缓解机制的理解。从基础研究角度看,揭示了S2不同层神经元在疼痛调制中的功能异质性,以及S2与S1连接在协调身体不同部位疼痛感知中的重要性。从临床应用前景来说,为开发新型疼痛治疗方法提供了潜在靶点。未来,或许可以通过精准调控这些神经环路,更有效地缓解慢性疼痛患者的痛苦。
本文使用的工具病毒布林凯斯生物科技有限公司均可提供:

布林凯斯也可提供各类定制服务
请联系小布或者咨询所在区域销售经理
联系电话 18971216876(微信同号)
本文未经授权禁止转载
如有需要,可联系小编获取原文