在大脑研究领域,奖赏中枢一直是科学家们关注的焦点。它可不是一个简单的存在,而是大脑中参与奖赏和愉悦感受的神经结构集合。以往我们知道腹侧被盖区、伏隔核等脑区在其中扮演重要角色,而如今,一个新的脑区——脑室下被盖核(SVTg)进入了大家的视野。SVTg位于脑桥脑干的第四脑室下方,是一个独特的GABA能抑制性核团。
2025年1月24日,匈牙利国家研究与创新办公室实验医学研究所Gabor Nyiri团队,在Science杂志上发表题为“Identification of the subventricular tegmental nucleus as brainstem reward center”的研究论文,揭示了SVTg作为一个新的脑干奖赏中心的功能,它通过整合来自皮层和皮下区域的输入来处理情感价值。SVTg在调节与负面情绪状态相关的脑区(如LHb)中起关键作用,这对于理解情感和恐惧相关障碍的神经基础具有重要意义。
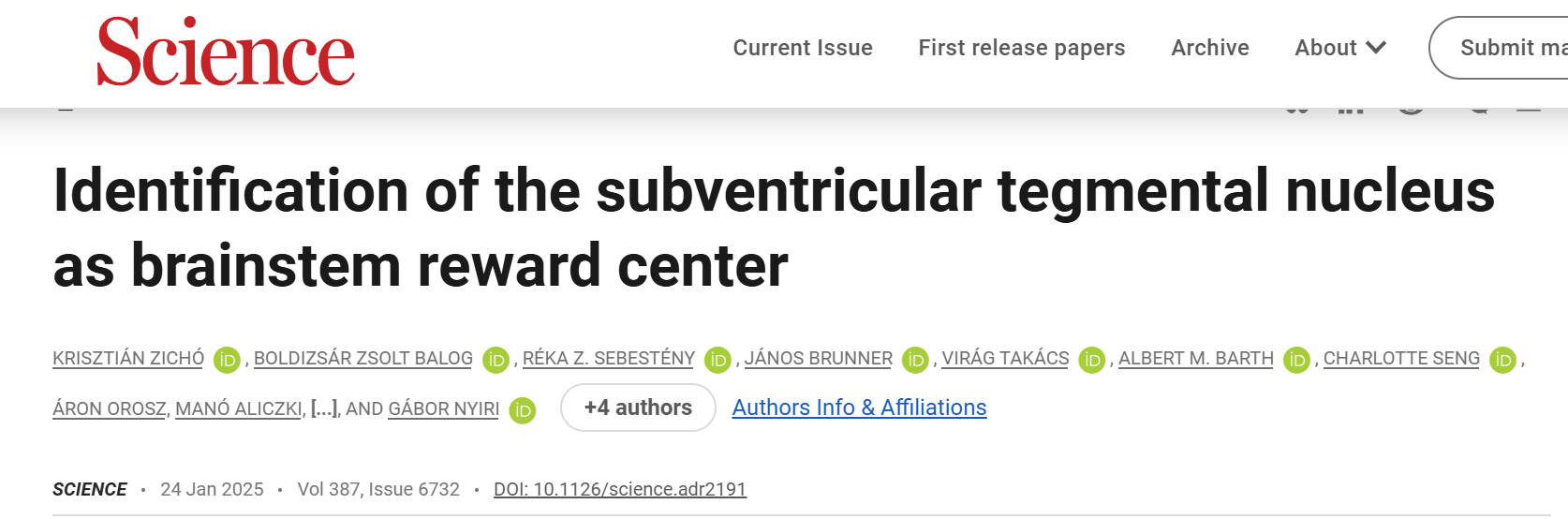
通过向vGAT-Cre小鼠的外侧缰核(LHb)注射一种表达荧光蛋白的、Cre依赖的、逆行传播的腺相关病毒(AAV),研究了LHb的GABA能神经元输入(图1A)。这一实验揭示了一个之前未被识别的大脑区域——脑室下被盖核(SVTg),它位于脑干桥脑中央灰质(PCG)的第四脑室下方(图1B),且大约15%的投射到LHb上的GABA能神经元都来自于SVTg。通过对冠状面和矢状面脑切片进行免疫组化实验,发现SVTg→LHb的GABA能神经元与相邻的背外侧被盖核(LDTg)、蓝斑核(LC)和中缝背核(DR)的神经元群体在位置和细胞特征上有明显的区别(图1C-1F)。SVTg对LHb的投射主要是同侧的,尽管有一些SVTg→LHb神经元位于中线位置。
使用AAV病毒示踪方法(图1G)观察了SVTg纤维在LHb中的分布,结果发现SVTg密集地支配了LHb的整个前后轴向范围(主要集中在LHb的内侧和后部)(图1H),LHb中这些轴突几乎都表达vGAT,但不表达兴奋性神经递质转运体。同一SVTg→LHb神经元的轴突侧支还靶向其他与记忆形成和价值加工相关的皮下区域(图2O-2Q)。LHb神经元将负性价值信号传递到VTA,为了研究投射到VTA的LHb神经元(LHb→VTA)是否直接被SVTg→LHb神经元抑制,作者结合AAV1型顺行和AAV11型逆行病毒示踪技术,结果发现SVTg神经元与LHb→VTA神经元的细胞体和树突形成了含有gephyrin(抑制性突触后蛋白)的突触连接(图1,I和J)。
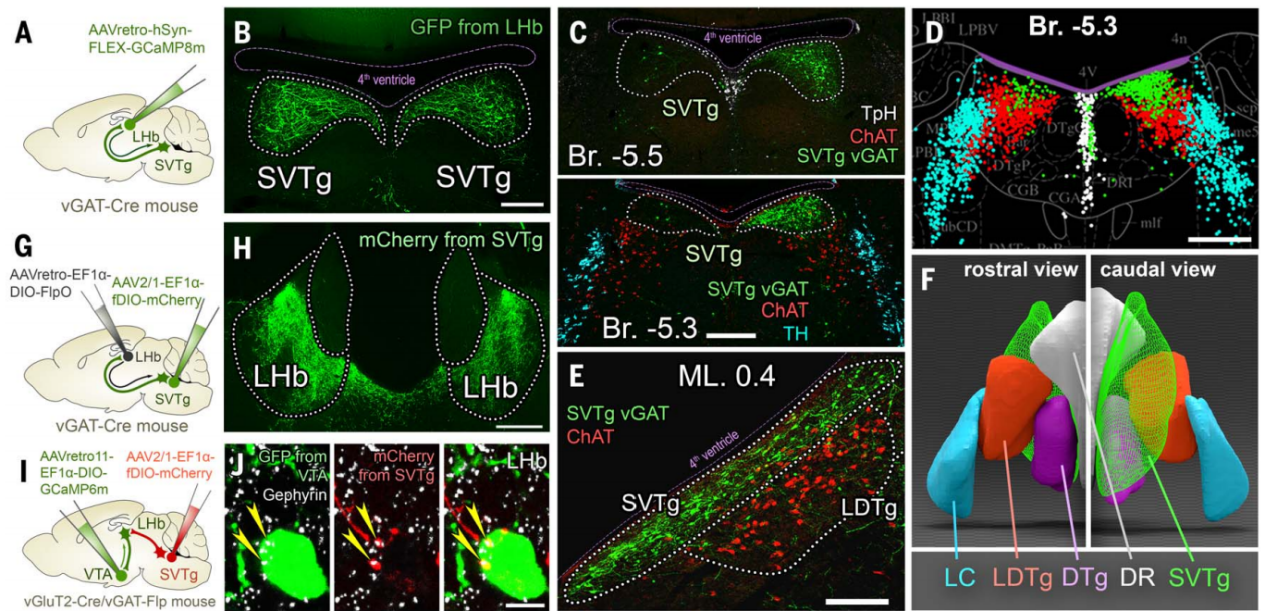
图1 SVTg神经元与LHb→VTA神经元存在突触连接
电子显微镜显示,SVTg与LHb→VTA神经元形成了典型的GABA能对称性突触(图2,K和L),并且这类突触在LHb的突触后膜含有GABAγ2受体和gephyrin(图2,M和N)。这些结果表明SVTg神经元对LHb存在特定的环路抑制。为了研究SVTg和LHb神经元之间的功能连接,作者使用了体内多通道电生理记录和光遗传学方法。在vGAT-Cre小鼠LHb注射逆向感染SVTg神经元并表达ChR2的Cre依赖型AAV,在SVTg上方植入了一根光纤(图2R),结果发现在光遗传刺激SVTg神经元时,至少有23%的LHb神经元活动降低(图2,T和U)。此外,LHb神经元反应潜伏期显示,在激光脉冲开始后的10到20毫秒时间窗口内,放电率迅速降低(图2V)。这些结果表明,SVTg可以直接抑制参与编码负面行为的LHb神经元。
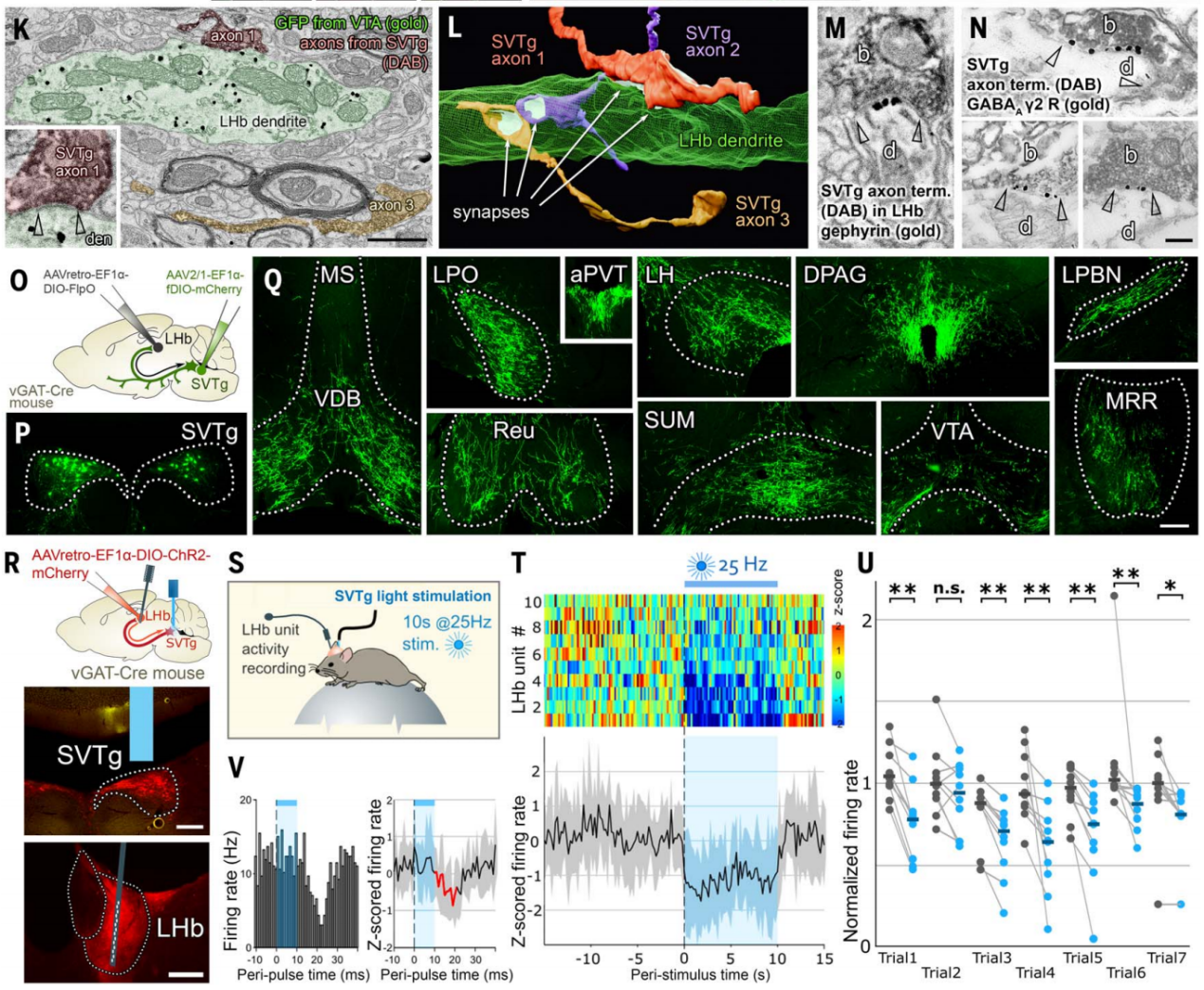
图2 SVTg通过GABA能突触抑制LHb神经元
据文献报道抑制LHb可以诱导奖赏体验,作者在行为实验中测试了光遗传学刺激SVTg的效果。在vGAT-Cre小鼠LHb中注射表达ChR2的逆向示踪AAV,感染SVTg→LHb神经元,在SVTg上方植入了光纤(图3A)。实时位置偏好(RTPP)和条件位置偏好(CPP)测试(图3B)结果显示,与CTRL小鼠不同,ChR2小鼠在4Hz和20Hz光照刺激下,对RTPP测试中接受过刺激的箱子表现出强烈即时偏好;在CPP测试中,之前接受20Hz刺激的ChR2小鼠对之前接受过刺激的箱子表现出位置偏好(图3,C和D);在适应期小鼠对双室箱都没有偏好(图3C)。为了证明靶向LHb的SVTg纤维直接负责诱导位置偏好行为,作者进行了类似的实验,但只在LHb中刺激SVTg纤维(图3E),并进行了与上述相同的RTPP和CPP实验。同样,实验发现与CTRL小鼠相比,ChR2小鼠对接受刺激的箱子显示出强烈的RTPP和CPP(图3F)。这表明SVTg的激活能够引发小鼠积极的奖赏体验,在将奖赏信号传递和转化为行为偏好的过程中起作用。
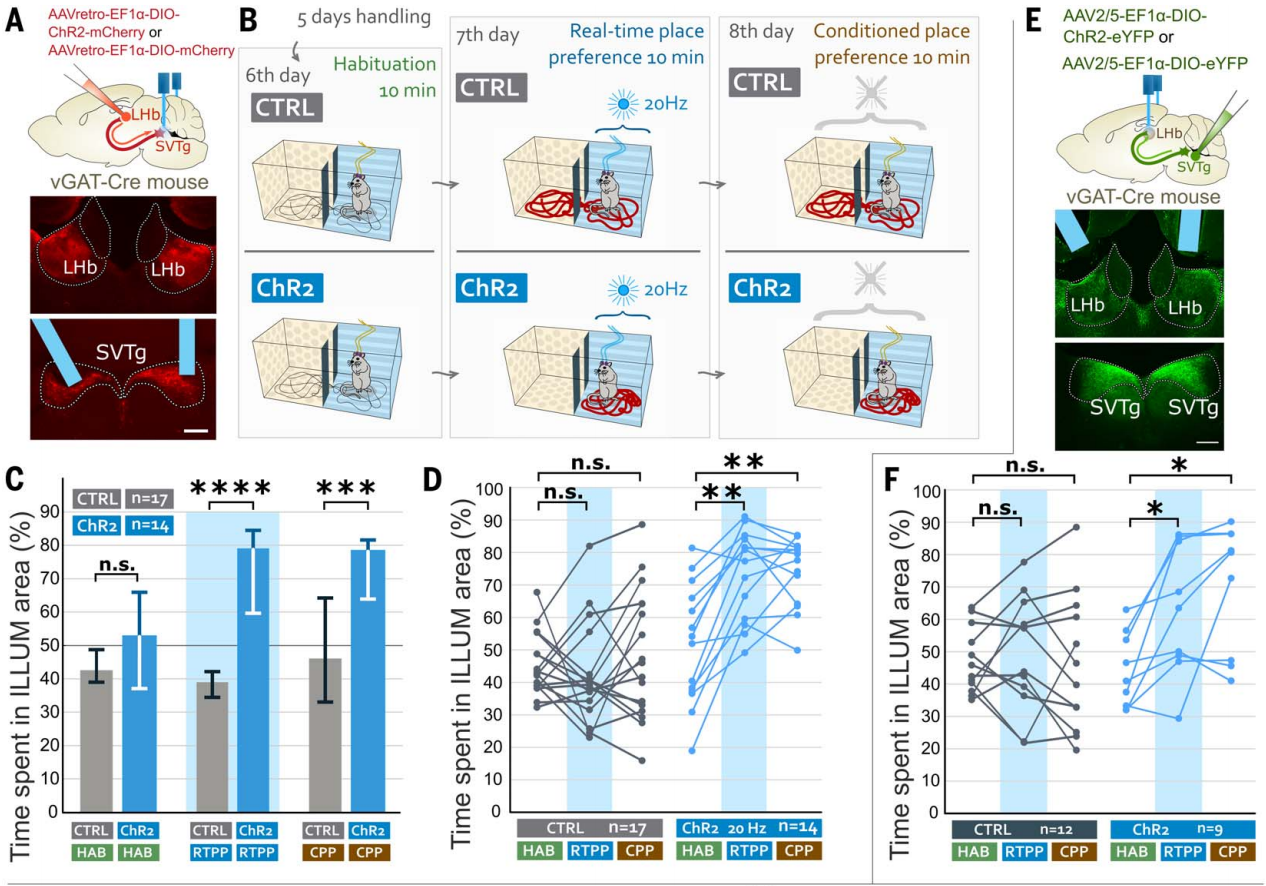
图3 SVTg神经元诱导小鼠奖赏体验
为了测试小鼠是否会主动激活SVTg神经元,作者进行了光遗传学自我刺激实验。在vGAT-Cre小鼠LHb中注射表达ChR2的逆向示踪AAV,感染SVTg→LHb神经元,在SVTg上方植入了光纤(图4G)。限制饮食的小鼠在操作性条件反射任务中接受了10天的训练,只有当小鼠将鼻子伸入预定义的(ILLUM)孔时,才会受到光刺激(图4H)。结果发现,与CTRL小鼠相比,ChR2小鼠更频繁地将鼻子伸入ILLUM孔(图4I)。在没有光刺激的情况下测试了ChR2小鼠对ILLUM孔偏好的记忆,发现它们仍然比CTRL小鼠更偏好ILLUM孔(图4,I和J)。这些结果显示,SVTg的激活具有奖赏效应,并且小鼠会主动激活自己的SVTg,这也表明SVTg在驱动奖赏寻求行为中可能发挥作用。
为了研究光遗传学激活SVTg是否能够减轻小鼠的焦虑,将ChR2小鼠和CTRL小鼠放在高架十字迷宫(EPM)上,在整个实验过程中,它们持续接受4 Hz的光刺激,持续时间为10分钟(图4,K和L)。与CTRL小鼠相比,ChR2小鼠在开放臂上停留的时间更长,并且进入开放臂的次数更多(图4M),这表明激活SVTg可能具有抗焦虑的效果。
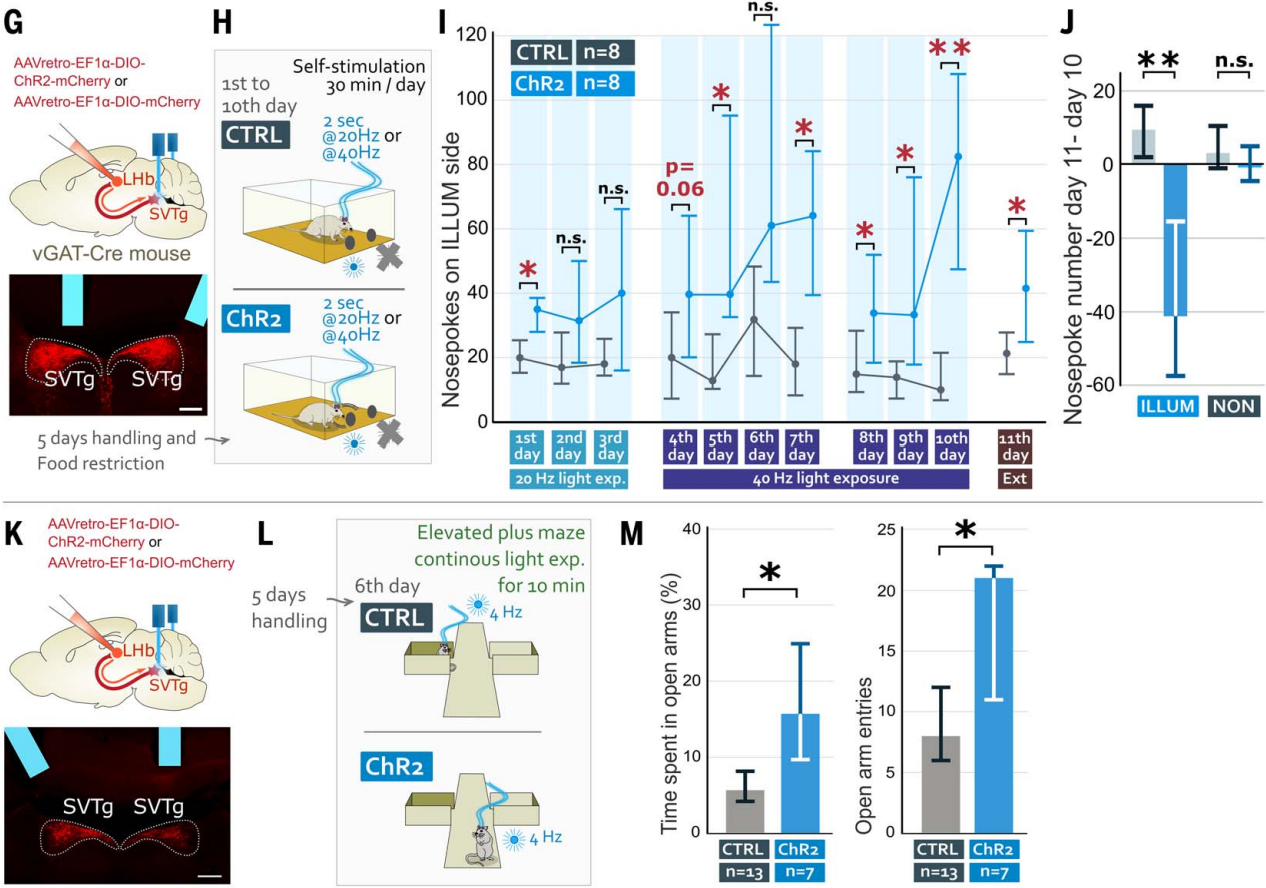
图4 小鼠可以自我刺激SVTg并发挥抗焦虑的作用
伏隔核(NAc)中的多巴胺释放可以传递奖赏体验的信号。尽管SVTg并没有直接投射到NAcc(图2Q),但作者研究了SVTg是否可以通过已知的LHb→VTA→NAcc通路调节奖赏行为。在vGAT-Cre小鼠注射表达ChR2的AAV,感染SVTg→LHb神经元,使用另一种AAV在NAcc中表达多巴胺指示剂(DA4.4-GRABDA),并在SVTg植入光纤进行光遗传学刺激和记录多巴胺释放。实验发现,激活SVTg也可以引发NAcc中多巴胺释放(图5A-5C),其释放水平与水奖赏刺激下的情况相似(图5C)。这些结果进一步证实了SVTg可以通过调节多巴胺介导奖赏反应。
为了测试自然奖赏是否会在SVTg神经元中触发即早基因表达,作者研究了在食物奖赏后SVTg神经元的c-Fos表达情况。首先,在vGAT-Cre小鼠的SVTg→LHb神经元中用表达GFP的AAV进行感染。将限制食物的小鼠分为两组:一组在新环境中接受含蔗糖的奖赏颗粒(REW小鼠),另一组则被放入相同环境中但没有奖赏颗粒(CTRL小鼠)(图5D)。结果发现,与CTRL小鼠相比,奖赏诱导REW小鼠SVTg中c-Fos活性增加(图5,E和F)。钙成像实验结果发现,在训练有素、头部固定、限制饮水的小鼠中,水奖赏都能诱导SVTg神经元的活动增加(图5G-5J)。
为了研究对奖赏的期望是否会激活SVTg神经元,使用上述小鼠群体,其中SVTg→LHb神经元表达了GCaMP8m。结果发现中性刺激(如纯音或短或长环境光照)并不会激活头部固定小鼠的SVTg神经元(图5K-5M)。在随后实验的第一天,限制饮水的小鼠被训练学习,在2秒音调播放结束时给予小鼠一滴水(图5K)。在第二天,发现预测奖赏的音调增加了SVTg神经元的活动,而没有影响对照信号(图5,L和M)。这些结果进一步表明,SVTg的活动与奖赏预测相关。
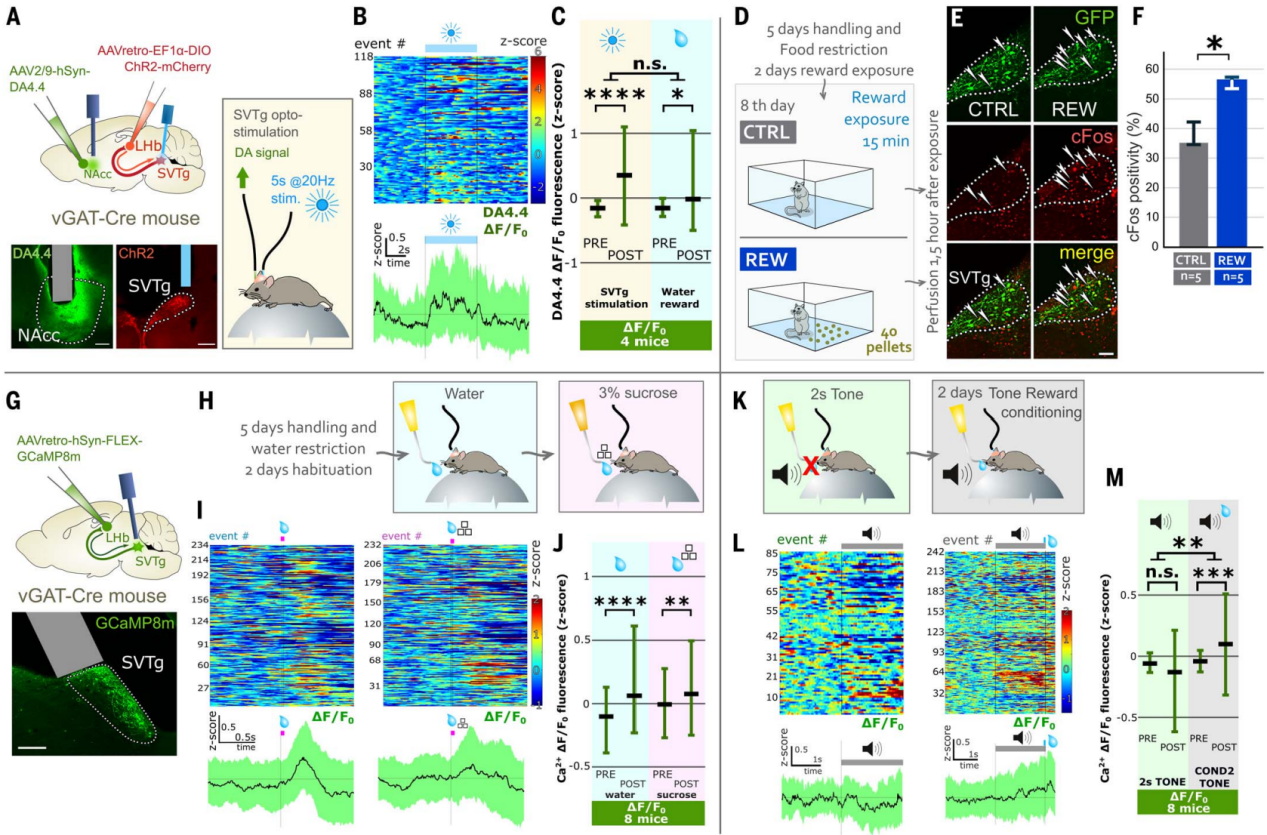
图5 SVTg诱导NAc中多巴胺释放并被奖赏体验激活
要记住之前找到的食物在哪里,需要把“奖赏”的感觉和那个食物的位置联系起来。为了测试SVTg在这些过程中的作用,作者使用了一种食物诱导的位置偏好范式。用表达抑制性光敏蛋白stGtACR2的AAV逆向感染SVTg→LHb神经元,在SVTg上方植入了光纤(图6A)。经过适应性处理和食物限制后,小鼠被放入双箱适应6天,适应期CTRL和stGtACR2小鼠均没有表现出位置偏好(图6,B和C)。在第7天和第8天,小鼠只在其中一个箱内接受40个蔗糖颗粒,并给光照刺激(图6B),结果与CTRL小鼠相比,stGtACR2小鼠对含颗粒位置的偏好更低。在第9天,小鼠既没有收到颗粒,也没有光纤光刺激,结果CTRL小鼠对之前食物所在的位置表现出偏好,而stGtACR2小鼠则没有(图6,C和D),这表明SVTg的正常活动对于奖赏位置记忆是必要的。
作者进一步通过光遗传抑制调控,研究SVTg的活动是否对于维持平衡的价值环路是必要的,结果光刺激SVTg后发现stGtACR2小鼠立即表现出实时位置厌恶(RTPA)和条件性位置厌恶(CPA)(图6F-6H)。这些结果表明SVTg 可能具有基线神经元活动,在空间探索期间保持健康的效价检测和动机状态。
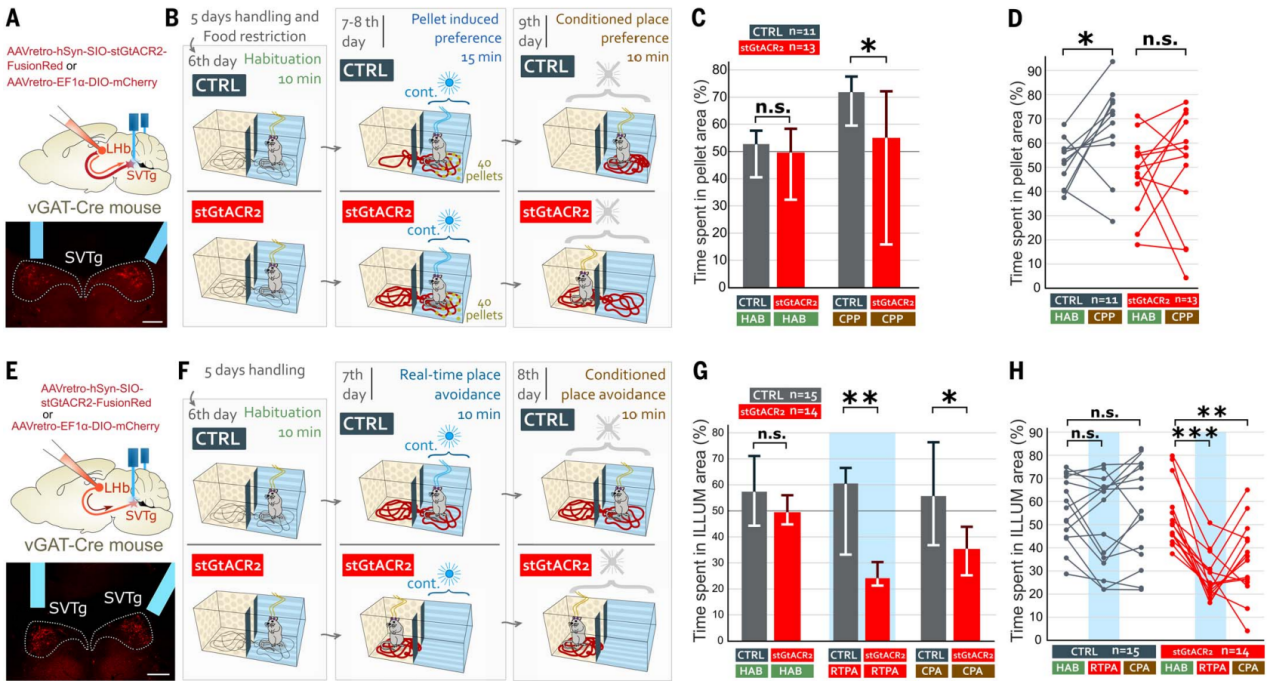
图6 抑制SVTg会破坏食物诱导的偏好学习并诱导回避
此外,作者还研究了SVTg在平衡恐惧反应中的作用。使用钙成像技术记录了在厌恶事件期间SVTg的神经元活动(图7,A和B),结果发现气流的厌恶刺激会引起SVTg神经元的快速激活(图7C-7E)。进一步的给予10次随机气流的厌恶刺激,结果发现,与最后五个气流相比,最初的五个气流引起了更强的SVTg激活(图7F-7H)。此外,最初的三组气流比最后三组气流引起了更强的SVTg激活(图7I)。这些结果表明SVTg相关环路或SVTg神经元内部发生了快速的适应性变化,对早期刺激的反应更为强烈,随后逐渐减弱。
为了研究这种快速自然激活的SVTg神经元在防止过度的恐惧反应中是否是必要,作者测试了小鼠在抑制SVTg神经元活动的情况下如何应对恐惧。在vGAT-Cre小鼠的SVTg→LHb神经元中,用表达stGtACR2的AAV进行感染,在SVTg上方植入了光纤(图5J)。结果发现在足底电击实验中,抑制SVTg会使小鼠在原始情境CTX-A和新情境CTX-B中的恐惧反应(冻结时间)显著增加,而激活SVTg能抑制小鼠在CTX-A中的恐惧反应(图7,J和K)。这些数据表明,SVTg通过平衡恐惧反应,控制恐惧记忆形成的强度以及防止异常的过度泛化。
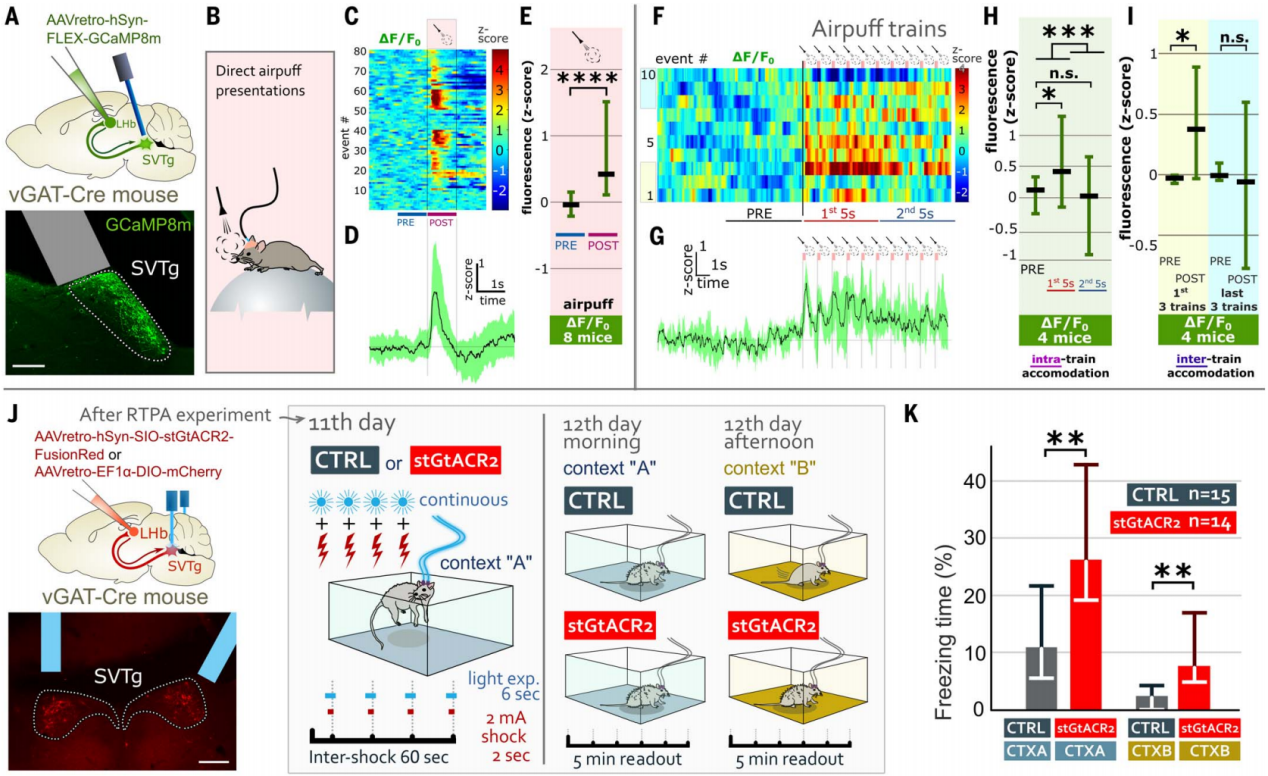
图7 SVTg神经元被厌恶事件激活来控制恐惧记忆的形成
为了确定哪些脑区通过直接突触连接靶向SVTg神经元,作者使用了跨单突触狂犬病毒(RV)示踪技术。在vGAT-Cre小鼠中直接用Cre依赖型辅助病毒感染SVTg神经元,并在同一小鼠的LHb中注射逆行RV(图8,A和B)。结果发现,几个编码价值、动机和厌恶情绪的关键脑区均通过单突触靶向SVTg GABA能神经元,其中包括在厌恶行为中起基础作用的中缝核区(MRR),还发现几个高阶联合皮层区域,如眶额叶皮层(OFC)和前扣带皮层(ACC),也靶向SVTg神经元(图8,C和D)。

图8 跨单突触示踪SVTg神经元的上游脑区
前面行为学实验和示踪实验结果表明奖赏预测激活SVTg可能受到高阶联合皮层的调控,为了进一步确认这一点,作者在vGluT1-Cre小鼠的SVTg一侧逆向感染了皮层神经元(图9,E和F)。结果发现,OFC中逆向标记的锥体细胞数量最多,而其他高阶联合皮层,包括ACC和其他前额叶皮层区域,也靶向SVTg(图9G)。免疫组化光学和电子显微镜成像证实,OFC通过兴奋性轴突末端靶向SVTg神经元的树突和细胞体,这表明SVTg可能在高阶OFC执行与奖赏相关的功能中发挥直接作用。
在vGluT1-Cre小鼠的OFC注射表达ChR2的AAV,并在SVTg上方植入光纤,进行位置偏好和恐惧条件反射实验(图9H)。结果发现刺激OFC在SVTg的轴突终端,ChR2小鼠在RTPP和CPP测试中对刺激侧表现出偏好(图9I),且在恐惧条件反射实验中,OFC纤维激活能降低ChR2小鼠在CTX-A中的恐惧反应(图9J-9K)。这些实验表明,OFC可能通过SVTg在价值处理中发挥作用。
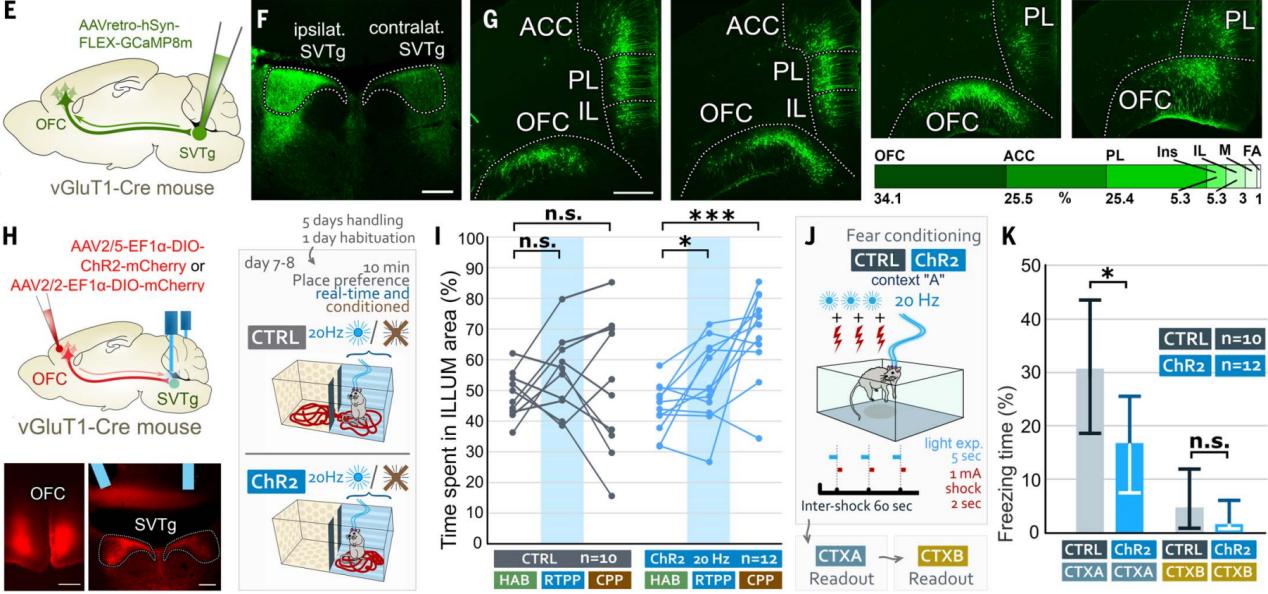
图9 SVTg介导OFC诱导的奖赏处理
通过对SVTg神经元的输入神经递质系统的特征进行分析,更好地理解了SVTg的作用。利用单细胞mRNA测序,作者对SVTg GABA能神经元的全部mRNA库进行了表征(图10A)。结果显示SVTg神经元中表达GABA能神经元标记物(GAD65、GAD67、GAT1和vGAT),以及多种与奖赏相关的受体基因,还高表达reelin(Reln)、钙通道1G(Cacna1g)和特定转录因子基因(Satb1、Pax6)(图10B-10D);进一步的免疫染色表明,几乎所有SVTg神经元在中脑这一核团的整个头尾方向范围内均表达Satb1、Pax6和Reln,且Satb1是识别脑桥中SVTg的最佳候选标记(图10D);体外电生理记录发现所有SVTg神经元都能产生爆发式放电,其活动受皮质和皮质下谷氨酸能控制(图10E-10G);血清素对SVTg神经元有双重兴奋作用,通过至少两条独立途径介导,且SVTg神经元接受血清素能轴突纤维的支配,部分形成经典突触(图10F)。
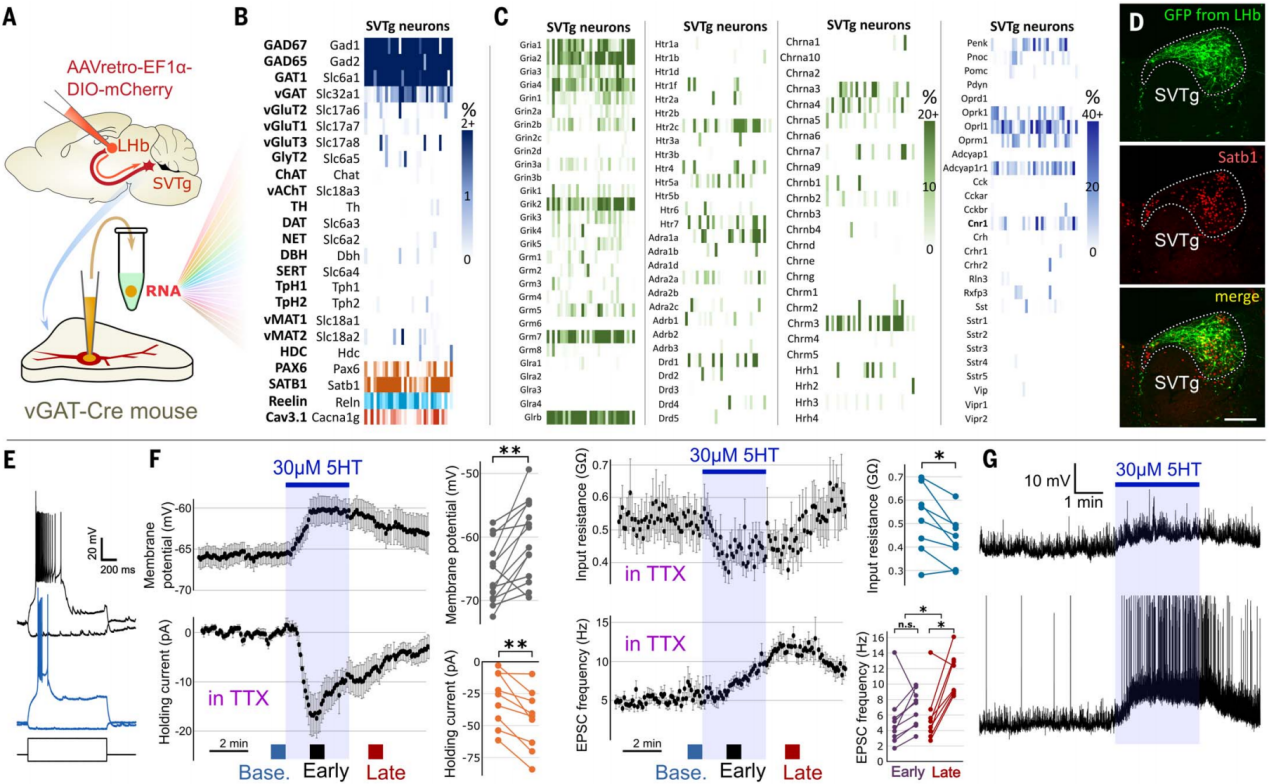
图10 SVTg神经元的基因表达谱和体外电生理特性
桥脑脑干被认为是进化上非常古老且高度保守的区域,因此其神经元群体很可能存在于大多数哺乳动物的大脑中,甚至可能更加进化。由于Satb1在小鼠脑干的SVTg神经元中具有高度特异性(图10D),作者利用它来定位大鼠、猕猴(猕猴属,Macaca mulatta)和人类桥脑中的SVTg。结果发现在大鼠、猕猴和人类的脑干中都发现了Satb1阳性的SVTg神经元,其位于第四脑室下方,在LDTg、LC和DR神经元之间,表明SVTg在进化上高度保守(图11)。
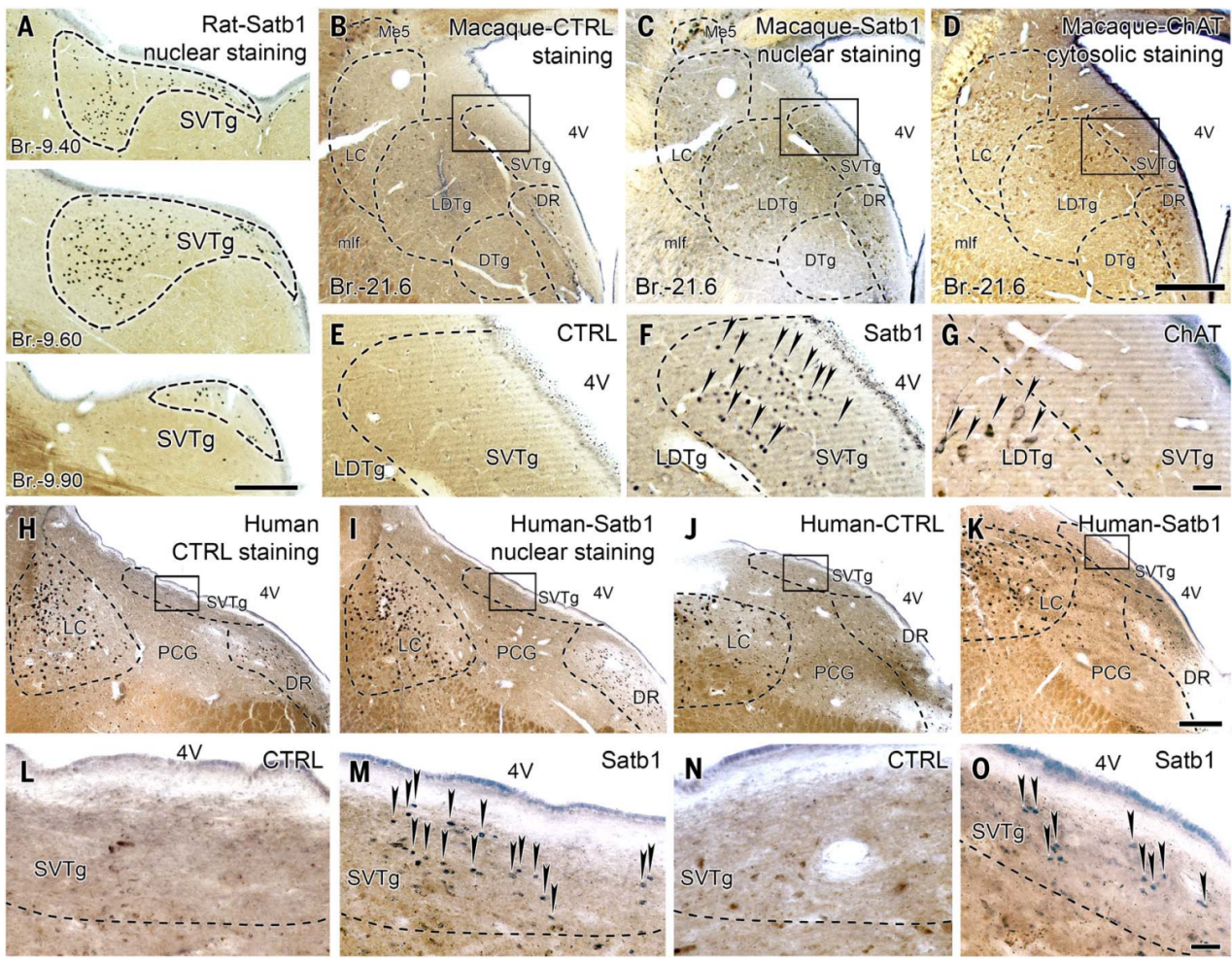
图11 在大鼠、猴子和人类脑桥背侧发现了Satb1阳性SVTg神经元
1、发现新的脑干奖赏中心:研究首次识别并命名了位于第四脑室下方的脑干核团——SVTg,并证实其为一个GABA能抑制性核团,对调节奖赏处理和情感价值评估具有关键作用。
2、揭示SVTg的功能作用:通过多种实验方法,研究证实SVTg在奖赏和奖赏预测线索的激活下,能够促进正向情感状态,减少焦虑,并通过抑制LHb来调节奖赏相关的多巴胺释放。
3、阐明SVTg的神经环路:研究详细描述了SVTg与多个脑区的连接关系,包括其对LHb的直接抑制作用,以及与前额叶皮层、伏隔核等区域的相互作用,揭示了其在情感和动机调节中的复杂神经网络。
4、潜在的临床应用:研究结果提示SVTg可能在焦虑、抑郁等情绪障碍以及成瘾行为中发挥重要作用,为未来的治疗方法提供了新的靶点,例如通过调节SVTg的活动来缓解相关症状。
在神经科学研究中,常用的AAV血清型有1、2、5、6、8和9型,但它们低效的逆行转导倾向限制了其在投射网络研究或疾病治疗中的应用。尤其是研究某核团接收上游特定类型神经元input环路时,需要用到一些低毒性的,较容易制备的逆行的转导病毒。科学家们在 AAV2 的基础上,通过定向进化的方式改造出一种具有逆向示踪功能的AAV2 突变体—AAV2-retro,该血清型能够在小鼠大脑中进行有效的神经环路逆向标记,且其逆行示踪能力和效率与传统的逆行示踪剂相当。
然而,徐富强教授团队通过研究发现,AAV2-retro血清型对于如尾状核(CP)、伏隔核(ACB)、无名小体、终纹床核、外侧下丘脑区(LHA)、外侧前视区、黑质网状部、运动相关的上丘脑、中缝核等核团的感染效率较低。像CP和ACB这两个富含GABA能神经元且与VTA直接相连的区域,几乎没有发现细胞体被AAV2-retro标记(图1)。
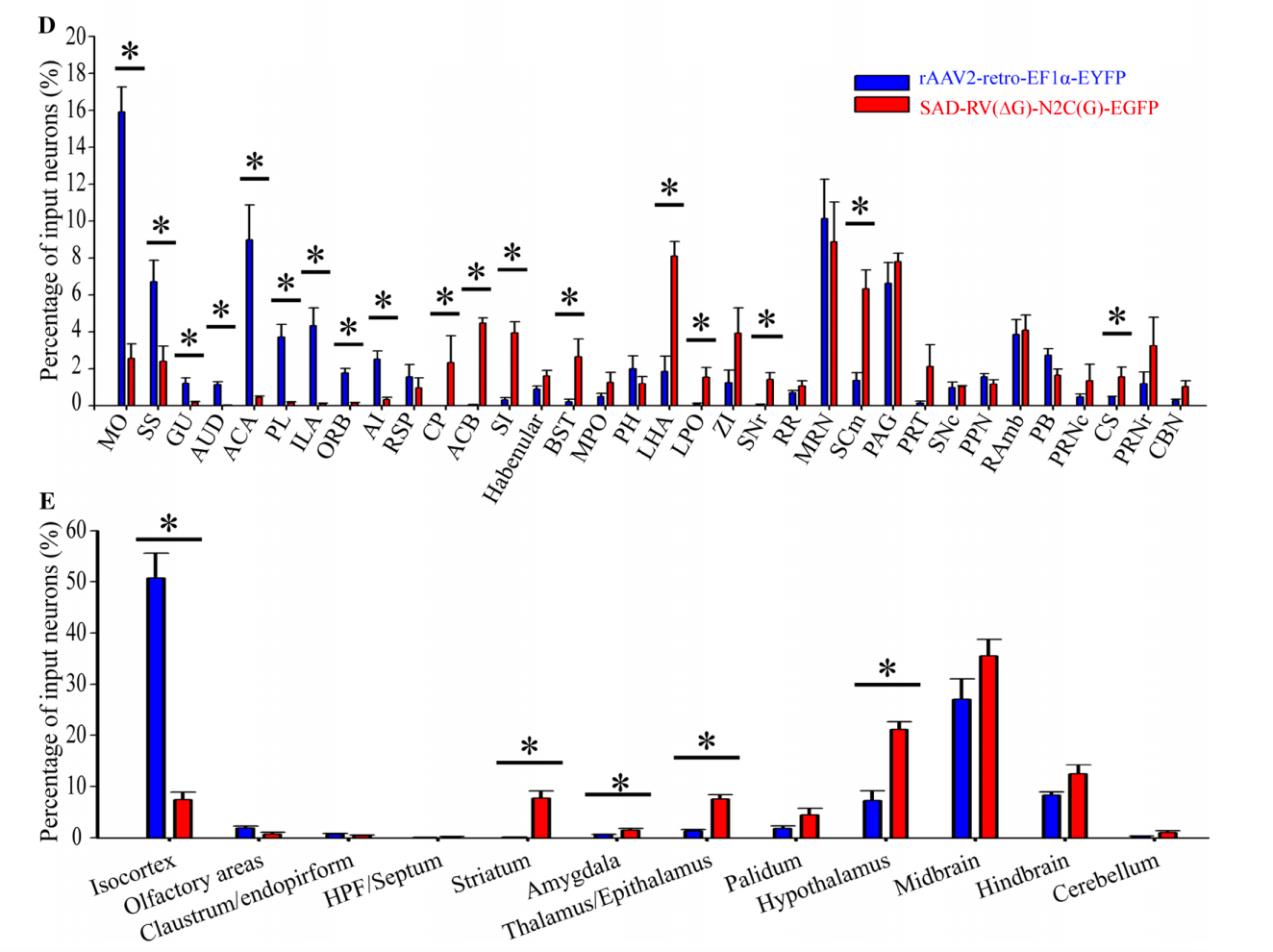
Fig. 1 Retrograde infection tropism biases of SAD-RV(DG)-N2C(G) and rAAV2-retro injected into the VTA. Zhu X, Lin K, Liu Q, et al, [J]. Neuroscience bulletin Ref 1
Gabor Nyiri和Szabolcs Káli团队发现利用AAV2-retro很难验证SVTg→LHb神经元是否能够直接抑制投射至腹侧被盖区(VTA)的神经元。正如我们前面提到,AAV2-retro血清型在一部分核团中,感染特定类型神经元末梢的效率较低。在经过了多次标记未果后,Gabor团队联系了徐富强团队的林坤章博士和BrainCase,尝试运用团队最新发表的新型逆标AAV11血清型病毒,从而最终明确,SVTg→LHb的GABA能神经元能将负性价值信号传递到VTA这条新的环路。
AAV11的逆标应用是徐富强教授团队经过大量的筛选后的成果,其可以作为AAV2-retro的有力补充,成为一种强大的逆行病毒示踪工具。结合光纤光谱学In combination with fiber photometry,AAV11可以通过逆行递送钙敏感指示剂,在神经元特异性启动子或Cre-lox系统的控制下,监测功能网络中的神经元活动。此外,嵌入GfaABC1D启动子的AAV11在体内的星形胶质细胞趋向性优于AAV8和AAV5,结合双向多载体轴突-星形胶质细胞标记,AAV11可用于研究神经元与星形胶质细胞的连接。而且,团队通过携带IBA1启动子和miRNA-9靶向序列的AAV11证明了该血清型在多种脑区和脊髓中对小胶质细胞具有高转导特异性。
1,Zhu X, Lin K, Liu Q, et al. Rabies virus pseudotyped with CVS-N2C glycoprotein as a powerful tool for retrograde neuronal network tracing[J]. Neuroscience bulletin, 2020, 36: 202-216.
2,Han Z, Luo N, Ma W, et al. AAV11 enables efficient retrograde targeting of projection neurons and enhances astrocyte-directed transduction[J]. Nature Communications, 2023, 14(1): 3792.【点击查看相关推文】
3,Luo N, Lin K, Cai Y, et al. Microglia-specific transduction via AAV11 armed with IBA1 promoter and miRNA-9 targeting sequences[J]. bioRxiv, 2024: 2024.07. 09.602653.【点击查看相关推文】