单纯疱疹病毒(herpes simplex virus,HSV)是目前在临床使用最广泛的溶瘤病毒(oncolytic virus,OV)之一。HSV为双链DNA病毒,可编码84种不同多肽,其基因组长为152Kb。 HSV病毒基因按照其表达的时序性分为三个类别:早期或α基因、中期或β基因、晚期或γ基因。这些溶瘤基因编码蛋白可促进病毒的复制并引发宿主免疫反应[1]。病毒DNA复制和蛋白质合成导致癌细胞裂解,随后,子代病毒被释放以感染相邻的癌细胞,扩大对癌症的杀伤能力。
HSV可以通过局部(腹膜或胸膜灌注和肿瘤内注射)和全身途径(血管传递)发挥作用。肿瘤内注射可限制其只传送到肿瘤部位。一些物理障碍如细胞外基质和针对HSV的宿主免疫应答反应会抑制病毒复制。
图1、单纯疱疹病毒1型(HSV-1)模式图
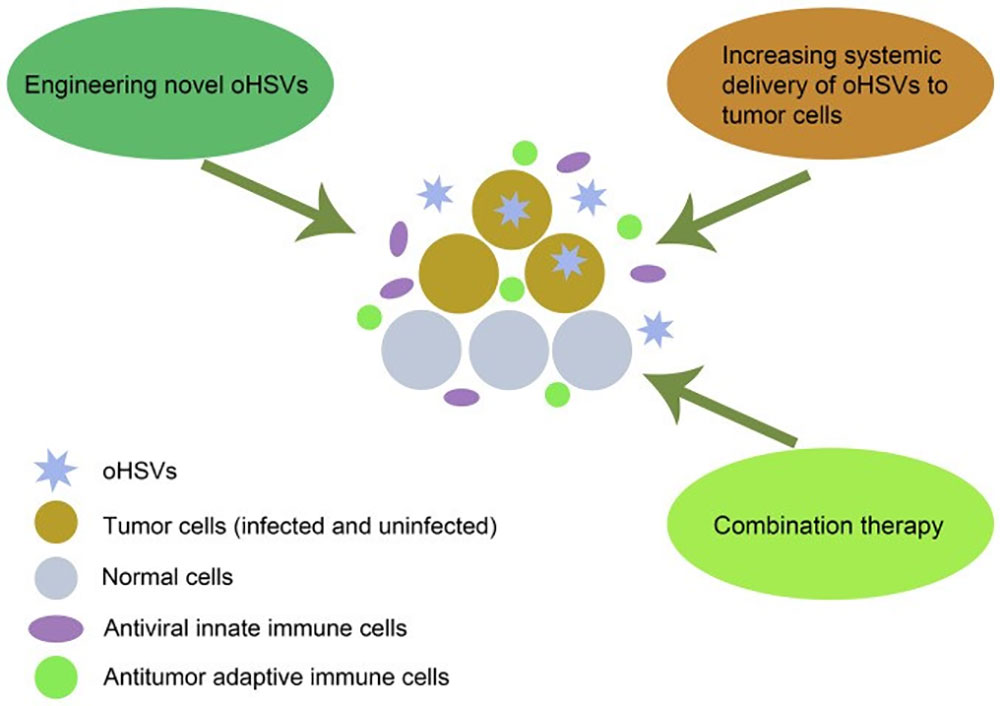
图2:oHSVs破坏肿瘤细胞的机制示意图及提高其疗效的多种策
oHSV通过选择性地在肿瘤细胞中复制并逃避抗病毒免疫来直接破坏肿瘤细胞,并刺激抗肿瘤免疫反应,这是oHSV杀死癌细胞的主要机制。多种策略可以提高oHSV在肿瘤治疗中的疗效,包括设计新型 oHSV、增加oHSV向肿瘤细胞的全身递送和联合治疗。
2015年,经美国食品和药物管理局(FDA)批准,用于治疗黑色素瘤的talimogene laherparepvec(T-VEC)是对HSV-1基因改造后形成的有效临床治疗药物,也是OV应用于临床的重大突破[5-6]。T-VEC的正式名称为OncovexGM-CSF,是HSV-1的基因工程改造毒株,其缺失了两个拷贝的ICP34.5基因和ICP47编码基因,插入了人粒细胞集落刺激因子(granulocyte-macrophage colonystimulating factor,GM-CSF)编码基因。OncovexGM-CSF通过直接肿瘤溶解和诱导肿瘤特异性再次免疫应答发挥抗肿瘤作用,包括增强抗原特异性T细胞应答、抑制CD4+Tregs、CD8+Ts和骨髓来源的抑制性免疫细胞(MDSCs)的水平[7,8]。
2021年,第三代溶瘤性单纯疱疹病毒载体G47Δ被日本厚生劳动省(WHLW)批准用于治疗胶质瘤。为提高其抗肿瘤活性,敲除了ICP34.5基因以消除病毒的神经毒性,敲除了312bp的α47基因以提高病毒的复制和繁殖能力[9-10]。同时,将ECOL-I LacZ基因插入ICP6(UL39)区域使核苷酸还原酶(RR)失活,让病毒仅在肿瘤细胞中繁殖,从而改善其溶瘤作用[9]。G47Δ在多种癌症中显示出很强的复制能力,有效诱导特异性抗肿瘤免疫,并显示出高安全性[10]。
目前,HSV的基因修饰大部分都基于ICP6基因(UL39)失活和ICP34.5基因缺失[12]。ICP6蛋白是对病毒DNA复制而言必不可少的核糖核苷酸还原酶的大亚基。ICP6突变的HSV只能在快速分裂的细胞如肿瘤细胞中复制,可提高其肿瘤靶向性。病毒基因ICP34.5是HSV中的主要神经毒性基因[11]。作为遗传修饰的结果,ICP6/ICP34.5缺失的HSV对正常组织具有低致病性,对肿瘤细胞具有高的溶瘤能力[15]。
目前,HSV-1的基因设计一般采用病毒株或含有病毒基因组的质粒,通过同源重组技术或细菌人工染色体(bacterial artificial chromosome, BAC)技术进行多轮重组以获得目的病毒。
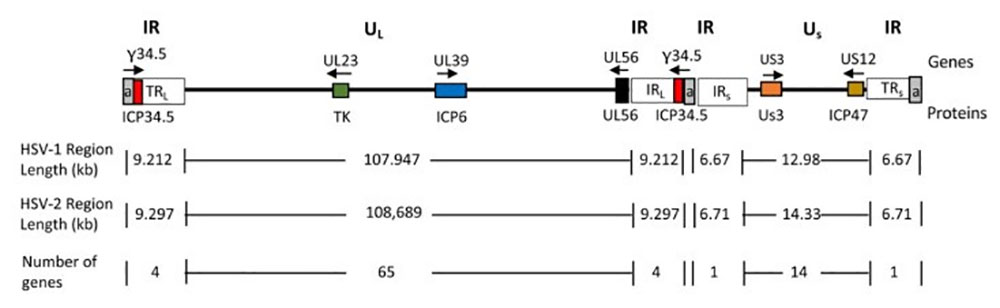
图3、HSV基因组示意图 doi:10.3390/v13091740
序列重复的次数(a,灰色)是可变的。与肿瘤特异性相关的基因显示为彩色框,其名称显示在基因组线上方;基因产物名称显示在基因组线下方。箭头指示转录方向。
布林凯斯Brain Case专注于工具病毒载体研究及转化医学研究。基于多年积累的基因治疗研发经验,在溶瘤病毒载体领域建立了质粒、细胞治疗、基因治疗、载体改造,病毒制备,药效实验等研究平台。目前布林凯斯可以为全球客户提供腺病毒(Adenovirus)、牛痘病毒(Vaccinia Virus)、单纯疱疹病毒(Herpes Simplex Virus)、水疱性口炎病毒(Vesicular Stomatitis Virus)等溶瘤病毒的构建及药效服务。