
替代或编辑致病突变对治疗许多人类疾病有着巨大的希望,然而在体内向特定细胞传递治疗性基因修饰物一直具有挑战性,特别是在大面积的、分散的组织中,如骨骼肌。
2021年9月,美国布罗德研究所团队与哈佛大学团队合作在Cell上发表了“Directed evolution of a family of AAV capsid variants enabling potent muscle-directed gene delivery across species”一文,开发出一个新的腺相关病毒(AAV)家族作为基因递送载体用于基因治疗。
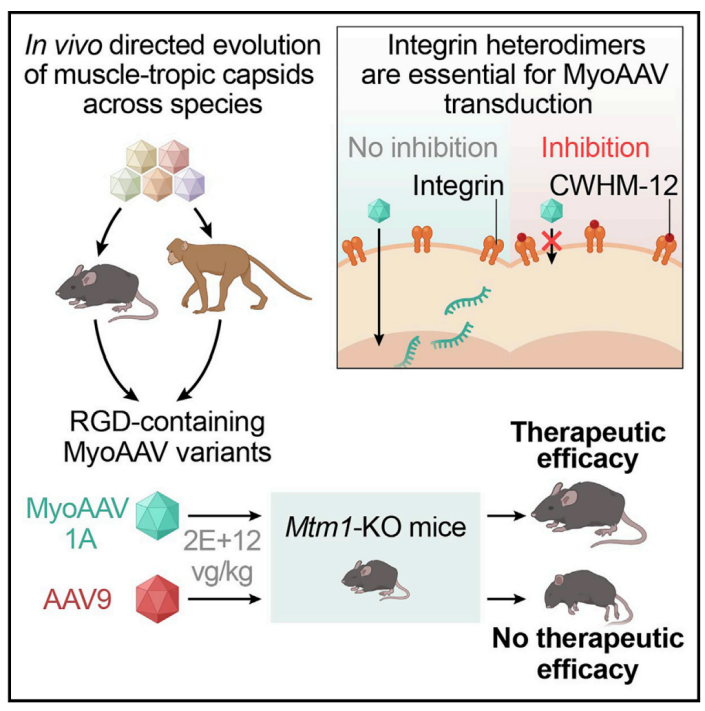
研究人员建立了一种体内策略来进化和严格选择AAV的衣壳变体,这些变体能够有效地递送到所需的组织。使用这种方法,研究人员确定了一类含有RGD基序的衣壳,在小鼠和灵长类动物体内定向进化出一种工程化改造的AAV载体—MyoAAV,在小鼠和非人类灵长类动物静脉注射后,能够高效靶向肌肉组织,递送到肌肉组织的效率是传统病毒载体的10倍以上。同时,与传统递送载体相比,该载体在遗传性肌肉疾病中的治疗剂量降低大约100到250倍,这一研究成果极大地减少了肝脏损伤和其他严重副作用的风险。
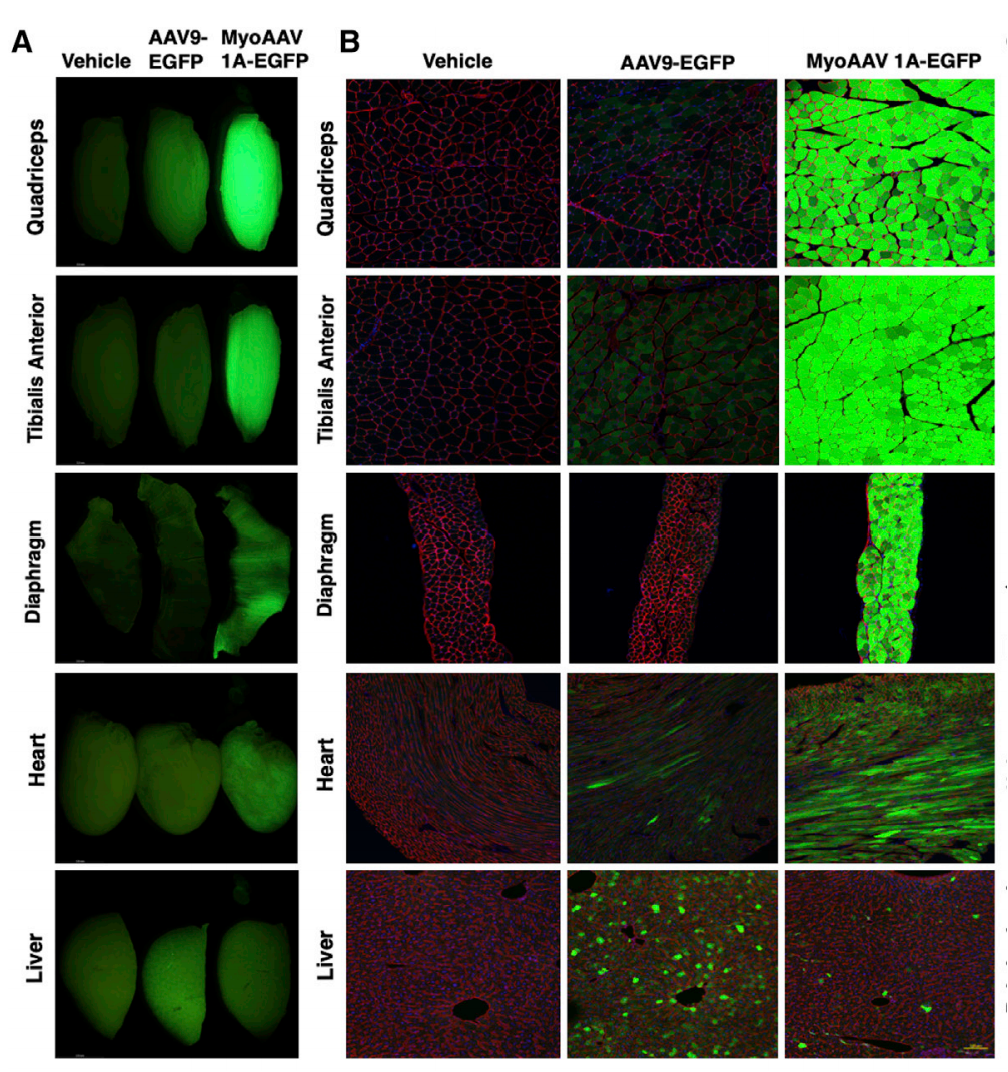
MyoAAV 1A在全身注射后能高效地转导小鼠骨骼肌,将成年C57BL/ 6J小鼠注射1E+12 vg(~4E+13 vg/kg)AAV9-或MyoAAV 1A-CMV-EGFP,并分析注射2周后不同组织中的转基因表达和载体基因组丰度。整体荧光成像结果显示,与注射aav9的小鼠相比,注射MyoAAV 1A的小鼠肌肉中的荧光强度更强,重要的是,MyoAAV 1A转导的心脏比AAV9更有效,而心脏是许多遗传性肌病中更重要的受影响的器官。免疫荧光分析进一步证实注射MyoAAV 1A小鼠肌纤维和心肌细胞中转基因表达很强。
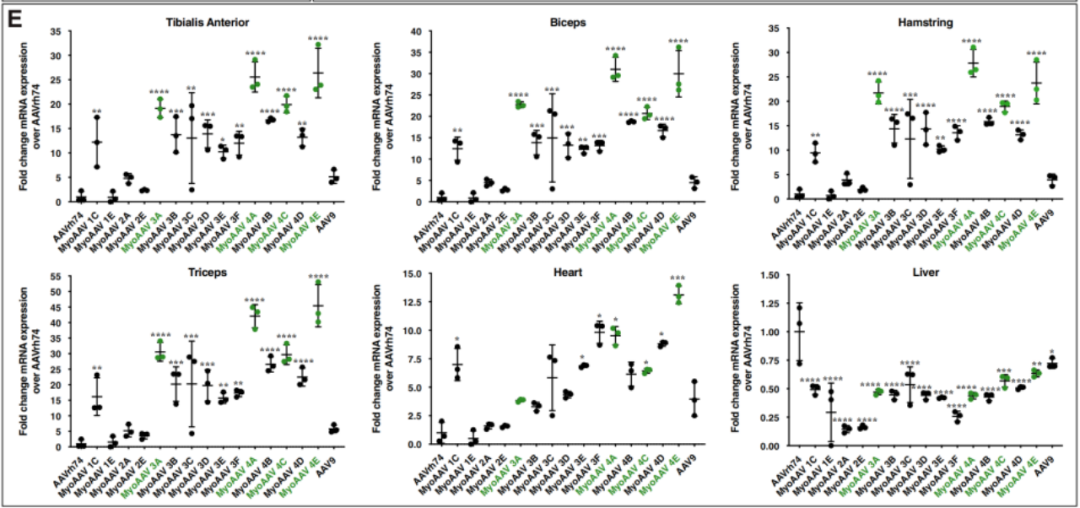
作者在NHPs筛选出11个对肌肉组织有最高度嗜性的突变体:MyoAAV 3A-F and MyoAAV 4A-E,并在小鼠和NHPs中对这些突变体的转导效率进行了测试。

基因mRNA的定量分析结果显示,与AAVrh74和AAV9相比,MyoAAV 4A、MyoAAV 4E、MyoAAV 3A和MyoAAV 4C四种突变体在NHP骨骼肌中转导效率最高,在小鼠胫骨前肌、二头肌、腘绳肌、三头肌、心脏等肌肉组织中也有很高的转导效率,并且不在肝脏中富集。
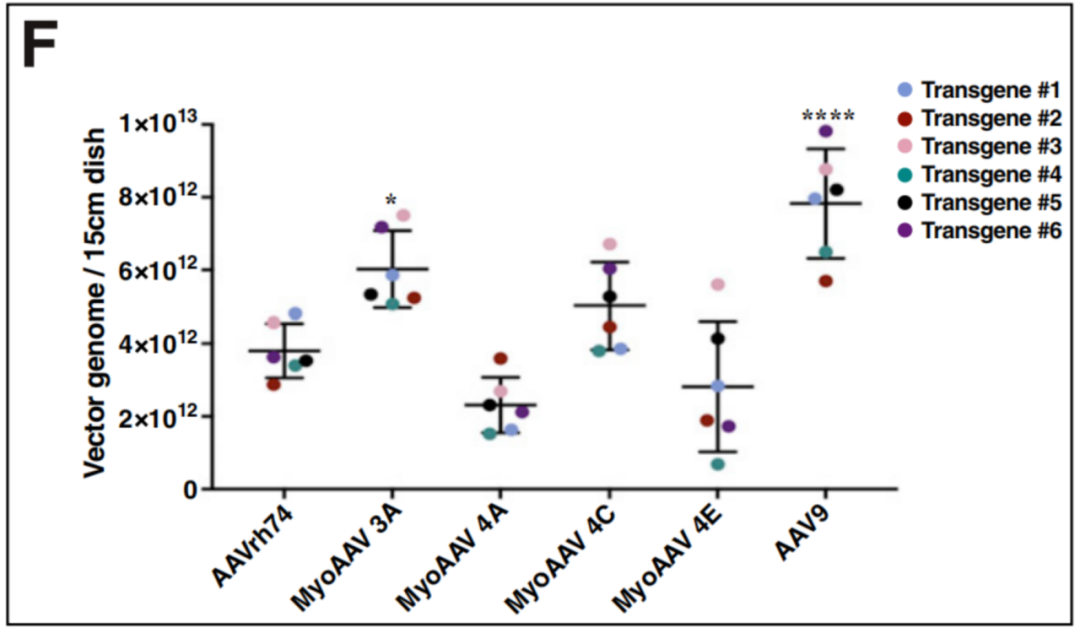
作者又评估了这四种突变体的产量,用MyoAAV 3A、4A、4C和4E,以及AAVrh74和AAV9分别制备了6种不同基因过表达的rAAVs病毒,结果显示AAV9在HEK293细胞中得到最高的滴度,所有MyoAAV变体与AAVrh74产生相似或更高的病毒滴度。
布林凯斯MyoAAV 4A、4E系列产品即将上线!这款产品在高效传导肌肉组织的同时极大地降低了副作用带来的风险。与此同时,该系列产品可根据您的实验需求进行特别定制。如果您对MyoAAV 4A、4E系列产品感兴趣,可以联系小布了解详情或下单订购。