伪狂犬病毒(PRV)广泛应用于示踪跨多个突触的神经环路。通过将PRV注射到外周部位,如心脏、胃肠道和肝脏,可以追踪到调控这些部位的大脑核团。此外,PRV也可以直接注射在中枢神经系统,用来示踪多突触神经环路。然而,由于病毒感染多个不同的神经元,传统方法无法准确识别特定神经元的输入信息,特别是那些表达特定神经递质、神经肽或受体的神经元。
为解决这一挑战,Brain Case推出了PRV-805(PRV-△TK-DIO-mCherry),一款创新的逆行示踪病毒。PRV-805仅在表达Cre重组酶的神经元和与起始细胞有突触连接的神经元中复制,并通过表达红色荧光蛋白标记这些神经元,精准示踪特异性神经元的输入。
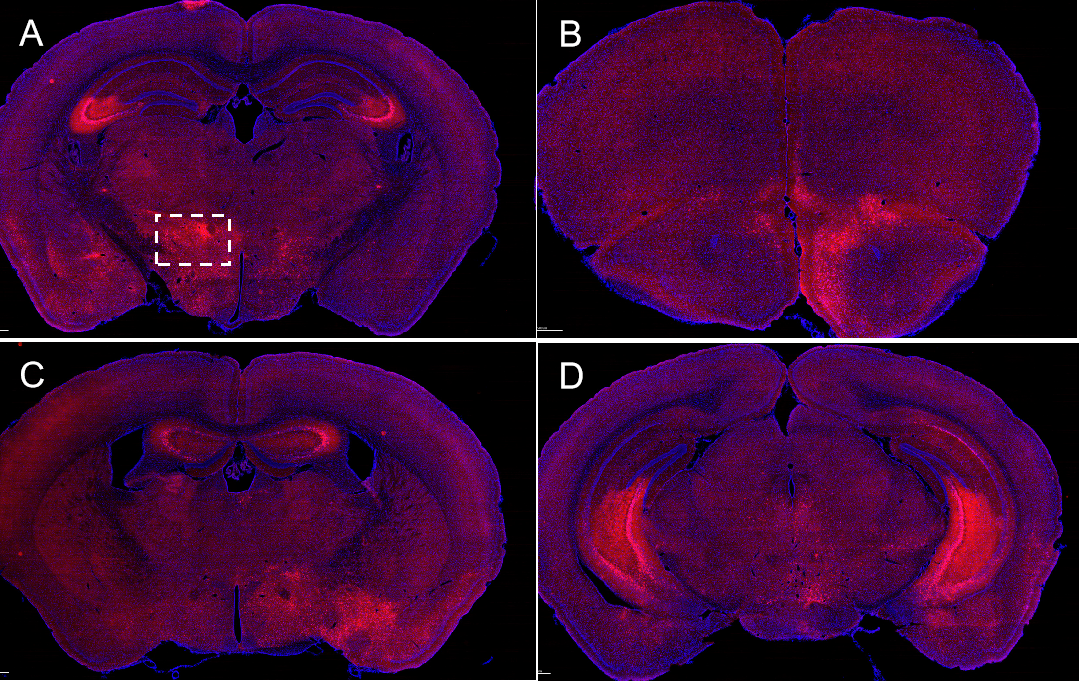
图1 PRV805在Vgat-cre小鼠中的逆向标记效果图
内部测试数据显示:将PRV805注射在Vgat-cre小鼠的下丘脑,2天后灌流取材,荧光成像结果显示注射位点及海马、杏仁核、内侧隔核、中缝背核、终纹床核等脑区有红色荧光信号(图1);而在C57鼠上则未检测到荧光信号,证明PRV-805实现了起始神经元特异性的逆向跨多突触示踪。这一创新技术将在神经科学研究中带来更精准的神经回路解析,助力探索复杂的脑部功能。
2001年加州大学霍华德·休斯医学研究所Jeffrey M. Friedman团队在Science(IF = 44.7)杂志上发表题为“Virus-Assisted Mapping of Neural Inputs to a Feeding Center in the Hypothalamus”的研究论文,研发了一种可用于逆行示踪特异性神经元的伪狂犬病毒PRV-Ba2001,该病毒编码一种绿色荧光蛋白标记物,仅在表达Cre重组酶的神经元和与起始细胞有突触连接的神经元中复制。在PRV基因组中创建了一个双顺反子,其中CMV被克隆到Tau-GFP融合基因的上游,紧接着是一个内部核糖体进入位点(IRES),位于内源性胸苷激酶(TK)基因的5'端。在CMV启动子和Tau-GFP开放阅读框起始点之间插入一个Lox-Stop-Lox序列,两个LoxP位点之间包含一个SV40 polyA转录终止子,没有Cre重组酶的情况下,它会阻止下游序列的表达。因此,TK和GFP的表达需要Cre重组酶介导。将病毒注射到神经肽Y神经元特异性Cre鼠(NPY-Cre鼠)弓状核中,大脑切片显示这些神经元接收下丘脑、杏仁核、皮层和大脑其他区域的神经元的输入。
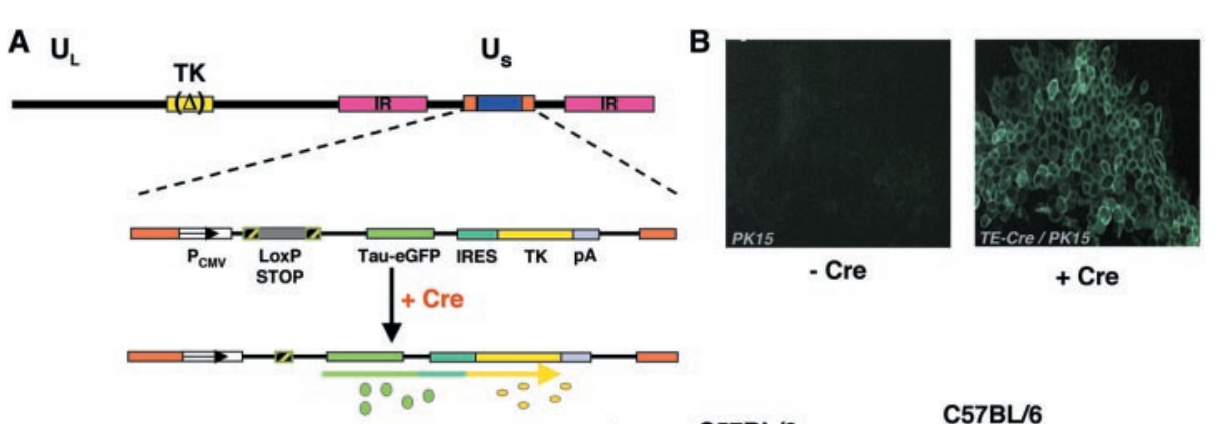
图2 PRV-Ba2001的结构和表达特性
2022年2月1日,美国国立卫生研究院的Sushil G. Rane团队在Cell Metabolism(IF = 27.7)杂志上发表了一篇题为“A distinct hypothalamus-to-b cell circuit modulates insulin secretion”的研究论文,开发了一款新的Cre依赖PRV病毒——PRV-Ba2017。与上一代Cre依赖的逆行示踪剂Ba2001相比,Ba2017表现出更好的遗传稳定性和更高的表达效率。基因编码序列包含CAG启动子,LoxP位点,SV40 polyA转录终止子,Lox2272位点,倒置的TK序列,倒置的绿色荧光蛋白EGFP序列,倒置的LoxP和Lox2722位点,WPRE转录后调节序列和BGH polyA转录终止子。为了减少在没有Cre酶的情况下泄漏表达,作者利用了DIO/FLEX系统,引入两对不同的Lox位点(LoxP和Lox2272)。将Ba2017注射到胰腺β细胞特异性Cre鼠(Ins1-Cre鼠)的胰管中,结果显示在胰腺外分泌部、脊髓、脑干和PVN细胞可以检测到绿色荧光信号。
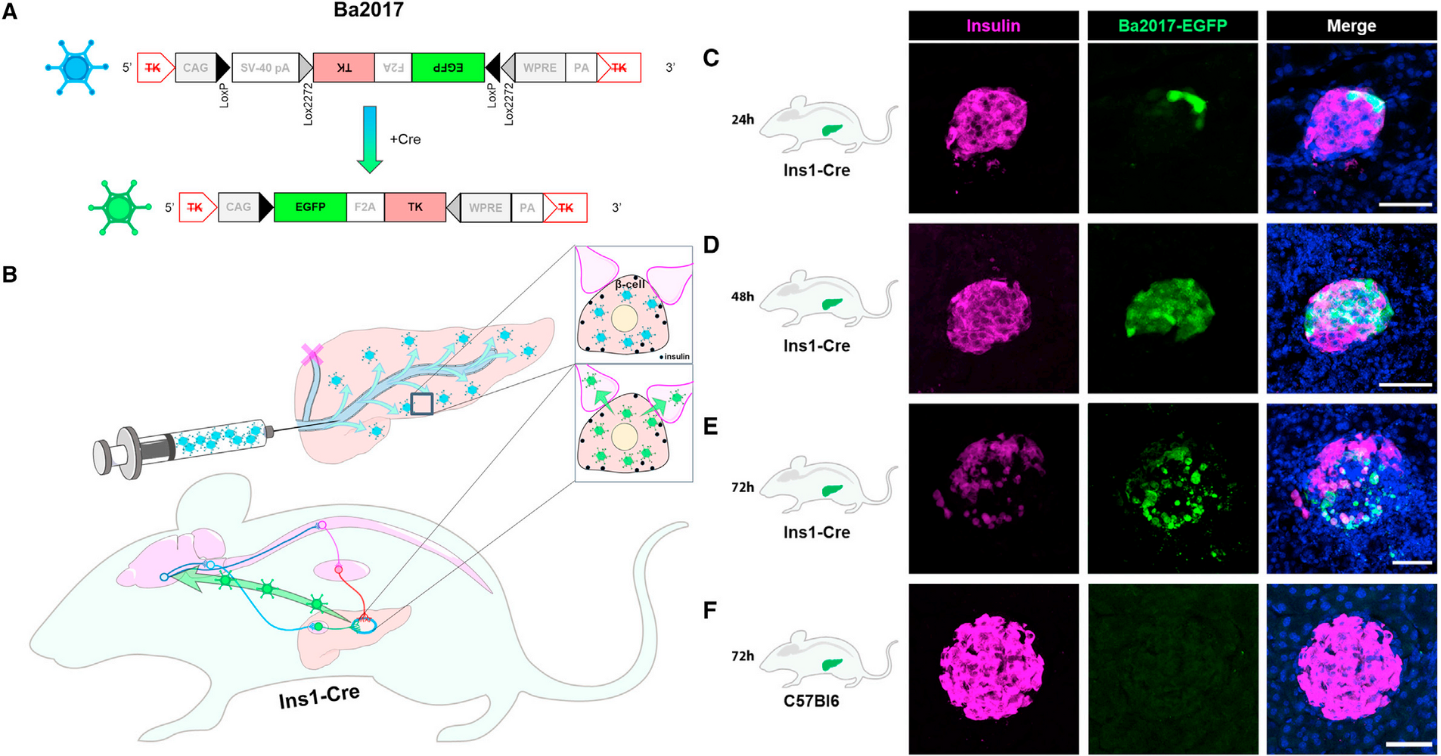
图3 用PRV-Ba2017感染Ins1-Cre鼠的胰岛β细胞
1、某客户成功在Cre转基因鼠的脊髓中注射PRV-805,示踪效果清晰可见,展示了PRV-805在中枢神经系统中的高效示踪能力(图4)。
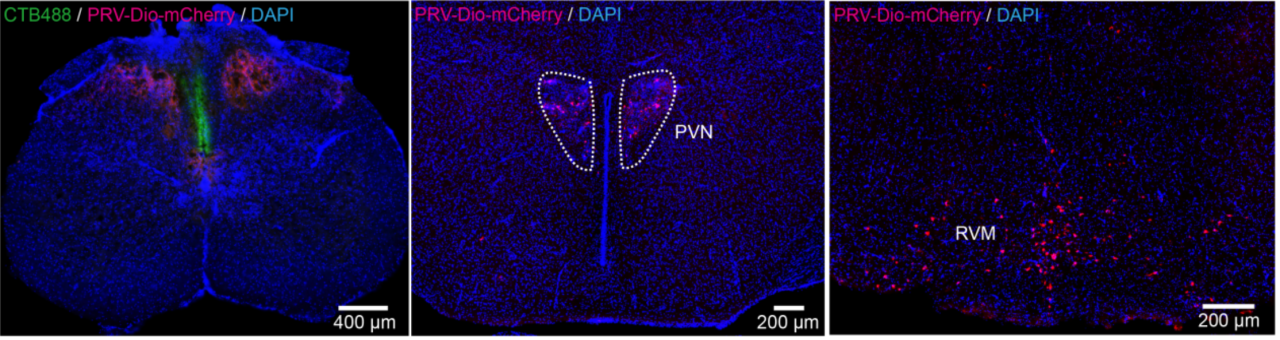
图4 Cre转基因鼠脊髓注射PRV805示踪效果图
2、某客户在Cre转基因鼠的舌部注射PRV-805,成像结果显示PRV-805在周围神经系统中表现出良好的示踪效果,进一步验证了其广泛的应用潜力(图5)。
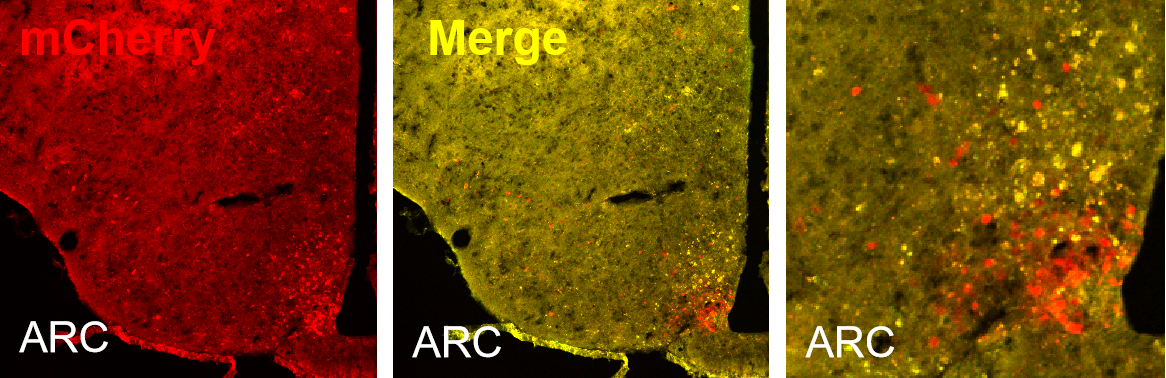
图5 Cre转基因鼠舌部注射PRV805示踪效果图
3、某客户在Cre转基因鼠的关节腔注射1.5-2.5μL PRV-805,表达时间为6天和7天,但成像结果显示中枢神经系统未检测到示踪信号。具体原因尚不明确,可能与注射部位、剂量或表达时间有关,可以进一步优化实验条件。
PRV-805在脊髓和舌部注射中表现出优异的Cre依赖逆向跨多突触标记效果,但在关节腔注射中可能存在一定的局限性,建议根据具体实验需求调整注射方案。
客户使用反馈的同批次产品仍有少量现货,现特别开放15个优惠名额,数量有限,先到先得!如需了解更多详情或申请优惠,请立即联系您当地的销售工程师!