小胶质细胞与人类健康以及各种CNS疾病的发病机制密切相关,已成为神经科学的热点研究方向。当前对于小胶质细胞的研究多依赖于构建转基因小鼠模型,以此将外源基因或遗传修饰导入小胶质细胞,然而,这种方法不仅耗时耗力、成本昂贵,而且无法转化为实际治疗策略。在众多工具病毒载体中,重组腺相关病毒(rAAV)由于安全性高等优势已被广泛用做神经科学研究的示踪工具及基因治疗给药载体,种类繁多的血清型赋予其多样的组织靶向感染特性,然而允许高效特异转导小胶质细胞的AAV载体较为罕见。
中科院徐富强/林坤章团队于2024年7月份发表在预印版BioRxiv上题为“Microglia-specific transduction via AAV11 armed with IBA1 promoter and miRNA-9 targeting sequences”的文章报道了携带mIBA1启动子和miRNA-9靶向序列的各种腺相关病毒(AAV)载体在转导尾状核(CPu)脑区的小胶质细胞中的特异性和效率,发现AAV11介导了对小胶质细胞更特异性和高效的转导,并且AAV11在不同脑区以及脊髓内对小胶质细胞也展现出了高转导特异性。最后,通过减少注射剂量,AAV11允许对小胶质细胞进行了精细的结构标记。这项工作为小胶质细胞研究提供了一个有力的工具。

首先,评估四种不同的AAV在成年小鼠大脑内转导小胶质细胞的特异性和效率,这些AAV配备了mIBA1启动子和miRNA-9靶向序列。注射剂量为2×10^9(VG),体积为200 nL(图1A)。三周后,收集大脑组织并切片并进行免疫荧光染色(图1B)。为了评估这些AAVs感染的细胞类型特异性,作者统计分析了EGFP和小胶质细胞标记IBA1的共定位(图1C)。为了评估AAVs在小胶质细胞上的转导效率,对标记小胶质细胞的数量(图1D)进行统计。所有这些AAVs在IBA1阳性细胞中介导了强大的EGFP表达,但特异性和效率水平不同(图1B-D)。对EGFP和IBA1双阳性细胞的定量分析表明,AAV11对纹状体区域内小胶质细胞的特异性(约98.9%,图1C)和效率(约947个细胞,图1D)最高。
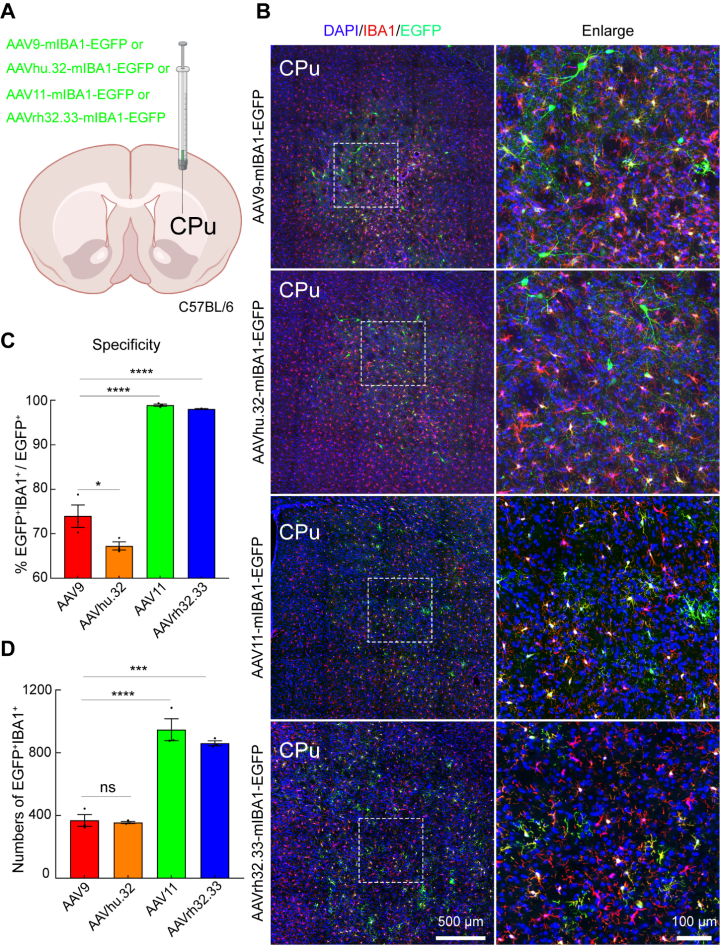
图1 体内筛选高效转导小胶质细胞的AAV
为了验证AAV11能否高效地转导DG脑区的小胶质细胞。将AAV11注射到大脑的DG区域,剂量为2×10^9(VG)(图2A)。三周后,收集大脑组织并切片并进行免疫荧光染色(图2B)。AAV11在海马体DG区域内的小胶质细胞中展示了强大的转导能力(图2B和2C)。对EGFP和IBA1双阳细胞的定量分析表明,AAV11主要转导小胶质细胞,特异性约为97%(图2D)。
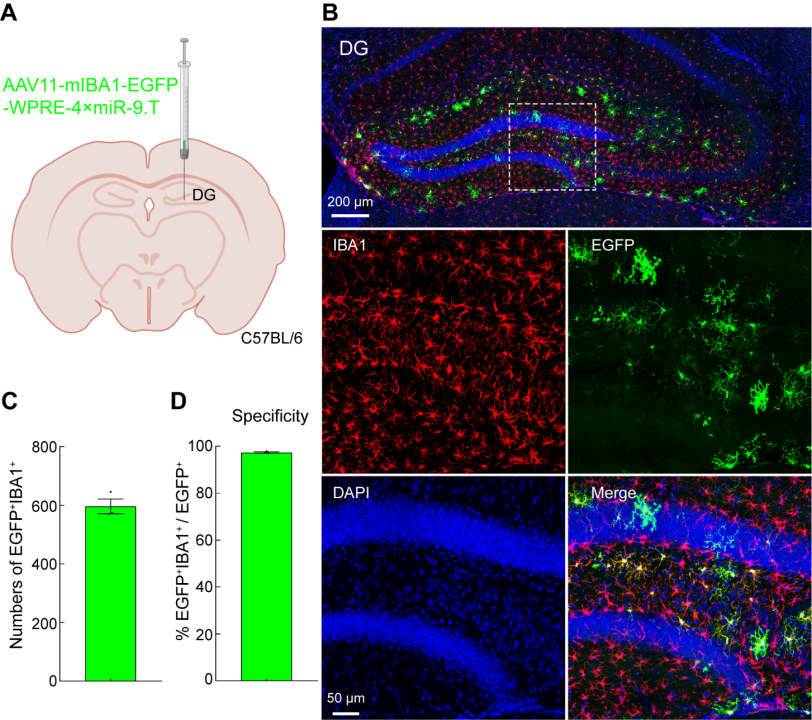
图2 AAV11高效特异转导DG脑区小胶质细胞
为了验证AAV11能否高效地转导SNr脑区的小胶质细胞。将AAV11注射到小鼠的SNr脑区,注射剂量2×10^9(VG)(图3A)。三周后,收集大脑组织并切片并进行免疫荧光染色(图3B)。在SNr中,可以观察到大多数小胶质细胞被绿色荧光标记(图3B和3C)。荧光共定位分析表明,AAV11在SNr小胶质细胞中介导的基因表达具有大约90%的特异性(图3D)。
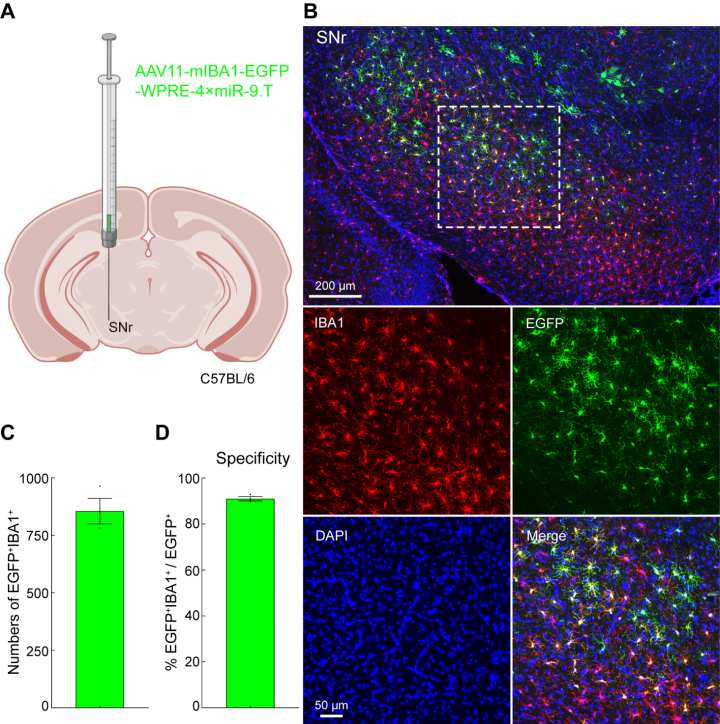
图3 AAV11高效特异转导SNr脑区小胶质细胞
脊髓小胶质细胞在脊髓损伤修复、炎症反应调节、疼痛产生以及潜在治疗策略的发展中扮演着极其重要的角色。因此,有必要开发针对脊髓小胶质细胞的基因递送系统。作者探究了AAV11能否高效地转导脊髓中的小胶质细胞。将AAV11注射到脊髓的腰椎段,剂量5×10^9(VG)(图4A)。三周后,收集脊髓组织并切片并进行免疫荧光染色(图4B)。对EGFP和IBA1双阳性细胞的定量分析表明,AAV11在脊髓内的小胶质细胞中具有强大的转导能力,特异性约为80%(图4B和4C)。
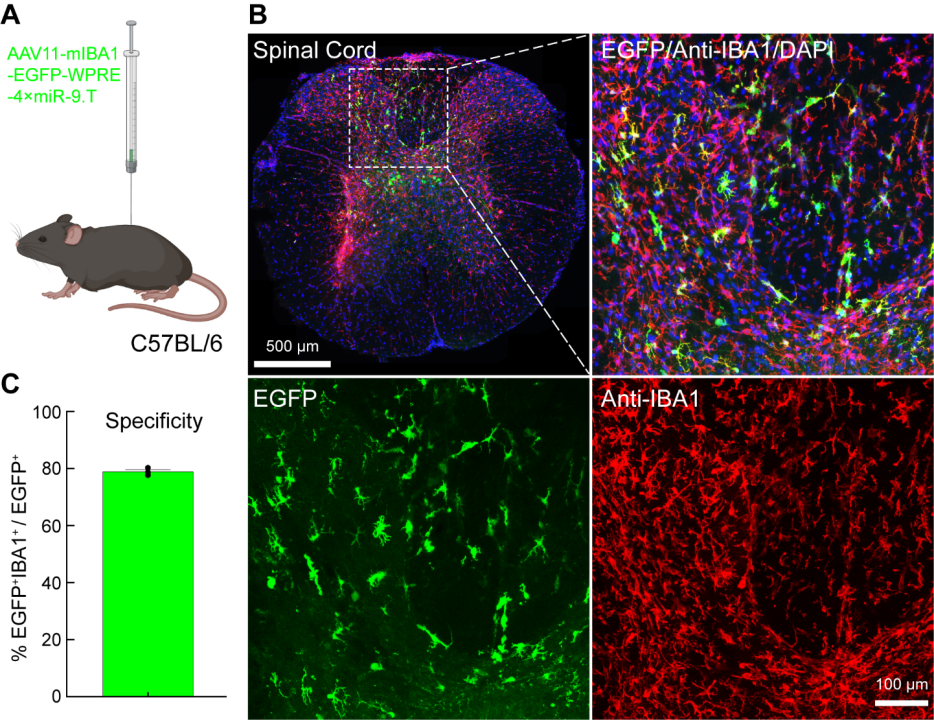
图4 AAV11高效特异转导脊髓小胶质细胞
小胶质细胞的复杂形态对其在大脑中的功能至关重要。小胶质细胞具有变化复杂的过程,并且在不同的生理或疾病状态下可以经历形态变化。标记小胶质细胞的细微形态是理解它们在不同状态下的变化及其与其他神经细胞相互作用的先决条件。然而,用于研究哺乳动物大脑中小胶质细胞细微形态的简单且通用的标记方法仍然缺乏。在这里,通过减少病毒注射量(50nL),以5×10^8(VG)的剂量在海马体的齿状回区域注射了AAV11(图5A)。三周后,收集大脑组织并切片并进行免疫荧光染色(图5B)。作者发现通过减少注射剂量,AAV11能够在海马体齿状回脑区稀疏标记小胶质细胞(图5B)。通过激光共聚焦扫描,可以清晰地观察到小胶质细胞的精细形态结构(图5C)。因此,AAV11可以用于稀疏标记小胶质细胞以分析它们的精细结构。
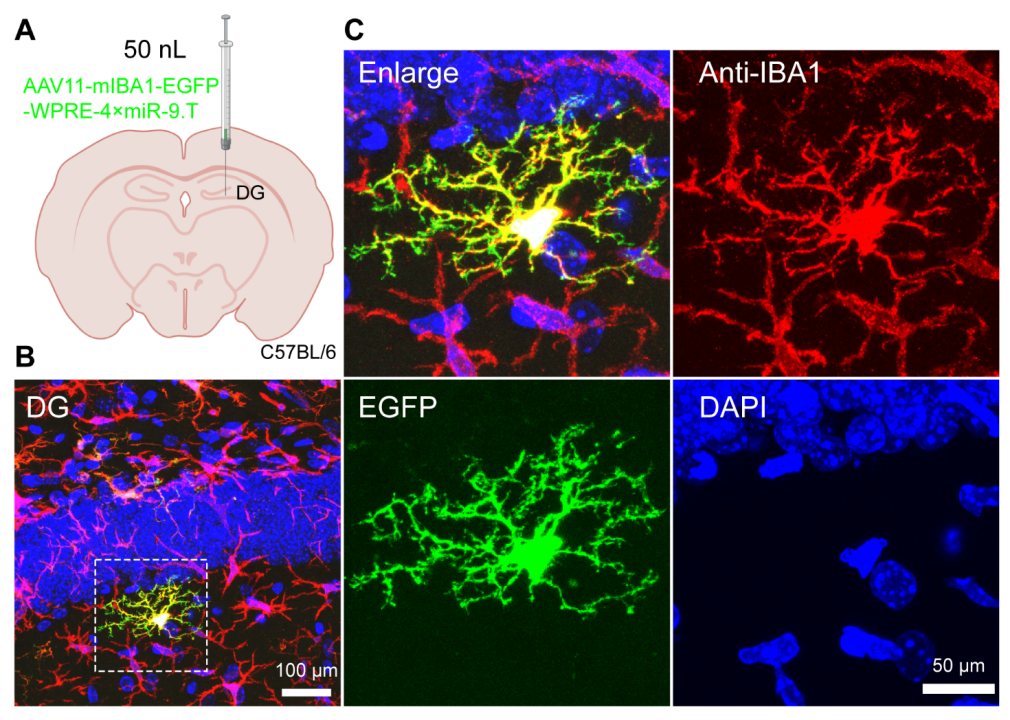
图5 AAV11稀疏标记小胶质细胞
我们通过直接注射含有IBA1启动子和一组针对miR-9的四个串联序列的AAV11,实现了成年小鼠特定脑区小胶质细胞的特异性转导。此外,我们还证明AAV11在不同的脑区和脊髓内对小胶质细胞也表现出高转导特异性。最后,通过减少注射剂量,AAV11可用于小胶质细胞的稀疏标记。这项工作为研究小胶质细胞的结构和功能提供了一种强大的病毒工具。
原文链接
https://www.biorxiv.org/content/10.1101/2024.07.09.602653v1