病毒示踪工具可以标记不同类型的神经元,并可以对神经元以及一个特定神经回路中的脑区进行功能调控。虽然PRV逆向跨多突触系统和RV逆向跨单突触系统已被证实在神经环路逆行示踪研究方面的重要价值,但是目前有效的可用的顺行跨突触示踪剂还很有限。现有的顺行示踪剂包括HSV-H129和编码Cre重组酶的腺相关病毒(AAV)血清型1,然而,每一种都有局限性:HSV-H129的神经元细胞毒性较大,不适于神经元的功能研究,如电生理等,而且HSV基因组大也不方便进行改造。
1.没法实现起始细胞的特异性
2.需要高剂量的病毒,这往往又会导致逆行标记和意外泄漏到附近区域
3.需要额外的报告系统,如cre-loxp系统,来放大信号以弥补较差的跨突触效率
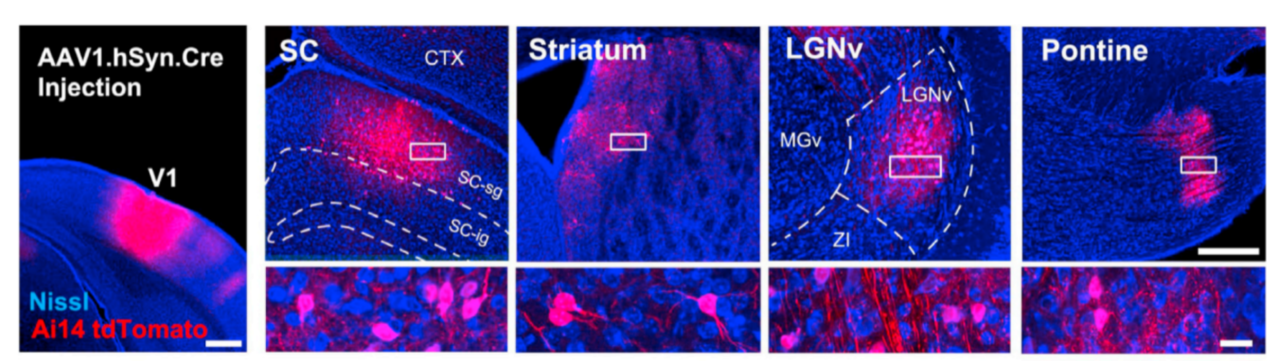
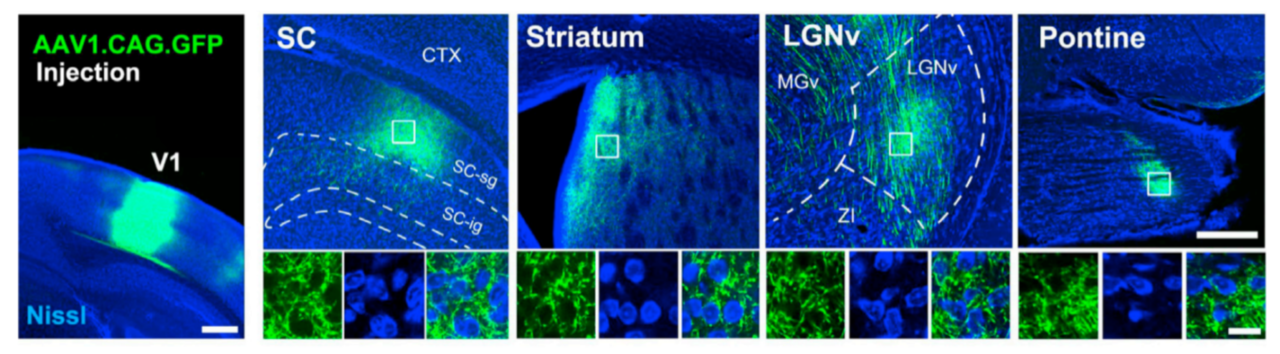
AAV1- CAG-GFP未能标记注射部位突触后脑区神经元胞体(PMID: 27989459)

2022年5月6日,加州大学旧金山分校研究者在Nature Neuroscience 杂志上发表了文章“Trans-Seq maps a selective mammalian retinotectal synapse instructed by Nephronectin”,该研究发明了一种名为Trans-Seq的技术平台开发出一种能够低毒、单一成分、跨单突触、可实现在体荧光成像的示踪剂--mWGA。作者首先在体内筛选了一种基于小麦胚芽凝集素(WGA)的荧光反式突触示踪剂,并获得了一个优化的结构,mWmC可以在视网膜和大脑回路中高效和特异性的跨单突触顺行示踪,mWmC用超异构荧光蛋白标记突触后神经元,能够直接进行连接处电生理学验证,相比于传统的WGA示踪剂有了实质性的突破。
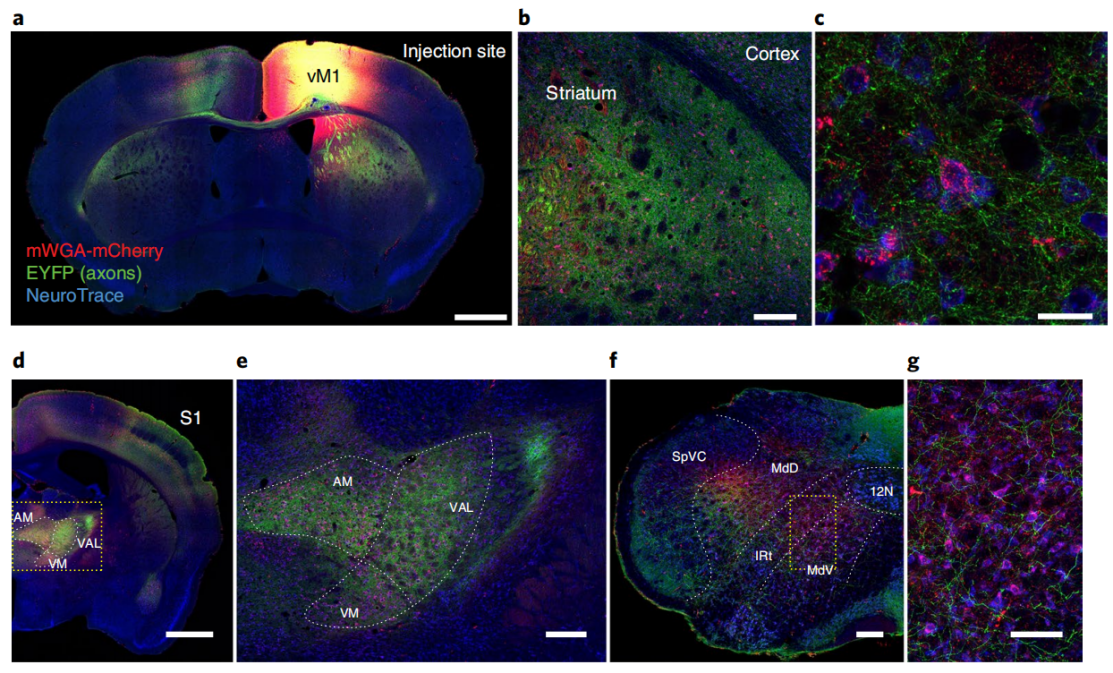
WGA及其密切相关的凝集素都表现出顺行跨突触的特性,植物来源的原始WGA示踪剂作为蛋白质应用时,表现出逆行转移的特性,推测可能是通过轴突末梢摄取实现的,并且顺行跨突触特性可以是多突触的。首先,作者合成一个哺乳动物密码子优化的cDNA(mWGA)来提高WGA在哺乳动物神经元中的表达。其次,研究了荧光蛋白融合到mWGA的N端或C端是否可以直接显示连接的神经元 (Fig. 1a,b)。最后,为了最大限度地提高与现有的RGC型绿色荧光蛋白(GFP)品系的兼容性,并识别高效的荧光蛋白融合构型,又合成了融合到红色荧光蛋白(RFP)变体上的mWGA构建物,包括mCherry、mRuby3和tdTomato(Fig. 1a,c)。
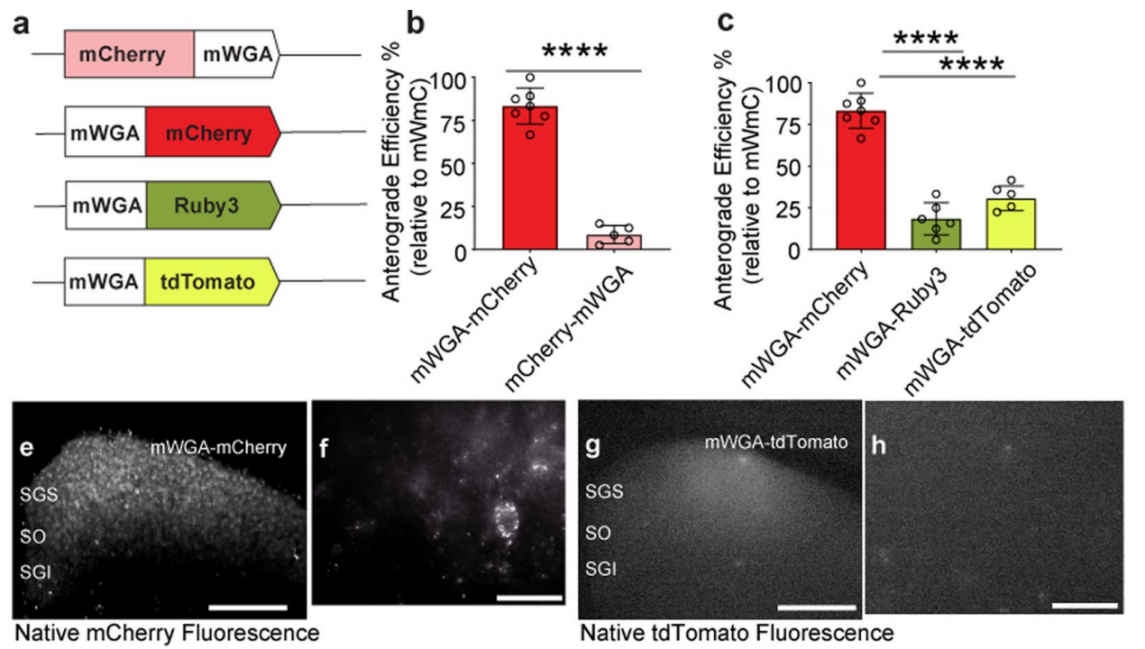
为了测试了mWGA顺行传导效率,将表达mWGA-RFPs的AAV2载体注射到小鼠左眼 (Fig. 2a),证实了主要标记RGC亚类(Fig. 2c,d)。通过天然荧光评估对侧SC上RFP阳性神经元的数量来评估顺行转移效率(Fig. 2e,f)。在急性SC脑切片中,还发现在相同的实验条件下,mWGA-mCherry(mWmC)结构比mCherry-mWGA具有更高的顺行转移效率(Fig. 1a,b)。
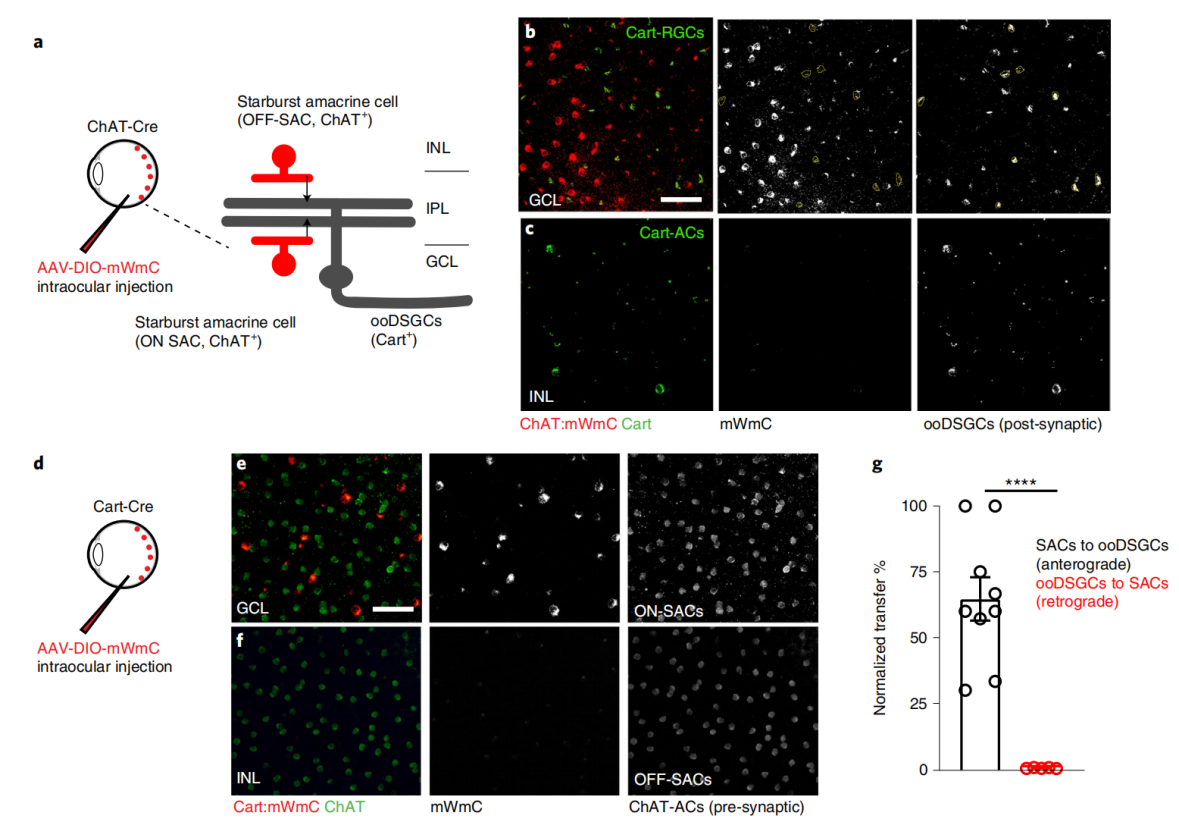
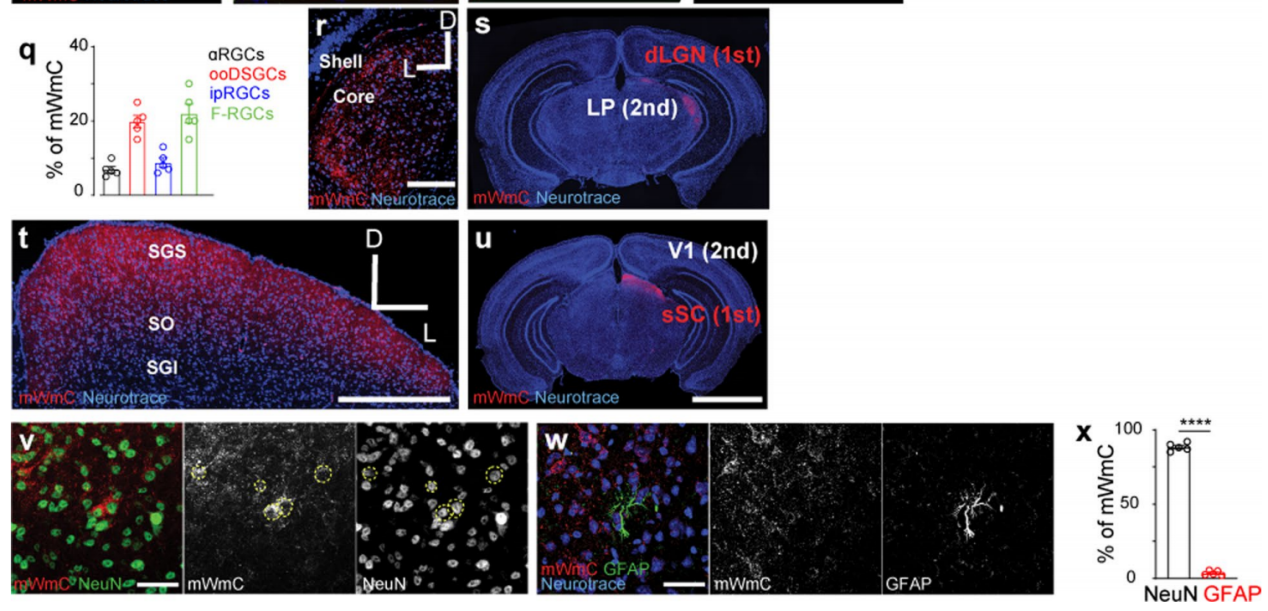
顺行示踪mWmC主要标记视网膜神经节细胞的脑内视网膜投射区域SC神经元和少量星形胶质细胞 (Fig. 3v-x)。除SC外(Fig. 3t,u),视网膜投射区域的实时荧光信号也很明显,如背外侧膝状核dLGN (Fig. 3r,s),然而在视网膜神经节细胞投射的第二级脑区如初级视觉皮层(V1)和丘脑外侧后核(LP)没有荧光信号(Fig. 3u,s)。这些结果表明mWmC主要通过跨单突触发生转移。
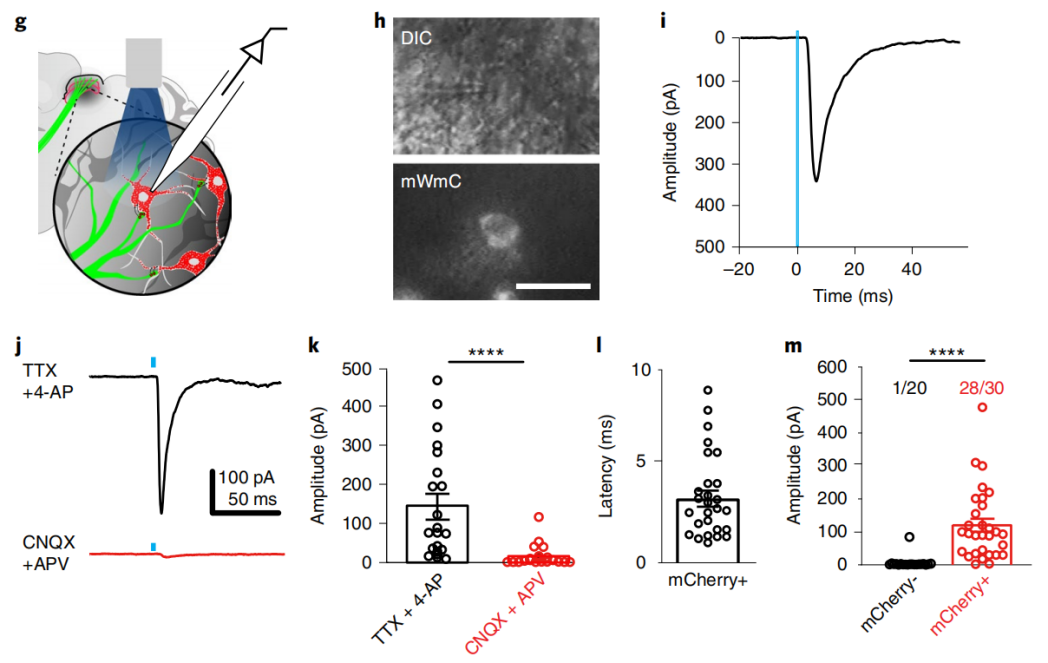
利用全细胞记录来测试mWmC+ SC神经元是否接收到来自RGCs的直接突触输入,发现93%的mWmC+神经元接收到单突触输入(Fig. 4m)。结合功能研究,在河豚毒素(TTX)和4-氨基吡啶(4-AP)存在的情况下,诱发的EPSCs持续存在,但是能被谷氨酸受体阻断剂CNQX和APV阻断,证实了突触连接是单突触和谷氨酸能的(Fig. 4j,k).。mWmC示踪剂不仅可以直接检测RGC突触后的SC神经元,而且在体内表现出较低的细胞毒性。
mWGA-mCherry是一种广泛适用的顺行跨突触示踪剂,携带明亮的红色荧光标记神经元,能实现突触前神经元特异性网络示踪,并与活体功能研究兼容,包括电生理学记录和荧光激活细胞分类术。mWmC在溶酶体富集的特性使其高效和特异性地标记单突触连接的神经元;另外,mWmC从内溶酶体逃逸的效率较低,导致mCherry荧光在细胞内积累,这可能是标记神经元产生高信噪比的关键。基因编码的mWmC存在少量的逆行扩散,将WGA严格限制在注射部位的起始细胞上有利于减少逆行标记。